Mutante de factor estimulante de colonias de granulocitos (G-CSF) y polipéptido conuugado químicamente del mismo.
Mutante conjugado de un G-CSF humano, comprendiendo el mutante la secuencia de aminoácidos identificada en SEQ ID NO:
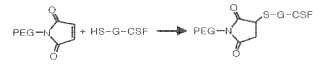
3, en el que un residuo de treonina (Thr) en la posición 133 de G-CSF que comprende la secuencia de aminoácidos identificada en SEQ ID NO:1 se sustituye por un residuo de cisteína (Cys), y el residuo de Cys sustituido se une a un compuesto químico no proteico, para su uso en la inhibición de la leucocitopenia o para su uso como adyuvante en el tratamiento del cáncer.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2006/002841.
Solicitante: MOGAM BIOTECHNOLOGY RESEARCH INSTITUTE.
Nacionalidad solicitante: República de Corea.
Dirección: 341 POJUNG-DONG, KIHEUNG-KU YONGIN-SI, KYONGGI-DO 446-799 REPUBLICA DE COREA.
Inventor/es: KANG,Kwan-Yub, HONG,Jeong-Woon.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K47/48
- C07K14/535 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › CSF de granulocitos; CSF de granulocitos-macrófagos.
PDF original: ES-2381256_T3.pdf
Fragmento de la descripción:
Mutante de factor estimulante de colonias de granulocitos (G-CSF) y polipéptido conjugado químicamente del mismo.
Campo de la invención
La presente invención se refiere a un mutante de factor estimulante de colonias de granulocitos humano (G-CSF) y a un conjugado químico del mismo como adyuvante en el tratamiento del cáncer para inhibir la leucocitopenia estimulando la formación de colonias de granulocitos neutrófilos a partir de células de médula ósea cuando se administra un fármaco anticancerígeno, e induciendo la diferenciación de las células de médula ósea hasta el estadio final, y más particularmente, a un mutante de factor estimulante de colonias de granulocitos humano (G-CSF) modificado mediante sustitución de un aminoácido en un sitio específico en el G-CSF y un conjugado químico del mismo con un polímero no proteico tal como polietilenglicol (PEG) .
Técnica anterior
Las actividades hematopoyéticas humanas se llevan a cabo principalmente en la médula ósea y se producen diversas clases de células sanguíneas a través de una variedad de rutas complejas. Las actividades hematopoyéticas están controladas por glicoproteínas específicas, que se denominan generalmente factores estimulantes de colonias (CSF) . Los CSF se han identificado y distinguido según sus actividades. Es decir, los CSF, que sirven como factores de crecimiento cuando se cultivan células sanguíneas en medios semisólidos, estimulan la formación clonal de monocitos, granulocitos u otras células hematopoyéticas. Por ejemplo, el CSF de granulocitos (G-CSF) y el CSF de macrófagos (M-CSF) estimulan la formación in vitro de colonias de granulocitos neutrófilos y macrófagos, respectivamente mientras que CSF múltiple, también conocido como interleucina-3 (IL-3) , estimula la proliferación clonal de diversos tipos de células sanguíneas y de tejidos, tales como granulocitos, macrófagos, megacariocitos, glóbulos rojos o similares.
Específicamente, se sabe que el G-CSF, que es una citocina de instrucción de la división y diferenciación de células madre intermedulares y leucocitos fuera de la médula ósea, fomenta la actividad fagocítica de los neutrófilos estimulando la diferenciación y/o proliferación de células progenitorias neutrófilas y activando los neutrófilos maduros, y la reactividad de factores quimiotácticos ( (Metcalf, Blood) 67:257 (1986) ; (Yan, et al., Blood) 84 (3) : 795799 (1994) ; (Bensinger, et al., Blood) 81 (11) :3158-3163 (1993) ; (Roberts, et al., Expt'l Hematology) 22:1156-1163 (1994) ; (Neben, et al., Blood) 81 (7) : 1960-1967 (1993) ) .
El tratamiento de tumores malignos se realiza generalmente mediante radioterapia y/o quimioterapia, lo que da como resultado de manera indeseable una reducción brusca de los leucocitos y una disminución de la inmunidad que se produce como consecuencia de la reducción de leucocitos, provocando de ese modo importantes inconvenientes cuando el tratamiento terapéutico mediante radioterapia y/o quimioterapia se realiza a lo largo de un periodo prolongado de tiempo. Inicialmente se notificaron los G-CSF como adyuvantes que podían tratar de manera eficaz el cáncer activando la capacidad de inmunización de un paciente (Lopez et al., J. Immunol. 131 (6) :2983-2988, 1983; Platzer et al., J. Exp.Med. 162:1788-1801, 1985) , y actualmente se usan eficazmente para el tratamiento de una variedad de cánceres y leucemia intratable.
La investigación de los G-CSF comenzó inicialmente con el hallazgo de que están presentes materiales de CSF de granulocitos en el medio de cultivo de la línea celular de carcinoma humano CHU-2 (Nomura et al, EMBO J. 8 (5) :871-876, 1986) o línea celular de carcinoma de vejiga humano 5637 (Welte et al., Proc. Narl. Acad. Sci. USA82: 1526- 1530, 1985; Strige et al., Blood69 (5) : 1508-1523, 1987) , y se purificó una proteína que tiene actividad de estimulación de colonias de granulocitos que tiene un peso molecular de 18 a 19 kDa (Nomura et al., EMBO J. 5 (5) :871-876, 1986) .
En primer lugar se aislaron los ADNc de G-CSF a partir de la línea celular de carcinoma de vejiga humano 5673 por L.M. Souza et al. (Science, 232 : 61-65 (1986) (véase la publicación de patente coreana n.º 1998-77885) , y luego se clonaron a partir de bibliotecas de ADNc de línea celular de carcinoma escamoso y macrófagos de sangre periférica
(S. Nagata et al., Nature, 319: 415-417 (1986) ; S. Nagata et al., EMBO J., 5: 575-581 (1986) ; Y. Komatsu et al., Jpn.
J. Cáncer Res., 78: 1179-1181 (1987) ) .
Con la llegada de la tecnología génica recombinante, se reveló que se producen G-CSF como cuerpos de inclusión insolubles en el transcurso de la expresión de una gran cantidad de G-CSF a partir de Escherichia coli y se convirtieron en G-CSF activos mediante replegamiento. El G-CSF recombinante (rG-CSF) producido a partir de E. coli comprende una proteína identificada en SEQ ID NO:2 (175 aminoácidos) , es decir, un G-CSF natural (174 aminoácidos) identificado en SEQ ID NO:1 y metionina N-terminal, y tiene un peso molecular de aproximadamente 19 kDa.
Además, el G-CSF natural tiene un sitio de O-glicosilación en un aminoácido treonina (Thr) en la posición n.º 133 mientras que el rG-CSF derivado de E. coli no tiene ningún sitio de glicosilación. Sin embargo, se sabe que la presencia o ausencia del sitio de glicosilación y/o la metionina N-terminal tiene poco efecto sobre la actividad biológica (Souza et al.: Science 232, 1986, 61) .
Los agentes terapéuticos de proteína biológica tales como G-CSF tienen ventajosamente alta selectividad y baja toxicidad mientras que presentan un corto tiempo de retención in vivo y son inestables. Para superar tales inconvenientes, se ha desarrollado un método de conjugación de polímeros biocompatibles, por ejemplo, polietilenglicol (PEG) , poli (alcohol vinílico) (PVA) o polivinilpirrolidona, a proteínas biológicas (polipéptidos) , por ejemplo, G-CSF o interferón. Una conjugación con PEG de este tipo impide la degradación de proteínas biológicas inhibiendo eficazmente las proteasas, aumenta la estabilidad y semivida de un agente terapéutico de proteína biológica impidiendo la excreción rápida del agente terapéutico de proteína biológica desde el riñón, y reduciendo la inmunogenicidad (Sada et al. J. Fermentation Bioengineering 71: 137-139 (1991) ) . El documento US2004/0175800 también trata de la pegilación de proteínas de la superfamilia de genes de la hormona del crecimiento.
En particular, los ejemplos de los agentes terapéuticos de proteína pegilada incluyen una formulación pegilada de adenosina diaminasa desarrollada como agente terapéutico de inmunodeficiencia combinada; una formulación pegilada de interferón desarrollada como agente terapéutico de hepatitis; formulaciones pegiladas de glucocerebrosidasa y hemoglobina, etcétera.
Además de PEG, generalmente se usan copolímeros de etilenglicol/propilenglicol, carboximetilcelulosa, dextrano, poli (alcohol vinílico) , polivinilpirrolidona, poli-1, 3-dioxolano, poli-1, 3, 6-trioxano, copolímero de etileno/anhídrido maleico, poliaminoácidos (o bien homopolímeros o bien copolímeros al azar) en el acoplamiento químico del agente terapéutico de proteína.
Dado que el PEG, que es un compuesto polimérico que tiene una fórmula general: HO- (-CH2CH2O-) n-H, es sumamente hidrólifo, se une con una proteína para su uso en aplicaciones médicas, aumentando de ese modo la solubilidad. El PEG que se une a la proteína tiene un peso molecular en el intervalo de aproximadamente 1.000 a aproximadamente 100.000. Si el peso molecular de PEG supera 1.000, el PEG tiene significativamente baja toxicidad. Los PEG que tienen un peso molecular en el intervalo de aproximadamente 1.000 a aproximadamente 6.000 están presentes sistémicamente y se metabolizan a través del riñón. En particular, los PEG ramificados que tienen un peso molecular de aproximadamente 40.000 están presentes en órganos tales como la sangre, el hígado, o similares, y se metabolizan a través del riñón.
La patente estadounidense n.º 4.179.337 da a conocer una composición de polipéptido soluble en agua, no inmunogénica, fisiológicamente activa que tiene polipéptidos acoplados a polietilenglicol (PEG) o polipropropilenglicol (PPG) que tienen un peso molecular de 500 a 20.000 daltons. Para acoplar el PEG a un polipéptido, generalmente se usa un PEG activado. El PEG activado se prepara convirtiendo un grupo hidroxilo terminal del PEG en un grupo metil éter y el otro grupo hidroxilo terminal en un grupo electrófilo, acoplando de ese modo el PEG al polipéptido... [Seguir leyendo]
Reivindicaciones:
1. Mutante conjugado de un G-CSF humano, comprendiendo el mutante la secuencia de aminoácidos identificada en SEQ ID NO:3, en el que un residuo de treonina (Thr) en la posición 133 de G-CSF que comprende la secuencia de aminoácidos identificada en SEQ ID NO:1 se sustituye por un residuo de cisteína (Cys) , y el residuo de Cys sustituido se une a un compuesto químico no proteico, para su uso en la inhibición de la leucocitopenia o para su uso como adyuvante en el tratamiento del cáncer.
2. Mutante conjugado según la reivindicación 1, siendo el mutante una proteína que comprende la secuencia de aminoácidos identificada en SEQ ID NO:4 que tiene un residuo de cisteína (Cys) en la posición 17 sustituido por un residuo de serina (Ser) .
3. Mutante conjugado según la reivindicación 1 ó 2, en el que el compuesto químico no proteico es un compuesto de una clase seleccionada del grupo que comprende polietilenglicol (PEG) , poli (alcohol vinílico) (PVA) , ácido policarboxílico y polivinilpirrolidona, que se une con una clase seleccionada del grupo que comprende maleimida, vinilsulfona, yodoacetamida y disulfuro de ortopiridilo.
4. Mutante conjugado según la reivindicación 1 ó 2, en el que el compuesto químico no proteico tiene un peso molecular en el intervalo de 2 a 100 kDa.
5. Mutante conjugado según la reivindicación 3, en el que el PEG tiene un peso molecular en el intervalo de 5 a 100 kDa.
6. Uso de un mutante conjugado de un G-CSF humano para la preparación de un medicamento para inhibir leucocitopenia o para uso como adyuvante en el tratamiento de cáncer, comprendiendo el mutante la secuencia de aminoácidos identificada en SEQ. ID NO:3, en el que un residuo de treonina (Thr) en la posición 133 de G-CSF que comprende la secuencia de aminoácidos identificada en SEQ iD NO:1 se sustituye con un residuo de cisteína (Cys) , y el residuo de Cys sustituido se une a un compuesto químico no proteico.
7. Uso según la reivindicación 6, en el que el mutante es una proteína que comprende la secuencia de aminoácidos identificada en SEQ. ID NO:4 que tiene un residuo de cisteína (Cys) en la posición 17 sustituido por un residuo de serina (Ser) .
8. Uso según la reivindicación 6 ó 7, en el que el compuesto químico no proteico es un compuesto de una clase seleccionada del grupo que comprende polietilenglicol (PEG) , poli (alcohol vinílico) (PVA) , ácido polycarboxílico y polivinilpirrolidona, que se une con una clase seleccionada del grupo que comprende maleimida, vinilsulfona, yodoacetamida y disulfuro de de ortopiridilo.
9. Uso según la reivindicación 6 ó 7, en el que el compuesto químico no proteico tiene un peso molecular en el intervalo de 2 a 100 kDa.
10. Uso según la reivindicación 8, en el que el PEG tiene un peso molecular en el intervalo de 5 a 100 kDa.
Patentes similares o relacionadas:
Derivativos del ácido siálico para la derivatización y conjugación de proteínas, del 20 de Diciembre de 2019, de LIPOXEN TECHNOLOGIES LIMITED: Un procedimiento de producción de un derivativo aldehído de un ácido siálico en el que un material de partida que tiene una unidad de ácido siálico en el […]
GELES DE QUITOSANO(A) CONTENIENDO NANOPARTICULAS METALICAS DE COBRE, PLATA Y ANTIBIOTICOS (CIPROFLOXACINO, CEFOTAXIME, GENTAMICINA Y CLOXACILINA), del 12 de Diciembre de 2019, de CARDENAS Y CIA LTDA: En la presente invención se describen geles de quitosano (poli-beta-glucosamina) con propiedades bactericidas y fungicidas en mezcla con nanopartículas […]
Compuestos de polímero de polialquileno y usos de los mismos, del 20 de Noviembre de 2019, de Biogen MA Inc: Una composición farmacéutica que comprende un conjugado y un vehículo, adyuvante, diluyente, conservante y/o solubilizante farmacéuticamente […]
Composiciones y métodos para la liberación dirigida de fármacos in vitro e in vivo a células de mamíferos mediante minicélulas intactas derivadas de bacterias, del 23 de Octubre de 2019, de ENGENEIC MOLECULAR DELIVERY PTY LTD: Una composición que comprende: (a) una pluralidad de minicélulas intactas derivadas de bacterias que tienen paredes celulares intactas, en donde la pluralidad […]
Moléculas con semividas prolongadas, composiciones y usos de las mismas, del 16 de Octubre de 2019, de MEDIMMUNE, LLC: Una molécula modificada que comprende una proteína o agente no de proteína y un dominio constante de IgG, en la que el dominio constante de IgG comprende un dominio CH3 humano […]
Método para la preparación de oligo etilenglicol monodisperso, del 19 de Junio de 2019, de NEKTAR THERAPEUTICS: Un método para preparar un oligo (etilenglicol) monodisperso, comprendiendo dicho método: (i) hacer reaccionar un oligo (etilenglicol) terminado […]
Construcciones de moléculas MHC y sus usos para el diagnóstico y terapia, del 29 de Mayo de 2019, de DAKO DENMARK A/S: Una construcción de moléculas MHC en forma soluble en un medio de solubilización o inmovilizada en un soporte sólido o semi-sólido, comprendiendo dicha construcción de moléculas […]
Usos terapéuticos de anticuerpos monoclonales frente al receptor de la angiotensina II tipo 1, del 17 de Mayo de 2019, de QUEEN MARY AND WESTFIELD COLLEGE: Un anticuerpo monoclonal o un fragmento del mismo que se une al péptido que consiste en la secuencia EDGIKRIQDD para su uso en el tratamiento de la proliferación […]