MÉTODO PARA LA PRODUCCIÓN DE 3-METILAMINO-1-( TIEN-2-IL)-PROPAN-1-OL.
Método para la producción de (S)-3-metilamino-1-(tien-2-il)-propan-1-ol de la fórmula I-S en el cual a) reacciona tiofeno con un halogenuro de ß-halopropionilo o un halogenuro de acriloilo en presencia de un ácido Lewis para dar una 3-halo-1-(tien-2-il)-propan-1-ona,
donde se introduce un haluro de hidrógeno simultáneamente o después de terminada la reacción, aunque antes del aislamiento del producto de reacción, y b) se reduce la propanona obtenida en la etapa a) en presencia de una deshidrogenasa (E.C. 1.1.x.x.), la cual exhibe una selectividad respecto a la formación de (S)-3-metilamino-1-(tien-2-il)propan-1-ol, y a continuación, dado el caso, se hace reaccionar con metilamina sin aislamiento del producto de reacción
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2004/010939.
Solicitante: BASF SE.
Nacionalidad solicitante: Alemania.
Dirección: 67056 LUDWIGSHAHEN ALEMANIA.
Inventor/es: HAUER, BERNHARD, BREUER, MICHAEL, FRIEDRICH, THOMAS, STURMER, RAINER, DR., KESSELER,MARIA.
Fecha de Publicación: .
Fecha Solicitud PCT: 30 de Septiembre de 2004.
Clasificación Internacional de Patentes:
- C07D333/16 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 333/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen un átomo de azufre como único heteroátomo del ciclo. › por átomos de oxígeno.
Clasificación PCT:
- C07D333/16 C07D 333/00 […] › por átomos de oxígeno.
Clasificación antigua:
- C07D333/16 C07D 333/00 […] › por átomos de oxígeno.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357115_T3.pdf
Fragmento de la descripción:
La presente invención describe un método para la producción de 3-metilamino-1-(tien-2-il)-propan-1-ol de la fórmula I
y en particular un método para la producción del enantiómero S, I-S. 5
El enantiómero S del aminopropanol I de la fórmula I-S
es un precursor importante para la síntesis del antidepresivo Duloxetina de la fórmula II
donde B representa un radical ácido orgánico o inorgánico con n cargas negativas y HnB representa un ácido 10 farmacéuticamente compatible.
Los métodos del estado de la técnica para la producción de duloxetinao bien de su base correspondiente son costosos y requieren el empleo de reactivos quirales o insumos quirales.
De este modo la EP-B-0273658 describe un método para la producción de la base correspondiente de duloxetina mediante la reacción de 2-acetiltiofeno en una reacción de Mannich con formaldehído y dimetilamina, reducción del 15 grupo ceto de la base Mannich allí obtenida hasta el (S)-3-N,N-dimetilamino-1-(tien-2-il)propan-1-ol racémico, formación del éter de la función alcohol con fluoruro de naftilo y finalmente formación del grupo dimetilamino en una funciónmetilamino. Se obtiene el enantiómero deseado del éter de naftilo mediante el empleo de materiales de partida quirales o mediante separacióndel racemato en la etapa del producto final, por ejemplo en las sales con ácidos ópticamente activos o cromatografía sobre una fase estacionaria quiral. 20
La US-5,362,886 describe un método análogo, en el cual al propanol racémico obtenido después de la reducción del grupo cetose añade ácido S-mandélico. El enantiómero S del alcohol obtenido con ello es empleado en las etapas subsiguientes de reacción.
Así mismo la EP-A-0457559 describe un método análogo al de la EP-B-0273658. Aquí se reduce el grupo ceto de la reacción de Mannich con el sistema asimétrico de reducción LAH-Icb (hidruro de litio y aluminio-[(2R,2S)-(-)-4-25 dimetilamino-1,2-difenil-3-metil-2-butanol]) hasta alcohol en la forma de enantiómero S. Además aquí es desventajosa, aparte de los costos, la sensibilidad del sistema de reducción LAH-lcb, el cual es estable sólo por unos pocos minutos.
También W. J. Wheeler y F. Kuo describen en Journal of Labelled Compounds ADN Radiopharmaceuticals, volumen XXXVI, Nr. 3, páginas 213 a 223 un método para la producción de duloxetina. En éste, el cloruro de ácido tiofen-2-carboxílico reacciona en un acoplamiento de Stille con vinil-tri-n-butilestanano en presencia de cantidades catalíticas de 30 bencilcloro-bis (trifenilfosfin)paladio(II) en DMPU (dimetilpropilenurea) hasta dar 1-(tien-2-il)-propenona de la fórmula II
la cual a continuación es convertida mediante tratamiento con cloruro de hidrógeno en 3-cloro-1-(tien-2-il)-propan-1-ona de la fórmula III.1
La cloropropanona III.1 así obtenida es a continuación reducida mediante el empleo de una oxazaborolidina quiral y BH3 para dar (S)-3-cloro-1-(tien-2-il)- propan-1-ol de la fórmula IV.1-S
5
El alcohol IV.1-S así obtenido es convertido mediante reacciones sucesivas con yoduro de sodio y a continuación con metilamina en (S)-3-metilamino-1-(tien-2-il)-propan-1-ol I-S. Mediante las reacciones subsiguientes sucesivas con hidruro de sodio, 1-fluoronaftalina y cloruro de hidrógeno, se obtiene duloxetina en forma del clorhidrato. Por un lado aquí es desventajoso que para la producción del producto intermedio cloropropanona III.1 se requieren numerosas etapas y costosos reactivos. Por otro lado en la conversión de la cloropropanona III.1 en el aminoalcohol se aísla el 10 cloropropanol IV.1-S. Sin embargo investigaciones de quien registra la patente han mostrado que este cloropropanol es sensible y se descompone fácilmente en una reacción fuertemente exotérmica, lo cual conduce no sólo a pérdidas de rendimiento respecto al aminoalcohol, sino que también dificulta el manejo de la reacción a escala técnica técnica.
De la literatura se conocen métodos para la producción de la 3-cloro-1-(tien-2-il)-propan-1-ona que se forma como producto intermedio en la síntesis de duloxetina, descrita por W. J. Wheeler et al. Sin embargo es una desventaja de los 15 métodos conocidos en el estado de la técnica que, o bien se forma la cloropropanona III.1 con pobre rendimiento o tiene que ser trabajada con reactivos de difícil manipulación. De este modo describen A. Etienne et al. en CR Acad. Sci., Ser. C, 1979, 288 (1), 49-52, la producción de la cloropropanona III.1 mediante reacción de Friedel-Crafts de tiofeno con cloruro de 3-cloropropionilo en presencia de cloruro de aluminio como catalizador ácido Lewis y en nitrometano como solvente. Se obtiene la cloropropanona III.1 con un rendimiento de tan sólo 7%. También la reacción correspondiente 20 descrita por Liu et al. en Quirality, 12, 26-29 (2000), en presencia de tetracloruro de estaño como catalizador ácido Lewisy benceno como solvente conduce a rendimientos poco satisfactorios. Meth-Cohn et al. describen en Acta Chem. Scand. v 20 (6), 1577-1587 (1966) la correspondiente acilación Friedel-Crafts sobre tiofeno en presencia de tricloruro de hierro o bien tricloruro de aluminio, donde se forma la cloropropanona III.1 en rendimiento moderado a bueno. Aquí es desventaja que tienen que emplearse disulfuro de carbono como solvente. 25
Kamal, G. B. R. Khanna, R. Ramu y T. Krishnaji describe en Tetrahedron Lett. 44, 2003, 4783-4787 la producción del precursor de duloxetina (S)-3-hidroxi-3-(tien-2-il)-propanonitrilo mediante acetilación de tiofeno con cloruro de cloroacetilo, la reducción de la cetona con borohidruro de sodio hasta dar el alcohol racémico, sustitución del radical cloro con cianuro y reacción del nitrilalcohol racémico con acetato de vinilo en presencia de una lipasa de Pseudomonas cepacia (inmovilizadas sobre diatomita), donde la lipasa cataliza de manera selectiva la esterificación de enantiómero R, 30 de modo que el enantiómero S que permanece no esterificado puede ser aislado en una forma pura. Aquí es una desventaja por un lado el gran número de etapas de reacción requeridas y por el otro la pérdida de la mitad del nitrilalcohol, puesto que en la fracción R esterificada no reacciona nuevamente hasta dar duloxetina.
De allí que fue un objetivo de la presente invención poner a disposición un método para la producción de 3-metilamino-1-(tien-2-il)-propan-1-ol I, el cual venciera la dificultad del estado de la técnica aquí descrita. Además debería proveer el 35 compuesto I en buen rendimiento total y en particular también permitir la producción S-enantioselectiva de enantiómero I-S.
El objetivo fue logrado primero que todo mediante una transformación del tiofeno en una reacción de Friedel-Crafts con halogenuro de β-halogenopropioniloo un halogenuro de acriloilo en presencia de un ácido Lewis, donde antes del aislamiento del producto de reacción se introduce un halogenuro de hidrógeno. A continuación se reduce el grupo ceto 40 de la 3-halógeno-1-(tien-2-il)-propan-1-ona de la fórmula III que fue allí obtenida
Hal= halógeno
y se hace reaccionar el producto reducido de la fórmula IV
con metilamina.
De allí que se describe un método para la producción de 3-metilamino-1-(tien-2-il)-propan-l-ol de la fórmula I
en el cual 5
a) se hace reaccionar tiofeno con un halogenuro de β-halogenopropionilo o un halogenuro de acriloilo en presencia de un ácido Lewis hasta dar una 3-halógeno-1-(tien-2-il)-propan-1-ona, donde simultáneamente o después de ocurrida la reacción, aunque antes del aislamiento del producto de reacción, se añade un halogenuro de hidrógenoy
b) se reduce la propanona obtenida en la etapa a) y a continuación, preferiblemente sin aislamiento del 10 producto de reacción, se hace reaccionar con metilamina.
El método acorde con la invención provee un compuesto objetivo I en buen rendimiento total. La producción de la halopropanona III de la etapa intermedia no está además acoplada al uso de costosos reactivos orgánicos de estaño. El halopropanol IV de difícil manipulación no necesita ser separado. Además el método permite una forma sencilla de producción enantioselectiva del enantiómero-S I-S, en lo cual se ejecuta la reducción de la halopropenona III de la... [Seguir leyendo]
Reivindicaciones:
1. Método para la producción de (S)-3-metilamino-1-(tien-2-il)-propan-1-ol de la fórmula I-S
en el cual
a) reacciona tiofeno con un halogenuro de β-halopropionilo o un halogenuro de acriloilo en presencia de un 5 ácido Lewis para dar una 3-halo-1-(tien-2-il)-propan-1-ona, donde se introduce un haluro de hidrógeno simultáneamente o después de terminada la reacción, aunque antes del aislamiento del producto de reacción, y
b) se reduce la propanona obtenida en la etapa a) en presencia de una deshidrogenasa (E.C. 1.1.x.x.), la cual exhibe una selectividad respecto a la formación de (S)-3-metilamino-1-(tien-2-il)propan-1-ol, y a continuación, dado el caso, se hace reaccionar con metilamina sin aislamiento del producto de reacción. 10
2. Método según la reivindicación 1, donde en la etapa a) se emplea como ácido Lewis tricloruro de aluminio.
3. Método según una de las reivindicaciones precedentes, donde la reacción de la etapa a) es realizada en un hidrocarburo halogenado como solvente.
4. Método según la reivindicación 1, donde se lleva a cabo la reducción en presencia de una deshidrogenasa (E.C. 1.1.1.x) en particular en presencia de una alcohol deshidrogenasa (E.C.1.1.1.1 o E.C.1.1.1.2). 15
5. Método según la reivindicación 1 o 4, donde la deshidrogenasa es elegida de entre deshidrogenasas de levaduras del género Geotrichum, Pichia, Candida, Hansenula o Saccharomyces y de bacterias del género Pseudomonas, Burkholderia, Agrobacterium, Rhodococcus o Lactobacillus.
6. Método según la reivindicación 5, donde la deshidrogenasa es elegida de entre deshidrogenasas de Geotrichum candidum, Candida magnoliae y Lactobacillus brevis. 20
7. Método según la reivindicación 1, donde se emplea una alcohol deshidrogenasa con una secuencia de aminoácidos que en la región del extremoN terminal
a) incluye una secuencia constituyente de aminoácidos de por lo menos 10residuos sucesivos de aminoácidos según SEQ ID NO: 1, donde preferiblemente adicionalmente a la posición correspondiente según SEQ ID NO:1, la posición 12 de aminoácido representa valina; o 25
b) incluye una secuencia constituyente de aminoácidos de por lo menos 10 residuos aminoácidos sucesivos según SEQ ID NO: 2.
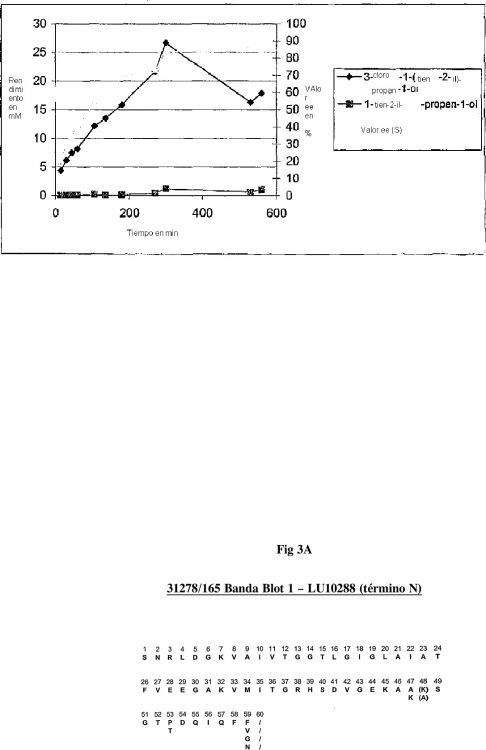
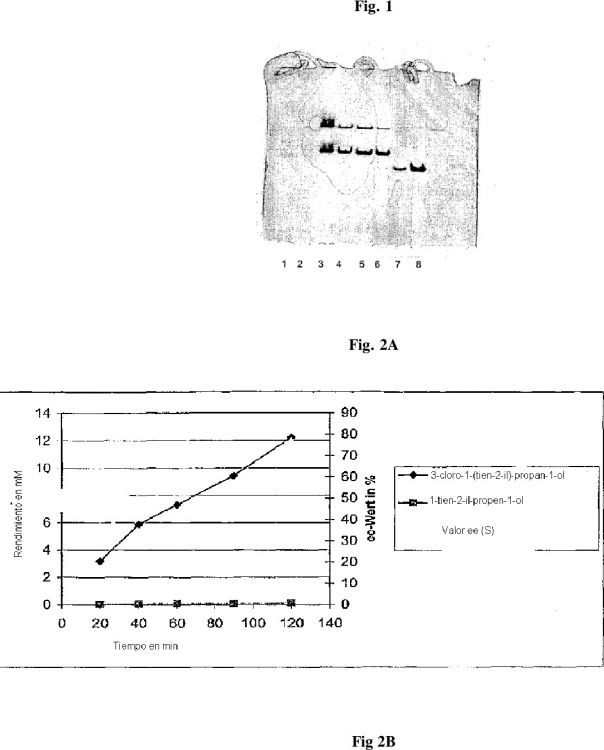
8. Método según la reivindicación 7, donde la deshidrogenasa tiene la capacidad de reducir 3-cloro-1-(tien-2-il)-propan-1-ona hasta (S)-3-cloro-1-(tien-2-il)-propan-1-ol.
9. Método según la reivindicación 8, donde la deshidrogenasa cataliza la reducción en una pureza de enantiómeros de 30 por lo menos 85 % ee (en presencia de NADH y/o NADPH; a 30°C y pH 6.0).
10. Método según una de las reivindicaciones 7 a 9, donde la deshidrogenasa es codificada por una secuencia de ácidos nucleicos que incluye SEQ ID NO:3, o abarca una secuencia de aminoácidos según SEQ ID NO: 4 o por lo menos una secuencia constituyente de acuerdo con la figura 3, y es obtenible preferiblemente de Lactobacillus brevis o es una alcohol deshidrogenasa funcionalmente equivalente derivada de ella, con una secuencia de aminoácidos idéntica 35 en por lo menos 60%.
11. Método según una de las reivindicaciones 7 a 9, donde la deshidrogenasa es codificada por una secuencia de ácidos nucleicos que incluye SEQ ID NO:5, o exhibe una secuencias de aminoácidos que incluye SEQ ID NO: 6 y es obtenible preferiblemente de Candida magnoliae (ATCC 12573) o es una alcohol deshidrogenasa funcionalmenteequivalente derivada de ella, con una secuencia de aminoácidos idéntica en por lo menos 60%. 40
12. Método según una de las reivindicaciones 1 a 11, donde se emplea la deshidrogenasa o un microorganismonatural o recombinante que produce esta deshidrogenasa.
Patentes similares o relacionadas:
Derivado de urea o sal farmacológicamente aceptable del mismo, del 8 de Abril de 2020, de KYORIN PHARMACEUTICAL CO., LTD.: Un compuesto representado por la fórmula general (I) o un hidrato, un solvato o una sal farmacológicamente aceptable del mismo: **(Ver fórmula)** […]
Derivado de ácido 4-aminometilbenzoico, del 20 de Marzo de 2019, de TOA EIYO LTD.: Un compuesto representado por la fórmula general :**Fórmula** una sal farmacéuticamente aceptable del mismo o un solvato del mismo; en donde Ar representa […]
Novedosos compuestos organolépticos y su uso en composiciones de aroma y fragancia, del 18 de Octubre de 2018, de INTERNATIONAL FLAVORS & FRAGRANCES INC.: Un compuesto representado por la fórmula I:**Fórmula** en la que R1 es un grupo alquilo C1-C4; R2 está seleccionado del grupo que consiste en hidrógeno, […]
Compuesto de amina y su uso farmacéutico, del 11 de Mayo de 2016, de MITSUBISHI TANABE PHARMA CORPORATION: Un compuesto de amina representado por la siguiente fórmula (I)**Fórmula** en donde R es un átomo de hidrógeno o P(≥O)(OH)2, X es un […]
Productos de reacción heterocíclicos alquilados útiles como antioxidantes, del 30 de Marzo de 2016, de SI GROUP, INC: Una mezcla de productos de reacción macromoleculares formada reuniendo componentes que comprenden: (A) un 4-alcoximetil-2,6-5 dihidrocarbilfenol estéricamente impedido o un […]
Productos de reacción heterocíclicos alquilados útiles como antioxidantes, del 23 de Marzo de 2016, de SI GROUP, INC: Un producto de reacción macromolecular que comprende (a) uno o más de i) compuestos heterocíclicos sustituidos con un grupo 3,5-dihidrocarbil-4-hidroxilbencilo; […]
Derivados de 1-N-azacicloalquil-3-fenoxipropano útiles para la preparación de medicamentos psicotrópicos, del 10 de Marzo de 2016, de BIOPROJET: Compuesto de fórmula (I): **Fórmula** con R1 y R2 tomados junto con el átomo de nitrógeno al que están unidos, forman un anillo que contiene nitrógeno monocíclico […]
Derivados de C-glucósido y sales de los mismos, del 3 de Febrero de 2016, de ASTELLAS PHARMA INC.: Un derivado de C-glucósido o una sal de los mismos, en la que el derivado de C-glicósido es al menos un compuesto seleccionado del grupo constituido […]