CONSTRUCCIÓN DE APOLIPOPROTEÍNAS.
Una construcción de apolipoproteínas para uso como un medicamento que tiene la fórmula general apo-A-X,
- en la que apo-A es un componente de apolipoproteína seleccionado entre el grupo que consiste en apolipoproteína Al, apolipoproteína AII, apolipoproteína AIV, un análogo, o su variante que comparte al menos 70 % de identidad de secuencia con una secuencia seleccionada entre el grupo constituido por SEQ ID NO 15: y y (i) X es una proteína heteróloga que comprende más de 200 aminoácidos, con la condición que cuando la construcción consiste en exactamente dos apolipoproteínas nativas idénticas están ligadas C-terminal a N-terminal, o (ii) X es un resto heterólogo que es un módulo de oligomerización, en la que la construcción tiene un incremento de semivida en plasma comparada con la apolipoproteína de tipo salvaje; y en la que el análogo o variante es capaz de provocar la misma respuesta fisiológica que la apolipoproteína-A-I, A-II o A-IV
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/DK2001/000739.
Solicitante: F. HOFFMANN-LA ROCHE LTD.
Nacionalidad solicitante: Suiza.
Dirección: GRENZACHERSTRASSE 124 4070 BASEL SUIZA.
Inventor/es: MOESTRUP,S REN, GRAVERSEN,JONAS.
Fecha de Publicación: .
Fecha Solicitud PCT: 9 de Noviembre de 2001.
Fecha Concesión Europea: 22 de Septiembre de 2010.
Clasificación PCT:
- A61K38/17 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- C07K14/775 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Apolipopéptidos.
- C07K19/00 C07K […] › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
Clasificación antigua:
- C07K14/775 C07K 14/00 […] › Apolipopéptidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2356181_T3.pdf




Fragmento de la descripción:
La invención se refiere a una construcción de apolipoproteínas, una construcción de apolipoproteínas para uso como un medicamento, una secuencia de ácido nucleico que codifica la construcción de apolipoproteínas, un vector que comprende la secuencia de ácido nucleico, un procedimiento para producir la construcción de apolipoproteínas, una composición farmacéutica que comprende la construcción de apolipoproteínas, y uso de la 5construcción de apolipoproteínas para la preparación de una composición farmacéutica.
Técnica anterior
En lo siguiente, el término Apo A o apolipoproteína A se usará para designar cualquiera de las tres apolipoproteínas, Apolipoproteína A 1. Apolipoproteína A 11, o Apolipoproteína A IV.
Las enfermedades cardiovasculares provocadas por aterosclerosis en los vasos es la causa más 10frecuente de muerte en los países industrializados del mundo. Uno de los factores patogénicos que provocan aterosclerosis es la deposición de colesterol en las paredes de los vasos que conducen a la formación de placas y eventualmente a arterosclerosis y un aumento de riesgo de infarto.
Apolipoproteína A-1 (apo-A-1) es el principal componente de HDL (lipoproteína de alta densidad) en plasma, que está correlacionada de forma negativa con la presencia de arterosclerosis. Existe una fuerte evidencia 15experimental de que este efecto está provocado por el llamado transporte inversos de colesterol desde los tejidos periféricos al hígado. Existe evidencia experimental de que el transporte inverso de colesterol se puede estimular en mamíferos mediante inyección de apo-A-1.
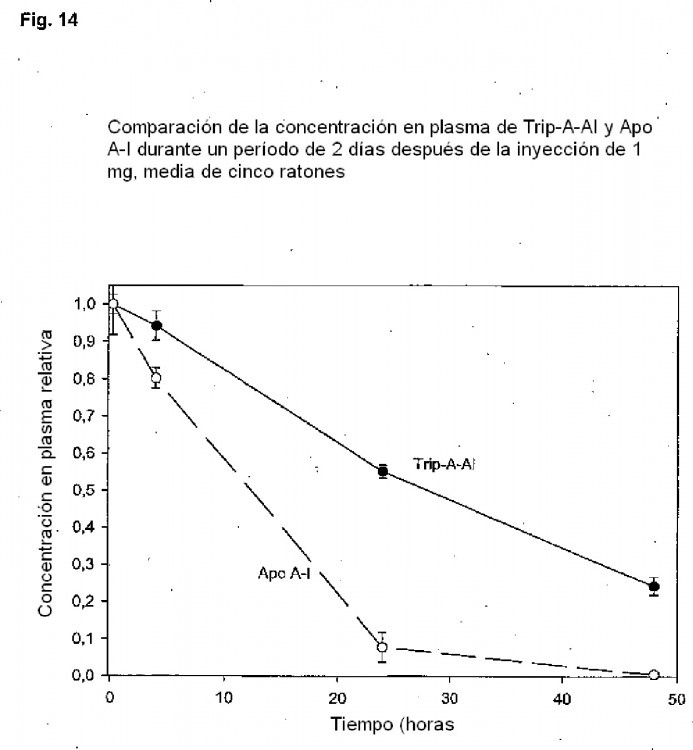
Apolipoproteína A-1 se elimina rápidamente del plasma. Se cree que Apo-A-1 se retira hasta un gran cantidad del plasma mediante filtración en los riñones sin descomponerse primero (Braschi et al 1999, J Lipid Res, 2040: 522 - 532; Braschi et al 2000, Biochemistry, 39: 5441 - 5449; Glass et al 1983, J Biol Chem 258:7161-7167). La corta semivida en plasma de apolipoproteína A es una restricción contra el uso de la proteína en el tratamiento de aterosclerosis.
Los documentos US 5.876.968 WO9312143 (SIRTORI ET AL.) se refiere sustancialmente a dímeros puros de una variante de apo-A-1 llamada apolipoproteína A-1-Milano. Los medicamentos que contienen el dímero 25se pueden usar para prevenir trombosis o se pueden usar como un profármaco para el monómero. Una característica específica de esta variante particular de apo-A-I is es su capacidad para formar dímeros covalentes con ellos mismos. Los autores especularon que la presencia de Apo A-I-M puede ser responsable de una semivida en plasma prolongada, pero no se han presentado datos concluyentes.
El documento US 5.643.757 (SHA-IL ET AL.) desvela un procedimiento para la producción de, 30apolipoproteína A-I humana estable, madura y biológicamente activa con alto rendimiento.
El documento US 5.990.081 (AGELAND ET AL.) desvela un procedimiento para el tratamiento de arterosclerosis o enfermedades cardiovasculares mediante la administración de una cantidad terapéuticamente eficaz de apolipoproteína A o apolipoproteína E.
El documento WO 96/37608 (RHONE-POULENC ROHRER ET AL.) desvela dímeros homólogos humanos 35de variantes de apolipoproteína A-I que comprenden cisteína en la posición 151. La presencia del resto de cisteína en la secuencia de aminoácidos permite la formación de dímeros mediarte puentes disulfuro entre los monómeros. La referencia además desvela las secuencias de secuencias de ácido nucleico y vectores correspondientes que comprende éstas así como las composiciones farmacéuticas que comprende las variantes y el uso de éstas en la terapia génica. 40
El documento WO 90/12879 (Sirtori et al) y documento WO 94/13819 (Kabi Pharmacia) desvelan los procedimientos para la preparación de ApoA-1 y ApoA-IM en levadura y E. coli respectivamente. Los documentos también desvelan el uso de ApoA-1 y ApoA-IM como un medicamento para el tratamiento de aterosclerosis y enfermedades cardiovasculares.
En conclusión la técnica anterior se refiere principalmente al uso de monómero ApoA-1 nativa o monómero 45de ApoA-IM o dímero de ApoA-IM como medicamentos para el tratamiento de enfermedades vasculares, a pesar de las desventajas conocidas de estas proteínas (principalmente eliminación rápida). La técnica anterior no sugiere modificar ApoA-1 con el fin de obtener construcciones con una capacidad incrementada para realizar el transporte inverso de colesterol y / o con semivida más larga en plasma. Es un objeto de la presente invención proporcionar tales construcciones de ApoA, que se pueden usar para el tratamiento y / o prevención de enfermedades 50cardiovasculares.
Sumario
En un primer aspecto la invención se refiere a una construcción de apolipoproteínas para uso como un medicamento que tiene la fórmula general
- apo A-X,
- en la que apo A es un componente de apolipoproteína A seleccionado entre el grupo constituido por apolipoproteína Al, apolipoproteína AII, apolipoproteína AIV, un su análogo o una de sus variantes, 5
- y X es un resto heterólogo que comprende al menos un compuesto seleccionado entre el grupo constituido por un aminoácido, un péptido, una proteína, un carbohidrato, y una secuencia de ácido nucleico,
- con la condición de que cuando la construcción consta de dos, apolipoproteínas nativas exactamente idénticas y éstas están unidas en serie. 10
Mediante la invención se proporciona una construcción novedosa para uso como un medicamento. La técnica anterior falla para enseñar una construcción de apolipoproteína como se define en la presente invención para uso médico. Las construcciones de apolipoproteínas de acuerdo con la presente invención se pueden considerar de manera amplia como análogos de HDL debido a su capacidad de formar complejos con colesterol y otros lípidos u ayuda en el transporte de estos compuestos al hígado. 15
A lo largo de toda la invención el componente o parte de la construcción de apolipoproteína se denomina apo A o apolipoproteína. En lo siguiente y en las reivindicaciones, el resto heterólogo se denomina componente X de la construcción. La apolipoproteína o su análogo o variante está unido de forma covalente al resto heterólogo.
El componente X de la construcción se puede considerar de manera amplia como un resto heterólogo. En este contexto un resto heterólogo es cualquier tipo de resto que no está unido a apolipoproteína o un análogo o 20una de sus variantes o equivalentes funcionales en condiciones nativas. El resto heterólogo de este modo puede ser un péptido o una proteína o parte de un péptido o proteína de la misma o de otras especies, o incluso un único aminoácido. Puede ser un péptido sintético. Puede ser de naturaleza carbohidrato o de otra naturaleza polimérica y biocompatible tal como polioles, secuencias de ácidos nucleicos.
La equivalencia funcional con apolipoproteína nativa A-I, A-II o A-IV se puede medir de manera 25conveniente usando un ensayo de unión de lípido. La capacidad de la construcción para provocar sustancialmente la misma respuesta fisiológica en un mamífero se puede medir de manera conveniente midiendo la capacidad de realizar transporte de colesterol inverso en un organismo de ensayo tales como conejos o roedores tales como ratones.
La construcción que comprende apolipoproteína y un resto heterólogo es capaz de realizar transporte de 30colesterol inverso también o incluso que las apolipoproteínas nativas, a pesar de la modificación provocada por la adición de un resto heterólogo. La semivida en plasma de la construcción está incrementada de preferencia comparada con la de la apolipoproteína de tipo salvaje. El aumento de semivida se puede deber o bien al incremento de tamaño de la construcción de apolipoproteínas, que puede reducir la velocidad de filtración a través de los riñones, se puede deber a un incremento en la unión a HDL, o se puede deber a la reducción de la 35descomposición de la construcción comparado con Apo A nativa.
De preferencia la semivida en plasma es al menos doble o triple, o al menos cuádruple, o al menos doble. De manera similar, la afinidad de unión tal como la afinidad de unión a lípido, y / o la afinidad de unión a colesterol de la construcción está aumentada de preferencia comparada con la apolipoproteína de tipo salvaje. De preferencia,... [Seguir leyendo]
Reivindicaciones:
1. Una construcción de apolipoproteínas para uso como un medicamento que tiene la fórmula general
apo-A-X,
- en la que apo-A es un componente de apolipoproteína seleccionado entre el grupo que consiste en apolipoproteína Al, apolipoproteína AII, apolipoproteína AIV, un análogo, o su variante que comparte al menos 70 % de identidad de secuencia con una secuencia seleccionada entre el grupo constituido por 5
SEQ ID NO 15:
y
y (i) X es una proteína heteróloga que comprende más de 200 aminoácidos, con la condición que cuando la construcción consiste en exactamente dos apolipoproteínas nativas idénticas están ligadas C-terminal a N-terminal,
o 5
(ii) X es un resto heterólogo que es un módulo de oligomerización,
en la que la construcción tiene un incremento de semivida en plasma comparada con la apolipoproteína de tipo salvaje; y en la que el análogo o variante es capaz de provocar la misma respuesta fisiológica que la apolipoproteína-A-I, A-II o A-IV.
2. La construcción de la reivindicación 1, que comprende además un espaciador entre el componente apo-A y X. 10
3. La construcción de la reivindicación 2, en la que el espaciador comprende un péptido espaciador.
4. La construcción de la reivindicación 3, en la que el péptido espaciador comprende al menos dos aminoácidos, tal como al menos tres aminoácidos, por ejemplo al menos cinco aminoácidos, tal como al menos diez aminoácidos, por ejemplo al menos 15 aminoácidos, tal como al menos 20 aminoácidos, por ejemplo al menos 30 aminoácidos, tal como al menos 40 aminoácidos, por ejemplo al menos 50 aminoácidos, tal como al menos 60 aminoácidos, por 15ejemplo al menos 70 aminoácidos, tal como al menos 80 aminoácidos, tal como al menos 90 aminoácidos tal como aproximadamente 100 aminoácidos.
5. La construcción de acuerdo con la reivindicación 2, en la que el espaciador está unido al componente de apo-A y X mediante enlaces covalentes.
6. La construcción de acuerdo con la reivindicación 2, en la que el espaciador es esencialmente no inmunógeno, y / 20º es propenso a la escisión proteolítica y / o no comprende ningún resto de cisteína.
7. La construcción de acuerdo con la reivindicación 2, en la que la estructura tridimensional del espaciador es lineal o sustancialmente lineal.
8. La construcción de acuerdo con la reivindicación 2, en la que el péptido espaciador comprende la secuencia de aminoácidos GTKVHMK de tetranectina, secuencia de aminoácidos PGTSGQQPSVGQQ y GTSGQ de la hebra de 25conexión 3 de fibronectina humana, PKPSTPPGSS de la región de articulación de IgG3 de tipo murino, SGGTSGSTSGTGST, AGSSTGSSTGPGSTT o GGSGGAP.
9. La construcción de la reivindicación 1, en la que la proteína o péptido comprende al menos una proteína de mamífero.
10. La construcción de acuerdo con la reivindicación 9, en la que la proteína de mamífero es una proteína humana. 30
11. La construcción de la reivindicación 9, en la que la proteína comprende al menos una proteína seleccionada entre el grupo que comprende albúmina, más de preferencia albúmina sérica, el fragmento de serina proteasa de plasminógeno u otra serina proteasa modificada por ingeniería genética mediante rotura de la triada catalítica, y la región constante de la cadena pesada de inmunoglobulinas.
12. La construcción de acuerdo con la reivindicación 1, en la que el componente X comprende al menos una 5apolipoproteína A-I, apolipoproteína A-II, apolipoproteína A-IV, Apolipoproteína E, su análogo o variante que comparte al menos 70 % de identidad de secuencia con una secuencia seleccionada entre el grupo que consiste en
y
13. La construcción de la reivindicación 9, en la que el péptido que constituye el componente X comprende más de 300 aminoácidos, por ejemplo más de 400 aminoácidos, tal como más de 500 aminoácidos, por ejemplo más de 5600 aminoácidos, 5 tal como más de 700 aminoácidos, por ejemplo más de 800 aminoácidos, tal como más de 900 aminoácidos, por ejemplo más de 1000, 1250, 1500, 2000, o 2500 aminoácidos.
14. La construcción de la reivindicación 1, en la que el módulo de oligomerización es un módulo de dimerización.
15. La construcción de la reivindicación 1, en la que el módulo de oligomerización es un módulo de trimerización.
16. La construcción de la reivindicación 1, en la que el módulo de oligomerización es un módulo de trimerización. 10
17. La construcción de la reivindicación 1, en la que el módulo de oligomerización es de naturaleza no peptídica.
18. La construcción de la reivindicación 15, en la que el módulo de trimerización comprende una secuencia de aminoácidos capaz de mediar el intercambio de reconocimiento entre cadena, trimerización y alineación de tres cadenas de polipéptidos.
19. La construcción de la reivindicación 15, en la que el módulo de trimerización comprende el módulo de 15trimerización de tetranectina.
20. La construcción de la reivindicación 19, en la que el módulo de trimerización de tetranectina es capaz de formar un complejo estable con otro módulo de trimerización de tetranectina.
21. La construcción de las reivindicaciones 19 a 21, en la que el módulo de trimerización que comprende dos módulos de trimerización de tetranectina unidos mediante un resto espaciador, que permite que los dos módulos 20de trimerización de tetranectina tomen parte en una formación de complejo no siendo un tercer módulo de trimerización de tetranectina parte de la construcción de apolipoproteínas.
22. La construcción de las reivindicaciones 19 a 21, en la que al menos un módulo de trimerización de tetranectina
está seleccionada entre el grupo que consiste en tetranectina humana, tetranectina murina o lectina de tipo C de cartílago humano, bovino o de tiburón.
23. La construcción de las reivindicaciones 19 a 22, en la que el módulo de trimerización de tetranectina comprende a secuencia que tiene al menos un 68 % de identidad con la secuencia de consenso de la SEQ ID NO 12.
24. La construcción de la reivindicación 23, en la que el resto de cisteína nº 50 está sustituido por un resto de 5serina, un resto de treonina, un resto de metionina.
25. La construcción de la reivindicación 23, en la que el resto de cisteína nº 50 está sustituido por cualquier otro resto de aminoácido.
26. La construcción de la reivindicación 1, que tiene una semivida de al menos la semivida de Apo Al, A-II o A-IV nativas, de preferencia al menos 2 veces mayor, más de preferencia al menos 3 veces mayor, tal como 4 veces, 10más de preferencia al menos 5 veces mayor, tal como 6 veces, más de preferencia al menos 8 veces mayor, tal como al menos 10 veces.
27. La construcción de la reivindicación 1, que tiene una afinidad de unión mayor a colesterol comparada con Apo A-I, A-II o A-IV nativas.
28. La construcción de la reivindicación 1, capaz de unirse a un receptor seleccionado entre el grupo constituido por 15cubilina, receptor de inactivador de clase B, tipo 1 (SR-B1), módulo 1 de unión a ATP (ABC1), Lecitina:colesterol aciltransferasa (LCAT), proteína de transferencia de ésteres de colesteril (CETP), proteína de transferencia de fosfolípidos (PLTP).
29. La construcción de acuerdo con la reivindicación 1, que tiene secuencia de aminoácidos que comparte al menos 70% de identidad de secuencia a una de las secuencias SEQ ID NO 3 a SEQ ID NO 11, o SEQ ID NO 14. 20
30. Uso de medicamento como se define en las reivindicaciones 1 a 29 para la preparación de una composición farmacéutica.
31. El uso de la reivindicación 30, para el tratamiento y / o prevención of arterosclerosis.
32. El uso de la reivindicación 30, para la eliminación de las endotoxinas.
33. El uso de la reivindicación 30, en el tratamiento de angina de pecho. 25
34. El uso de la reivindicación 30, en el tratamiento de infarto de miocardio.
35. El uso de la reivindicación 30, en el tratamiento de angina de pecho de placa.
36. El uso de la reivindicación 30, en el tratamiento de angina de pecho inestable.
37. El uso de la reivindicación 30, en el tratamiento de estenosis arterial tal como claudicación, estenosis de carótida o estenosis arterial cerebral. 30
Patentes similares o relacionadas:
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Polipéptidos de unión específica novedosos y usos de los mismos, del 15 de Julio de 2020, de Pieris Pharmaceuticals GmbH: Muteína de lipocalina lagrimal humana que tiene especificidad de unión para IL-17A, en la que la muteína se une a IL-17A con una KD de aproximadamente 1 nM o menos, en la que […]
Antígenos de coagulasa estafilocócica y métodos para su uso, del 13 de Mayo de 2020, de UNIVERSITY OF CHICAGO: Una composición inmunógena que comprende al menos dos dominios 1-2 de coagulasa estafilocócica diferentes, en donde cada uno de los al menos dos dominios […]
Cadena alfa del receptor de IgE de alta afinidad de fusión Fc, del 13 de Mayo de 2020, de KISSEI PHARMACEUTICAL CO., LTD.: Una proteína de fusión Fc que comprende: (i) una cadena α del receptor de IgE de alta afinidad; y (ii) la región Fc de IgG1, en donde la región del fragmento […]
Receptores de antígeno quimérico dirigidos a antígeno de maduración de células B, del 6 de Mayo de 2020, de PFIZER INC.: Un receptor de antígeno quimérico específico de antígeno de maduración de células B (BCMA) (CAR) que comprende un dominio de unión a ligando extracelular, […]
Procedimiento para diagnosticar cáncer y kit de diagnóstico a través de la medición de actividad de células NK, del 6 de Mayo de 2020, de NKMAX Co., Ltd: Un procedimiento para medir la actividad de los linfocitos citolíticos naturales (NK), que comprende: estimular las células NK en una muestra de sangre entera incubando […]
Construcción de nuevas variantes de dextransacarasa DSR-S por ingeniería genética, del 6 de Mayo de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE: 1. Una dextransacarasa que consiste en una secuencia que tiene el 90 %, el 95 % o el 98 % de similitud de secuencia con una secuencia de aminoácidos seleccionada del fragmento […]
Proteínas de fusión para la inhibición de angiogénesis, del 29 de Abril de 2020, de Allgenesis Biotherapeutics Inc: Una proteína de fusión que comprende: un péptido de unión a integrina que comprende unión de desintegrina a integrina αvβx […]