COMPOSICIONES QUE COMPRENDEN TRANS-(+/-)-DELTA-9-TETRAHIDROCANNABINOL CRISTALINO.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/005761.
Solicitante: EURO-CELTIQUE S.A..
Nacionalidad solicitante: Luxemburgo.
Dirección: 2, AVENUE CHARLES DE GAULLE 1653 LUXEMBOURG LUXEMBURGO.
Inventor/es: KUPPER,ROBERT,J.
Fecha de Publicación: .
Fecha Solicitud PCT: 14 de Junio de 2006.
Clasificación PCT:
- A61K31/352 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensados con carbociclos, p. ej. canabinoles, metantelina.
- A61P1/08 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 1/00 Medicamentos para el tratamiento de trastornos del tracto alimentario o del aparato digestivo. › para las náuseas, cinetosis o vértigos; Antieméticos.
- A61P29/02 A61P […] › A61P 29/00 Agentes analgésicos, antipiréticos o antiinflamatorios que no actúan sobre el sistema nervioso central, p. ej. agentes antirreumáticos; Antiinflamatorios no esteroideos (AINEs). › sin efecto antiinflamatorio.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357250_T3.pdf


Fragmento de la descripción:
1. Campo de la invención
La presente invención se refiere a composiciones farmacéuticas y a formas de dosificación mejoradas para ser usadas como medicamento, que se constituyen con trans-(±)-Δ9-tetrahidrocannabinol en forma cristalina. La presente invención se refiere también a dicho compuesto para ser usado en el tratamiento o la prevención de una afección tal como, entre otras, dolor, emesis, pérdida de apetito o pérdida de peso.
2. Antecedentes de la invención
En 1997, los Institutos Nacionales de la Salud publicaron un informe elaborado por grupo de expertos ad hoc que resumía los datos científicos disponibles en relación con las aplicaciones terapéuticas para la marihuana (“Workshop on the Medical Utility of Marijuana”, http://www.nih.gov/news/medmarijuana/MedicalMarijuana.htm). Este informe incluía una recomendación según la cual los NIH deberían considerar el apoyo de la investigación del uso potencial de marihuana para las siguientes indicaciones médicas: estimulación del apetito/caquexia, náusea y vómitos tras una terapia contra el cáncer, trastornos neurológicos y del movimiento, dolor, y glaucoma. En 1999, se publicó un segundo informe (“Marijuana and Medicine, Assessing the Science Base”, Janet E. Joy, Stanley J. Watson, Jr., y John A. Benson, Jr., Editores; Instituto de Medicina, 1999, National Academy Press, Washington D.C. (http://books.nap.edu/catalog/6376.html)), que proporcionaba una revisión de los usos terapéuticos reales y potenciales de los cannabinoides. Este último informe identificaba afecciones adicionales para las cuales podría resultar útil el trans-(-)-Δ9-tetrahidrocannabinol, incluyendo el dolor somático, el dolor crónico, el dolor neuropático, inflamación, espasticidad muscular incluyendo la asociada a lesiones de la médula espinal y esclerosis múltiple, trastornos de movimiento incluyendo distonía, enfermedad de Parkinson, enfermedad de Huntington, y síndrome de Tourette, cefalea migrañosa, epilepsia, y enfermedad de Alzheimer. Además de identificar dichas aplicaciones médicas para la marihuana y/o el trans-(-)-Δ9-tetrahidrocannabinol, ese informe resaltaba la necesidad de sistemas de administración de cannabinoides de inicio de respuesta rápido, no fumados, seguros y fiables.
Posteriormente, se han producido numerosos informes en la bibliografía, que han documentado la utilidad terapéutica del trans-(-)-Δ9-tetrahidrocannabinol, que es el producto natural, activo, que se encuentra en la marihuana. La patente U.S. n.º 6.713.048 B2 proporciona una recopilación de referencias, así como un resumen de los datos proporcionados en dichas referencias en relación con el uso del Δ9THC para el tratamiento de anorexia y caquexia asociadas al SIDA, náusea y emesis debidos a quimioterapia contra el cáncer, dolor debido a un cáncer avanzado, espasticidad relacionada con la esclerosis múltiple y lesiones de la médula espinal, y glaucoma. El término “THC” se ha usado en la bibliografía para referirse al material resinoso lipófilo, insoluble en agua, ópticamente activo, identificado o bien como Δ9-THC o bien como Δ1-THC, dependiendo de si el sistema de numeración se basa en el usado para compuestos de pirano o monoterpenoides, respectivamente (Agurell et al., eds. The Cannabinoids: Chemical, Pharmacologic, and Therapeutic Aspects: Nueva York, Academic Press (1984); Agurell et al., Pharmacol. Rev 38(1):21-43 (1986); Mechoulam ed., Marijuana: Chemistry, Pharmacology, Metabolism and Clinical Effects, Nueva York: Academic Press (1973); Mechoulam, Pharmacol Biochem Behav 40(3):461-464 (1991)).
En particular, el (-)-6a,10a-trans-Δ9-tetrahidrocannabinol (es decir, “trans-(-)-Δ9-THC”) se ha identificado como el componente responsable principalmente de los efectos antieméticos asociados al cannabis (S.E. Sallen et al., N. Engl. J. Med. 302: 135 (1980); A.E. Chang et al., Cancer 47:1746 (1981); y
D. S. Poster et al., J. Am. Med. Asso. 245:2047 (1981)). Se ha informado de que este compuesto, es decir, el trans-(-)-Δ9-THC, es útil como antiemético para aliviar las náuseas y los vómitos en pacientes que reciben quimioterapia contra el cáncer y para estimular el aumento de peso en pacientes que padecen infección por VIH sintomática (véase la patente U.S. n.º 6.703.418 B2 de Plasse).
Aunque se ha informado de que tanto el trans-(-)-Δ9-THC (es decir, el producto natural) como su isómero óptico trans-(+)-Δ9-THC (es decir, los enantiómeros trans-(-)- y trans-(+)-, respectivamente, del trans-(±)-Δ9-THC) son útiles para el tratamiento del dolor, el enantiómero trans-(-)-Δ9-THC se ha identificado como el más potente de los dos enantiómeros (véase, por ejemplo, G. Jones et al., Biochem. Pharmacol. 23:439 (1974); S.H. Roth, Can. J. Physiol. Pharmacol. 56:968 (1978); B.R. Martin et al., Life Sciences 29:565 (1981); M. Reichman et al., Mol. Pharmacol. 34:823 (1988); y M. Reichman et al., Mol. Pharmacol. 40:547 (1991)). De hecho, una publicación más reciente ha afirmado que la actividad farmacológica atribuida al trans-(+)-Δ9-THC en informes publicados anteriores es probable que represente la presencia de niveles bajos de trans-(-)-Δ9-THC en los materiales sometidos a prueba. De hecho, cuando está suficientemente purificado, el trans-(+)-Δ9-THC presenta aproximadamente solo un 1 % de la actividad del enantiómero trans-(-)-Δ9-THC (Mechoulam et al., Pharmacol Biochem Behav 40(3):461-464 (1991)).
El trans-(-)-Δ9-THC purificado es un material resinoso espeso y viscoso que se ha comparado con la savia del pino y el pegamento a base de caucho. Este material es químicamente inestable a la luz, el oxígeno, y el calor. Por consiguiente, el trans-(-)-Δ9-THC resulta extremadamente difícil de formular y no se adapta fácilmente para su incorporación a formas de dosificación convencionales que están disponibles típicamente para otros compuestos farmacéuticos sólidos.
El trans-(-)-Δ9-THC sintético (es decir, “dronabinol”), que lo vende actualmente como Marinol®, Unimed Pharmaceuticals, Inc., está disponible en valores de dosificación de 2,5; 5; y 10 mg. El trans-(-)Δ9-THC de Marinol® se formula como una solución en aceite de sésamo, que se distribuye en cápsulas de gelatina. Esta forma administrada oralmente de trans-(-)-Δ9-THC está sujeta a un metabolismo de primer paso en el hígado, se absorbe de manera relativamente lenta, y presenta un inicio retardado de la actividad farmacológica de entre media hora y dos horas. Por contraposición, la administración del material activo, trans-(-)-Δ9-THC, por inhalación (por ejemplo, fumando) da como resultado típicamente un inicio de la actividad farmacológica antes de de los 10 minutos después de la administración (“Workshop on the Medical Utility of Marijuana”, (http://www.nih.gov/news/medmarijuana/MedicalMarijuana.htm); patente U.S. n.º 6.713.048 B2, por ejemplo, Tabla 2, y las referencias citadas en dicho documento). No obstante, a la vista de los peligros inherentes de fumar (por ejemplo, enfisema y cáncer de pulmón), así como de la composición no definida de los materiales vegetales usados para preparar cigarrillos de marihuana (véanse, por ejemplo, “Marijuana and Medicine, Assessing the Science Base”, Janet E. Joy, Stanley J. Watson,Jr., y John A. Benson, Jr., Editores; Instituto de Medicina, 1999, National Academy Press, Washington D.C.), la administración de trans-(-)-Δ9-THC fumándolo no es una opción preferida. Teniendo en cuenta estas cuestiones, la técnica está bastante repleta de intentos por proporcionar formulaciones de trans-(-)-Δ9-THC terapéuticamente eficaces y mejoradas.
La patente U.S. n.º 6.328.992 describe un sistema de administración transdérmica para compuestos de cannabinoides, en el que el compuesto activo se formula como una mezcla que comprende un vehículo y un potenciador de la permeación. Según la patente 6.328.992, los vehículos adecuados pueden incluir caucho natural, materiales semisólidos viscoelásticos, hidrogeles, polímeros termoplásticos, elastómeros y elastómeros termoplásticos, o un aceite seleccionado del grupo consistente en aceites minerales, aceites vegetales, aceites de pescado, aceites animales, tetracloruro de carbono, soluciones etanólicas de resinas y mezclas de pirahexilo. Los potenciadores de la permeación de las formulaciones de la patente 6.328.992 incluyen surfactantes o disolventes no iónicos, por ejemplo, ésteres de glicerol, ésteres de poliglicerol, ésteres alquílicos de ácidos grasos, ésteres de sorbitán... [Seguir leyendo]
Reivindicaciones:
1. Composición farmacéutica que comprende trans-(±)-Δ9-tetrahidrocannabinol en forma cristalina y un vehículo farmacéuticamente aceptable para su uso como medicamento.
2. Composición farmacéutica que comprende trans-(±)-Δ9-tetrahidrocannabinol, en donde dicha composición está formulada con trans-(±)-Δ9-tetrahidrocannabinol en forma cristalina y un vehículo farmacéuticamente aceptable, para su uso como medicamento.
3. Forma de dosificación que comprende una cantidad terapéuticamente eficaz de trans-(±)-Δ9tetrahidrocannabinol en forma cristalina y un vehículo farmacéuticamente aceptable, para su uso como medicamento.
4. Forma de dosificación que comprende una cantidad terapéuticamente eficaz de trans-(±)-Δ9tetrahidrocannabinol, en donde dicha forma de dosificación está formulada con trans-(±)-Δ9tetrahidrocannabinol en forma cristalina, para su uso como medicamento.
5. Composición farmacéutica o forma de dosificación para uso de una cualquiera de las reivindicaciones 1 a 4, en donde el trans-(±)-Δ9-tetrahidrocannabinol cristalino comprende por lo menos un 95 %, preferentemente por lo menos un 98 %, más preferentemente por lo menos un 99 %, todavía más preferentemente por lo menos un 99,5 % y de la forma más preferente por lo menos un 99,9 % en peso de la cantidad total de cannabinoides en dicha composición.
6. Composición farmacéutica o forma de dosificación para uso de una cualquiera de las reivindicaciones 1 a 4, en donde el trans-(±)-Δ9-tetrahidrocannabinol cristalino consta esencialmente de trans-(-)-Δ9-tetrahidrocannabinol y trans-(+)-Δ9-tetrahidrocannabinol.
7. Composición farmacéutica o forma de dosificación para uso de una cualquiera de las reivindicaciones 1 a 4, en donde la relación molar de trans-(-)-Δ9-tetrahidrocannabinol con respecto a trans-(+)-Δ9-tetrahidrocannabinol está dentro de un intervalo de entre 0,8:1,2 y 1,2:0,8, preferentemente dentro de un intervalo de entre 0,9:1,1 y 1,1:0,9, más preferentemente entre 0,95:1,05 y 1,05:0,95 y de la forma más preferente 1:1.
8. Forma de dosificación para uso de la reivindicación 3 ó 4, en donde dicha cantidad de trans-(±)Δ9-tetrahidrocannabinol cristalino está dentro de un intervalo de entre 0,1 mg y 100 mg, preferentemente dentro de un intervalo de entre 0,5 mg y 75 mg, más preferentemente entre 2 mg y 50 mg, y de la forma más preferente entre 5 mg y 25 mg.
9. Forma de dosificación para uso de la reivindicación 3 ó 4, en donde dicha cantidad de trans-(±)Δ9-tetrahidrocannabinol cristalino es 80 mg, 40 mg, 20 mg, 10 mg ó 5 mg.
10. Composición farmacéutica o forma de dosificación para uso de una cualquiera de las reivindicaciones 1 a 4, en donde el trans-(±)-Δ9-tetrahidrocannabinol cristalino se prepara mediante un proceso que comprende:
I) dejar que trans-(-)-Δ9-tetrahidrocannabinol y trans-(+)-Δ9-tetrahidrocannabinol cristalicen desde una primera composición que comprende trans-(-)-Δ9tetrahidrocannabinol, trans-(+)-Δ9-tetrahidrocannabinol, y un disolvente orgánico no polar para proporcionar trans-(±)-Δ9-tetrahidrocannabinol cristalino, en donde la primera composición se obtiene:
(a) formando una composición bifásica que comprende (i) una primera fase orgánica, y (ii) una fase alcohólico-cáustica que contiene el trans-(-)-Δ9-tetrahidrocannabinol y el trans-(+)-Δ9-tetrahidrocannabinol;
(b) separando el trans-(-)-Δ9-tetrahidrocannabinol y el trans-(+)-Δ9tetrahidrocannabinol de la fase alcohólico-cáustica; y
(c) haciendo entrar en contacto el trans-(-)-Δ9-tetrahidrocannabinol y el trans-(+)-Δ9tetrahidrocannabinol de la etapa (b), con un disolvente orgánico no polar para formar la primera composición; o
II) dejar que trans-(-)-Δ9-tetrahidrocannabinol y trans-(+)-Δ9-tetrahidrocannabinol cristalicen desde una primera composición que comprende trans-(-)-Δ9tetrahidrocannabinol, trans-(+)-Δ9-tetrahidrocannabinol, y un disolvente orgánico no polar para proporcionar trans-(±)-Δ9-tetrahidrocannabinol cristalino, en donde la primera composición se obtiene:
(a) formando una composición bifásica que comprende (i) una primera fase orgánica, y (ii) una fase alcohólico-cáustica que contiene trans-(-)-Δ9-tetrahidrocannabinol;
(b) separando el trans-(-)-Δ9-tetrahidrocannabinol de la fase alcohólico-cáustica; y
(c) haciendo entrar en contacto el trans-(-)-Δ9-tetrahidrocannabinol de la etapa (b) con trans-(+)-Δ9-tetrahidrocannabinol y un disolvente orgánico no polar para formar la primera composición; o
III) dejar que trans-(-)-Δ9-tetrahidrocannabinol y trans-(+)-Δ9-tetrahidrocannabinol cristalicen desde una primera composición que comprende trans-(-)-Δ9tetrahidrocannabinol, trans-(+)-Δ9-tetrahidrocannabinol, y un disolvente orgánico no polar para proporcionar trans-(±)-Δ9-tetrahidrocannabinol cristalino, en donde la primera composición se obtiene:
(a) formando una composición bifásica que comprende (i) una primera fase orgánica, y (ii) una fase alcohólico-cáustica que contiene trans-(+)-Δ9-tetrahidrocannabinol;
(b) separando el trans-(+)-Δ9-tetrahidrocannabinol de la fase alcohólico-cáustica; y
(c) haciendo entrar en contacto el trans-(+)-Δ9-tetrahidrocannabinol de la etapa (b) con trans-(-)-Δ9-tetrahidrocannabinol y un disolvente orgánico no polar para formar la primera composición; o
IV) dejar que trans-(-)-Δ9-tetrahidrocannabinol y trans-(+)-Δ9-tetrahidrocannabinol cristalicen desde una primera composición orgánica que comprende trans-(-)-Δ9tetrahidrocannabinol, trans-(+)-Δ9-tetrahidrocannabinol, y un disolvente orgánico no polar, para proporcionar trans-(±)-Δ9-tetrahidrocannabinol cristalino, en donde la primera composición orgánica se obtiene:
(a) formando una primera composición bifásica que comprende (i) una primera fase orgánica, y (ii) una fase alcohólico-cáustica que contiene el trans-(-)-Δ9tetrahidrocannabinol y el trans-(+)-Δ9-tetrahidrocannabinol;
(b) separando la fase alcohólico-cáustica de la primera fase orgánica;
(c) haciendo entrar en contacto la fase alcohólico-cáustica separada con ácido para proporcionar una fase alcohólica tratada con ácido que contiene trans-(-)-Δ9tetrahidrocannabinol y trans-(+)-Δ9-tetrahidrocannabinol;
(d) formando una segunda composición bifásica que comprende (i) la fase alcohólica tratada con ácido de la etapa (c) y (ii) una segunda fase orgánica;
(e) separando la segunda fase orgánica de la etapa (d) que contiene trans-(-)-Δ9tetrahidrocannabinol y trans-(+)-Δ9-tetrahidrocannabinol; y
(f) haciendo entrar en contacto la segunda fase orgánica separada de la etapa (e) con un disolvente orgánico no polar para formar la primera composición orgánica; o
V) dejar que trans-(-)-Δ9-tetrahidrocannabinol y trans-(+)-Δ9-tetrahidrocannabinol cristalicen desde una segunda composición orgánica que comprende trans-(-)-Δ9tetrahidrocannabinol, trans-(+)-Δ9-tetrahidrocannabinol, y un disolvente orgánico no polar, para proporcionar trans-(+)-Δ9-tetrahidrocannabinol cristalino, en donde la segunda composición orgánica se obtiene:
(a) formando una primera composición bifásica que comprende (i) una primera fase orgánica, y (ii) una fase alcohólico-cáustica que contiene el trans-(-)-Δ9tetrahidrocannabinol;
(b) separando la fase alcohólico-cáustica de la primera fase orgánica;
(c) haciendo entrar en contacto la fase alcohólico-cáustica separada con ácido para proporcionar una fase alcohólica tratada con ácido que contiene trans-(-)-Δ9tetrahidrocannabinol;
(d) formando una segunda composición bifásica que comprende la fase alcohólica tratada con ácido de la etapa (c) y una segunda fase orgánica;
(e) separando la segunda fase orgánica de la etapa (d) que contiene trans-(-)Δ9-tetrahidrocannabinol; y
(f) haciendo entrar en contacto la segunda fase orgánica separada de la etapa (e) con trans-(+)-Δ9-tetrahidrocannabinol y un disolvente orgánico no polar para formar la segunda composición orgánica; o
VI) dejar que trans-(-)-Δ9-tetrahidrocannabinol y trans-(+)-Δ9-tetrahidrocannabinol cristalicen desde una segunda composición orgánica que comprende trans-(-)-Δ9tetrahidrocannabinol, trans-(+)-Δ9-tetrahidrocannabinol, y un disolvente orgánico no polar, para proporcionar trans-(+)-Δ9-tetrahidrocannabinol cristalino, en donde la segunda composición orgánica se obtiene:
(a) formando una primera composición bifásica que comprende (i) una primera fase orgánica, y (ii) una fase alcohólico-cáustica que contiene el trans-(+)-Δ9tetrahidrocannabinol;
(b) separando la fase alcohólico-cáustica de la primera fase orgánica;
(c) haciendo entrar en contacto la fase alcohólico-cáustica separada con ácido para proporcionar una fase alcohólica tratada con ácido que contiene trans-(+)-Δ9tetrahidrocannabinol;
(d) formando una segunda composición bifásica que comprende la fase alcohólica tratada con ácido de la etapa (c) y una segunda fase orgánica;
(e) separando la segunda fase orgánica de la etapa (d) que contiene trans-(+)Δ9-tetrahidrocannabinol; y
(f) haciendo entrar en contacto la segunda fase orgánica separada de la etapa (e) con trans-(-)-Δ9-tetrahidrocannabinol y un disolvente orgánico no polar para formar la segunda composición orgánica.
11. Forma de dosificación para uso de la reivindicación 3 ó 4, en donde la forma de dosificación es una forma de dosificación unitaria.
12. Forma de dosificación para uso de la reivindicación 11, que está adaptada para administración oral, administración parenteral, administración transmucosal, administración transdérmica, o administración por inhalación.
13. Forma de dosificación oral, cannabinoide, que comprende una primera composición y una segunda composición, en donde la primera composición comprende una cantidad terapéuticamente eficaz de trans-(±)-Δ9-tetrahidrocannabinol en forma cristalina, y la segunda composición comprende una cantidad eficaz de un agente que es adverso para la actividad farmacológica del trans-(±)-Δ9-tetrahidrocannabinol en forma cristalina, preferentemente dicho agente se selecciona del grupo consistente en SR 141716 A, SR 144528, y combinaciones de los mismos, para su uso como medicamento.
14. Forma de dosificación oral, cannabinoide, de la reivindicación 13, en donde la segunda composición está recubierta con una capa interior soluble en ácidos y una capa exterior soluble en bases.
15. Forma de dosificación oral, cannabinoide, de la reivindicación 13, en donde dicho trans-(±)-Δ9tetrahidrocannabinol cristalino comprende por lo menos un 95 %, preferentemente por lo menos un 98 %, más preferentemente por lo menos un 99 %, todavía más preferentemente por lo menos un 99,5 % y de la forma más preferente por lo menos un 99,9 % en peso de la cantidad total de cannabinoides en dicha primera composición.
16. Forma de dosificación oral, cannabinoide, de la reivindicación 13, en donde la primera composición y la segunda composición están cada una de ellas independientemente en una forma seleccionada del grupo consistente en polvos, gránulos, micropartículas, multipartículas, nanopartículas, perlas, y mezclas de los mismos, contenidos dentro de una cápsula; o
seleccionada del grupo consistente en polvos, gránulos, micropartículas, multipartículas, nanopartículas, y mezclas de los mismos, dispersados en una matriz farmacéuticamente aceptable.
17. Forma de dosificación oral, cannabinoide, de la reivindicación 13, en forma de un comprimido bicapa que tiene una primera capa que comprende la primera composición y una segunda capa que comprende la segunda composición, en donde el comprimido está recubierto con un recubrimiento que se disuelve en el estómago.
18. Forma de dosificación de liberación controlada, cannabinoide, adecuada para una dosificación de 8 horas, 12 horas ó 24 horas en un paciente humano, que comprende una matriz farmacéuticamente aceptable que comprende una cantidad terapéuticamente eficaz de trans(±)-Δ9-tetrahidrocannabinol en forma cristalina y un material farmacéuticamente aceptable de liberación controlada, para su uso como medicamento para administración oral.
19. Forma de dosificación de liberación controlada, cannabinoide, para uso de la reivindicación 18, en donde el material de liberación controlada se selecciona del grupo consistente en polímeros hidrófobos, polímeros hidrófilos, gomas, materiales derivados de proteínas, ceras, gomas laca, aceites, y mezclas de los mismos.
20. Forma de dosificación de liberación controlada, cannabinoide, para uso de la reivindicación 18, proporcionando, dicha forma de dosificación después de su administración a un paciente humano, una relación C24/Cmax de entre 0,55 y 1, preferentemente entre 0,55 y 0,85; más preferentemente entre 0,55 y 0,75; de la forma más preferente entre 0,60 y 0,70, y proporcionando dicha forma de dosificación un efecto terapéutico durante por lo menos 24 horas, en donde Cmax es preferentemente una concentración de umbral subsicotrópico.
21. Forma de dosificación de liberación controlada, cannabinoide, para uso de la reivindicación 18, en donde dicho trans-(±)-Δ9-tetrahidrocannabinol cristalino comprende por lo menos un 95 %, preferentemente por lo menos un 98 %, más preferentemente por lo menos un 99 %, todavía más preferentemente por lo menos un 99,5 % y de la forma más preferente por lo menos un 99,9 % en peso de la cantidad total de cannabinoides en dicha forma de dosificación.
22. Forma de dosificación para uso de la reivindicación 18, en donde dicha matriz comprende una pluralidad de matrices multipartícula, en donde dichas matrices multipartícula preferentemente se comprimen obteniendo un comprimido, se disponen en una cápsula farmacéuticamente aceptable o se disponen en una suspensión farmacéuticamente aceptable.
23. Proceso para la preparación de una forma de dosificación cannabinoide, de liberación controlada, oral y sólida, según la reivindicación 18, que comprende la etapa de incorporar una cantidad terapéuticamente eficaz de trans-(±)-Δ9-tetrahidrocannabinol cristalino en un material de liberación controlada farmacéuticamente aceptable, en donde el material de liberación controlada comprende una matriz seleccionada del grupo consistente en polímeros hidrófobos, polímeros hidrófilos, gomas, materiales derivados de proteínas, ceras, gomas laca, aceites, y mezclas de los mismos, formando una formulación matricial de liberación controlada, proporcionando, dicha forma de dosificación después de su administración a un paciente humano, una relación C24/Cmax de entre 0,55 y 1, preferentemente entre 0,55 y 0,85; más preferentemente entre 0,55 y 0,75, de la forma más preferente entre 0,60 y 0,70; y un efecto terapéutico durante por lo menos 24 horas, en donde dicho trans-(±)-Δ9-tetrahidrocannabinol está presente en dicha forma de dosificación en forma cristalina.
24. Proceso de la reivindicación 23, en el que dicho trans-(±)-Δ9-tetrahidrocannabinol cristalino comprende por lo menos un 95 %, preferentemente por lo menos un 98 %, más preferentemente por lo menos un 99 %, todavía más preferentemente por lo menos un 99,5 % y de la forma más preferente por lo menos un 99,9 % en peso de la cantidad total de cannabinoides en dicha forma de dosificación.
25. Composición cannabinoide de trans-(±)-Δ9-tetrahidrocannabinol, en la que dicha composición está formulada con trans-(±)-Δ9-tetrahidrocannabinol en forma cristalina y un vehículo farmacéuticamente aceptable adaptado para administración transmucosal o transdérmica, para su uso como medicamento para administración transmucosal o transdérmica.
26. Composición cannabinoide para uso de la reivindicación 25, en la que dicho trans-(±)-Δ9tetrahidrocannabinol cristalino comprende por lo menos un 95 %, preferentemente por lo menos un 98 %, más preferentemente por lo menos un 99 %, todavía más preferentemente por lo menos un 99,5 % y de la forma más preferente por lo menos un 99,9 % en peso de la cantidad total de cannabinoides en dicha composición.
27. Uso de una cantidad eficaz de la composición o la forma de dosificación según una cualquiera de las reivindicaciones 1 a 4 en la preparación de un medicamento para el tratamiento del dolor, emesis, pérdida de apetito o pérdida de peso, para el tratamiento de un mamífero que lo necesite.
28. Uso de una cantidad terapéuticamente eficaz de trans-(±)-Δ9-tetrahidrocannabinol en forma cristalina mezclado opcionalmente con un vehículo farmacéuticamente aceptable, en la producción de un medicamento, para ser administrado mediante deposición de trans-(±)-Δ9tetrahidrocannabinol en los pulmones de un mamífero que lo necesite.
29. Uso de la reivindicación 28, en el que dicho trans-(±)-Δ9-tetrahidrocannabinol cristalino comprende por lo menos un 95 %, preferentemente por lo menos un 98 %, más preferentemente por lo menos un 99 %, todavía más preferentemente por lo menos un 99,5 % y de la forma más preferente por lo menos un 99,9 % en peso de la cantidad total de cannabinoides en dicha composición.
30. Uso de la reivindicación 28, en el que dicho trans-(±)-Δ9-tetrahidrocannabinol cristalino, opcionalmente mezclado con un vehículo farmacéuticamente aceptable, está en una forma seleccionada del grupo consistente en polvos, gránulos, micropartículas, nanopartículas y mezclas de los mismos.
5 31. Uso de la reivindicación 28, en el que dicho trans-(±)-Δ9-tetrahidrocannabinol cristalino se aplica a los pulmones de dicho mamífero desde un dispositivo mecánico adecuado para administración pulmonar y capaz de depositar dicho trans-(±)-Δ9-tetrahidrocannabinol cristalino de un mamífero, seleccionado preferentemente del grupo consistente en inhalador de polvo, un inhalador de dosis unitaria, un inhalador de dosis medida, un pulverizador con bomba y un nebulizador.
32. Uso de una composición que comprende trans-(±)-Δ9-tetrahidrocannabinol, en la preparación de un medicamento que comprende mezclar una cantidad eficaz de trans-(±)-Δ9tetrahidrocannabinol en forma cristalina y un vehículo farmacéuticamente aceptable para proporcionar una composición adecuada para administración al paciente.
15 33. Uso según la reivindicación 32, en el que la composición está en forma de una suspensión o en forma de un sólido seco o polvo seco.
34. Uso según la reivindicación 32, en el que la mezcla y la administración son llevadas a cabo por el paciente.
35. Uso según la reivindicación 32, en el que la administración se lleva a cabo inmediatamente
20 después de mezclar el trans-(±)-Δ9-tetrahidrocannabinol cristalino y un vehículo farmacéuticamente aceptable para proporcionar la composición.
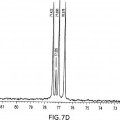
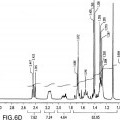
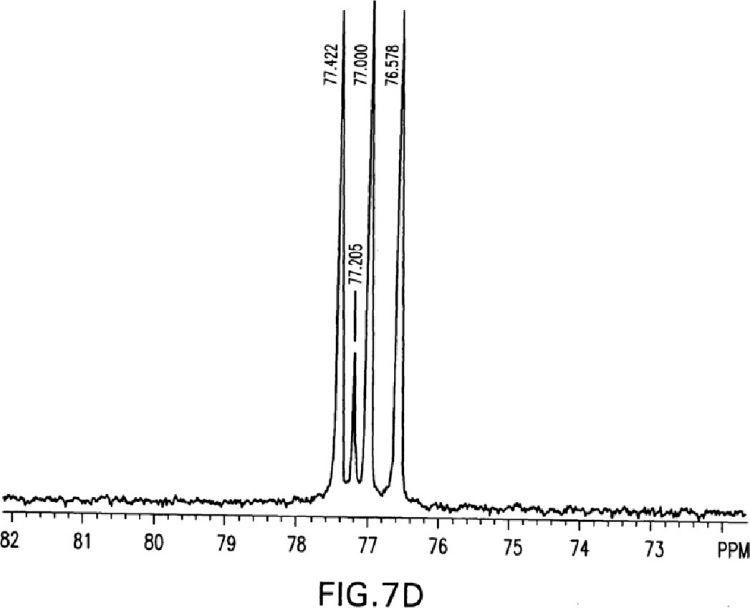
36. Composición farmacéutica para uso de la reivindicación 1 ó la reivindicación 2, en la que el trans-(±)-Δ9-THC cristalino está caracterizado por datos de difracción de rayos X en polvo que son totalmente equivalentes a
37. Composición farmacéutica o forma de dosificación para uso de cualquiera de las reivindicaciones 1 a 22, 25, 26 y 36, para su uso en el tratamiento de dolor, emesis, pérdida de apetito o pérdida de peso. Posición [º 2Theta] Altura (recuentos) FWHM [º 2Theta] Separación d [Å] Intensidad relativa [%] 6,6692 19.498,80 0,1937 13,24282 100,00 7,5065 371,92 0,2442 11,76756 1,91 8,2160 6.175,19 0,2022 10,75285 31,67 10,0639 452,67 0,1833 8,78223 2,32 12,0785 2.719,63 0,2648 7,32158 13,95 12,5994 3.096,56 0,1849 7,01999 15,88 13,4115 1.526,84 0,1946 6,59672 7,83 15,7538 3.687,75 0,2438 5,62076 18,91 16,7992 3.184,87 0,2996 5,27328 16,33 16,9469 3.842,66 0,1379 5,22765 19,71 18,1358 824,73 0,2900 4,88753 4,23 18,3638 838,84 0,1931 4,82737 4,30 18,9889 1.149,05 0,3438 4,66985 5,89 19,4280 1.481,36 0,2117 4,56526 7,60 20,3297 5.867,26 0,2421 4,36478 30,09 21,3925 2.243,64 0,2405 4,15027 11,51 22,6319 891,49 0,2973 3,92572 4,57 23,1056 549,17 0,2055 3,84628 2,82 23,7747 914,98 0,2504 3,73952 4,69 24,8661 800,07 0,3940 3,57782 4,10 25,6949 264,12 0,2130 3,46427 1,35 26,8305 79,60 0,2079 3,32016 0,41 27,4632 144,77 0,2812 3,24509 0,74 28,6526 365,56 0,3754 3,11303 1,87 31,5552 296,56 0,3828 2,83298 1,52 33,7001 78,62 0,0830 2,65741 0,40 34,1623 86,35 0,4055 2,62251 0,44
5 38. Composición farmacéutica o forma de dosificación para uso de la reivindicación 37, en la que el trans-(±)-Δ9-THC cristalino, opcionalmente mezclado con un vehículo farmacéuticamente aceptable, se administra mediante la deposición de trans-(±)-Δ9-THC en los pulmones de un mamífero que lo necesite.
39. Composición farmacéutica o forma de dosificación para uso de la reivindicación 38, en la que dicho trans-(±)-Δ9-THC cristalino comprende por lo menos un 95 %, preferentemente por lo menos un 98 %, más preferentemente por lo menos un 99 %, todavía más preferentemente por lo menos un 99,5 % y de la forma más preferente por lo menos un 99,9 % en peso de la cantidad total de cannabinoides en dicha composición o forma de dosificación.
40. Composición farmacéutica o forma de dosificación para uso de la reivindicación 38, en la que dicho trans-(±)-Δ9-THC cristalino, opcionalmente mezclado con un vehículo farmacéuticamente aceptable, está en una forma seleccionada del grupo consistente en polvos, gránulos, micropartículas, nanopartículas y mezclas de los mismos.
41. Composición farmacéutica o forma de dosificación para uso de la reivindicación 38, en la que dicho trans-(±)-Δ9-THC cristalino se aplica a los pulmones de dicho mamífero desde un dispositivo mecánico adecuado para administración pulmonar y capaz de depositar dicho trans(±)-Δ9-THC cristalino de un mamífero, seleccionado preferentemente del grupo consistente en inhalador de polvo, un inhalador de dosis unitaria, un inhalador de dosis medida, un pulverizador con bomba y un nebulizador.
42. Composición farmacéutica que comprende trans-(±)-Δ9-THC para uso en el tratamiento de dolor, emesis, pérdida de apetito o pérdida de peso, que comprende mezclar una cantidad eficaz de trans-(±)-Δ9-THC en forma cristalina y un vehículo farmacéuticamente aceptable, para proporcionar una composición adecuada para su administración al paciente.
43. Composición farmacéutica para uso de la reivindicación 42, en la que la composición está en forma de una suspensión o en forma de un sólido seco o polvo seco.
30 44. Composición farmacéutica para uso de la reivindicación 42, en la que la mezcla y la administración son llevadas a cabo por el paciente.
45. Composición farmacéutica para uso de la reivindicación 42, en la que la administración se lleva a cabo inmediatamente después de mezclar el trans-(±)-Δ9-THC cristalino y un vehículo farmacéuticamente aceptable para proporcionar la composición.
Patentes similares o relacionadas:
Uso de cannabinoides en el tratamiento de convulsiones atónicas en el síndrome de Lennox-Gastaut, del 29 de Julio de 2020, de GW Research Limited: Cannabidiol (CBD) para su uso en el tratamiento de las convulsiones en el síndrome de Lennox-Gastaut en el que el CBD está en forma de un extracto de cannabis […]
Uso de cannabidiol en el tratamiento del complejo de esclerosis tuberosa, del 27 de Mayo de 2020, de GW Research Limited: Cannabidiol (CBD) para su uso en el tratamiento de convulsiones generalizadas o focales con deterioro en un paciente con complejo de esclerosis tuberosa […]
NANOPARTÍCULAS TERAPÉUTICAS QUE ENCAPSULAN TERPENOIDES Y/O CANNABINOIDES, del 14 de Mayo de 2020, de GBS GLOBAL BIOPHARMA: En el presente documento se proporcionan nanopartículas de PEGA que encapsulan terpenoides y cannabinoides y composiciones farmacéuticas que comprenden […]
Sales de xantilio 3,6-disustituidas, del 29 de Abril de 2020, de WISTA LABORATORIES LTD.: Un compuesto de fórmula (II) para usar en un método de tratamiento o profilaxis de una afección de tauopatía o una enfermedad de agregación de proteínas […]
Métodos para el tratamiento de enfermedades pulmonares con estabilizadores de mastocitos, del 8 de Abril de 2020, de Respivant Sciences GmbH: Una composición que comprende una sal farmacéuticamente aceptable de cromolin para uso en un método de tratamiento de un paciente que tiene una enfermedad […]
USO DE INHIBIDORES ENZIMÁTICOS DE CD38 EN PACIENTES VIH POSITIVOS, del 2 de Abril de 2020, de INSTITUTO NACIONAL DE ENFERMEDADES RESPIRATORIAS ISMAEL COSIO VILLEGAS: La presente invención proporciona el uso de antocianinas inhibidoras de CD38 para la elaboración de un medicamento para el tratamiento de la infección por VIH. Este segundo […]
Bebida que contiene CBD, del 1 de Abril de 2020, de THC Pharm GmbH The Health Concept: Bebida o su sustancia base, en particular bebida energética, que contiene una formulación líquida que contiene cannabidiol y agua y al menos un emulsionante, […]
Uso de 3-desoxiantocianidinas para el tratamiento de enfermedades oculares, del 25 de Marzo de 2020, de Biophytis: Compuesto de Fórmula I **(Ver fórmula)** en donde R1, R2, R3, R4 y R5 cada uno representa independientemente un grupo seleccionado de […]