CÉLULAS PROGENITORAS HEPÁTICAS.
Una línea de células progenitoras pluripotentes hepáticas humanas no ovales aislada a partir de tejido adulto que expresa marcadores de células hepáticas y que es capaz de diferenciarse en células hepáticas maduras,
células productoras de insulina, células osteogénicas y células epiteliales
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IT2006/000391.
Solicitante: FRESENIUS MEDICAL CARE DEUTSCHLAND GMBH.
Nacionalidad solicitante: Alemania.
Dirección: ELSE-KRONER-STRASSE 1 61352 BAD HOMBURG V.D.H. ALEMANIA.
Inventor/es: HERRERA SANCHEZ,Maria Beatriz , BUSSOLATI,Benedetta , CAMUSSI,Giovanni , BUTTIGLIERI,Stefano.
Fecha de Publicación: .
Fecha Solicitud PCT: 24 de Mayo de 2006.
Clasificación Internacional de Patentes:
- C12N5/06B14
- C12N5/06B14P
Clasificación PCT:
- C12N5/22 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células humanas.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
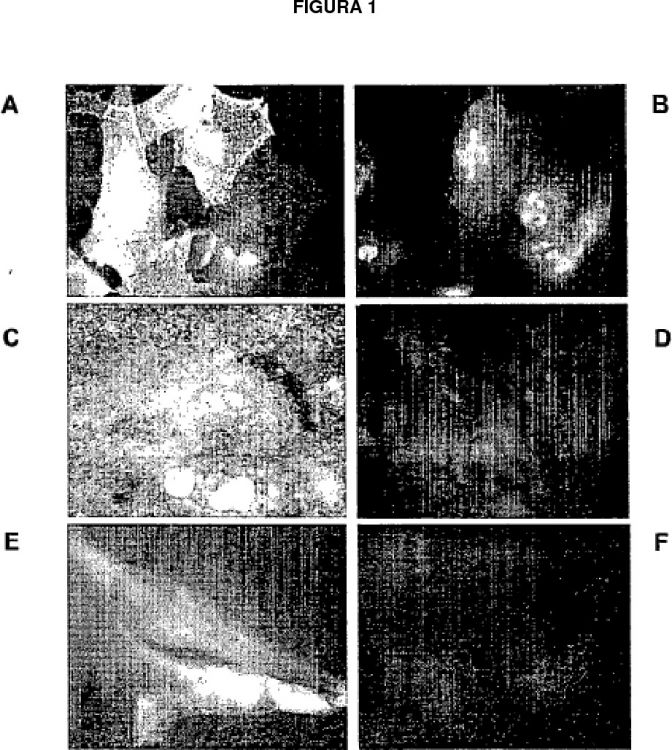
Fragmento de la descripción:
La presente invención se refiere a un procedimiento de aislamiento de células progenitoras a partir de tejido hepático adulto, células progenitoras hepáticas aisladas por el procedimiento de la invención, así como procedimientos de inducción de diferenciación de células progenitoras hepáticas aisladas y procedimientos de inmortalización condicional y selección metabólica de las células progenitoras hepáticas. Más específicamente, la 5 invención se refiere a células progenitoras hepáticas que, aunque se derivan del hígado, son diferentes morfológicamente de las células madre ovales hepáticas y no expresan marcadores que son típicos de células madre ovales hepáticas. Adicionalmente, las células progenitoras hepáticas de la invención muestran capacidad autorenovable y potencial de diferenciación multilinaje, características que permiten categorizar estas células como células progenitoras pluripotentes. 10
En la técnica anterior se describen las células madre hepáticas, por ejemplo en los documentos WO 03/078588, WO 00/43498, WO 00/03001, EP 1394263, US 2003/0138951. Las células madre hepáticas más conocidas se designan como células madre ovales hepáticas, debido a su forma ovalada característica. Las células madre ovales son un tipo bien definido de células madre hepáticas. Características típicas de las mismas son, aparte de su morfología ovalada característica, la expresión de uno o más marcadores de superficie que son típicos de 15 células madre hematopoyéticas, tales como c–kit (CD117) , CD34 y Sca–1, lo que sugiere que las células madre ovales se originan a partir de células madre hematopoyéticas. Además, las células madre ovales son progenitoras bipotentes capaces de generar tanto hepatocitos como colangiocitos in vivo (Petersen B. E., Goff J. P., Greenberger J. S., Michalopoulos G. K. (1998) Las células ovales de rata expresan el marcador de células madre hematopoyéticas Thy–1 en la rata. Hepatology 27, 433–445; Petersen B. E., Grossbard B., Hatch H., Pi L., Deng J., 20 Scott E.W. (2003) Las células ovales hepáticas positivas para A6 de ratón también expresan diversos marcadores de células madre hematopoyéticas. Hepatology 37, 632–640).
Suzuki A. y col. (2000) Hepatology, vol. 32, páginas 1230–1239 describe células progenitoras identificadas en el hígado de ratón fetal capaces de formar colonias que contienen distintos hepatocitos y colangiocitos.
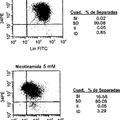
El documento US 2005/0074876 describe una línea de células hepáticas bipotenciales derivadas de tejido 25 de hígado de mamífero que es capaz de diferenciarse en hepatocitos y células de vías biliares.
Schwartz RE, y col. (2002) J. Clin. Invest., vol. 109, páginas 1291–1302 describe células progenitoras adultas multipotentes derivadas de médula espinal capaces de originar linajes embrionarios celulares in vivo y capaces de formar células similares a hepatocitos in vivo, así como la mayoría de las células neuroectodérmicas y mesodérmicas. 30
Young L., y col. (2002), PNAS, vol. 99, páginas 8078–8083, describe células madre ovales hepáticas de rata adulta capaces de diferenciarse en hepatocitos y en epitelio de vías biliares y de transdiferenciarse en células productoras de hormonas endocrinas pancreáticas.
Mahli M., y col. (200), J. Cell. Sci., vol. 115, páginas 2679–2688, describe células madre bipotentes ovales aisladas a partir de hígado humano fetal, que son capaces de originar por subpasaje células ovales, planas y 35 fusiformes que tienen expresión génica de dos linajes, en particular hepatocítico y biliar.
Sorprendentemente, los presentes inventores han encontrado ahora un procedimiento de aislamiento de células progenitoras a partir de tejido hepático adulto que da como resultado el aislamiento de una población de células progenitoras novedosa que se caracteriza tanto por la expresión de algunos marcadores de células que son típicos de células hepáticas, tales como albúmina y α–fetoproteína, como por la ausencia de características 40 morfológicas y moleculares típicas de células madre ovales. Las células progenitoras hepáticas novedosas de la invención son, de hecho, más de forma epitelioide que de forma ovalada. Además, tales células no parecen expresar algunos de los marcadores de células hemopoyéticas que son típicos de las células madre ovales hepáticas.
Por consiguiente, en un primer aspecto, la presente invención proporciona un procedimiento de aislamiento de una línea de células progenitoras hepáticas humanas no ovales que es tal como se define en la reivindicación 1, 45 procedimiento que comprende las etapas de:
(i) cultivar hepatocitos maduros humanos derivados de hígado adulto en un medio de cultivo celular hasta la muerte de los hepatocitos maduros y selección de una población de células supervivientes que tienen morfología epitelioide;
(ii) expandir la población de células supervivientes cultivando en un medio de cultivo que contenga glucosa, 50 que contenga suero, suplementado con hEGF (factor de crecimiento epitelial humano) y bFGF (factor de crecimiento fibroblástico básico) y que comprenda sales inorgánicas, aminoácidos y vitaminas habituales necesarias para el crecimiento de células de mamíferos.
Los hepatocitos maduros empleados en el procedimiento de la invención se obtienen a partir de tejido hepático adulto según cualquier procedimiento en sí mismo conocido para el aislamiento de hepatocitos a partir de hígado de mamíferos, preferentemente hígado humano. El significado de la expresión “tejido hepático adulto” tal como se utiliza en el presente documento está bien establecido en la técnica anterior y significa tejido hepático obtenido a partir de un organismo postnatal. El significado de la expresión “hepatocitos maduros” también está bien 5 establecido en la técnica anterior. Esta expresión abarca hepatocitos completamente diferenciados que no tienen la capacidad de proliferar in vitro. Los marcadores de diferenciación utilizados comúnmente para hepatocitos maduros son marcadores bioquímicos, tales como albúmina, tirosina aminotransferasa (TAT), citocromo P450, TO, serina deshidratasa (SDH) , Cxs 32 y 26, así como marcadores morfológicos, tales como formación de canalículos biliares, uniones en hendidura, peroxisomas con nucleoides cristalinos, un número elevado de mitocondrias (véase por 10 ejemplo Mitaka T (2002). Reconstruction of hepatic organoid by hepatic stem cells. J Hepatobiliary Pancreat Surg.; 9 (6): 697–703).
Los hepatocitos maduros pueden congelarse opcionalmente en un medio de cultivo que contiene suero en presencia de un agente crioprotector antes de cultivar. Los hepatocitos se congelan preferentemente en un medio líquido que comprende suero fetal bovino (FCS) inactivado por calor al 20% o suero humano (HS) inactivado por 15 calor al 20% y que contiene dimetilsulfóxido (DMSO) como agente crioprotector. De manera alternativa, cualquier otro compuesto conocido por poseer propiedades crioprotectoras puede utilizarse como agente crioprotector, tal como por ejemplo glicerol, etilenglicol, polietilenglicol o polvinilpirrolidona. Es preferible llevar a cabo la congelación a temperaturas muy bajas, por ejemplo situando la muestra de células a –80ºC y posteriormente en nitrógeno líquido.
El procedimiento de aislamiento de la invención comprende una primera etapa en la que el cultivo primario 20 de hepatocitos maduros se somete a selección negativa y una segunda etapa en la que la población de células supervivientes se expande.
En la primera etapa, los hepatocitos se cultivan en condiciones restrictivas hasta que se induce la muerte del cultivo primario de hepatocitos maduros. Para este propósito, los hepatocitos se pueden sembrar a una densidad de aproximadamente 1,0–1,5 x 105 células viables por cm2 sobre placas de cultivo recubiertas con colágeno y se 25 pueden cultivar en un medio de cultivo celular de hepatocitos durante aproximadamente al menos 2 semanas. Después de aproximadamente 2 semanas, la gran mayoría de los hepatocitos mueren pero sobrevive una población de células que forman agrupaciones. Tales células que forman agrupaciones se distinguen fácilmente a partir de hepatocitos maduros por su morfología epitelioide.
En la segunda etapa, se eliminan las agrupaciones de células supervivientes, se colocan en una placa en 30 dilución limitante y se cultivan en un medio de cultivo rico que contenga glucosa, que contenga suero, suplementado...
Reivindicaciones:
1. Una línea de células progenitoras pluripotentes hepáticas humanas no ovales aislada a partir de tejido adulto que expresa marcadores de células hepáticas y que es capaz de diferenciarse en células hepáticas maduras, células productoras de insulina, células osteogénicas y células epiteliales.
2. La línea celular según la reivindicación 1, que expresa los marcadores de células hepáticas albúmina y α–fetoproteína. 5
3. La línea celular según las reivindicaciones 1 ó 2, que expresa el marcador de células hepáticas CK18.
4. La línea celular según cualquiera de las reivindicaciones 1 a 3, que expresa los marcadores de células madre CD44, CD29, CD73, CD146, CD105 y CD90.
5. La línea celular según cualquiera de las reivindicaciones 1 a 4, que no expresa marcadores de células hematopoyéticas. 10
6. La línea celular según cualquiera de las reivindicaciones 1 a 5, que no expresa el marcador de células madre hematopoyéticas CD133.
7. La línea celular según cualquiera de las reivindicaciones 1 a 6, que no expresa los marcadores de células ovales CD117 (C–kit), CK 19 y CD34.
8. La línea celular según cualquiera de las reivindicaciones 1 a 7, que no expresa el marcador de células de 15 hepatocitos maduros citocromo P450 y que no sintetiza urea.
9. La línea celular según cualquiera de las reivindicaciones 1 a 8, que está inmortalizada.
10. Un procedimiento de aislar una línea de células progenitoras pluripotentes hepáticas humanas no ovales según cualquiera de las reivindicaciones 1 a 8, que comprende las etapas de:
(i) cultivar hepatocitos maduros humanos derivados de hígado adulto en un medio de cultivo celular hasta la 20 muerte de los hepatocitos maduros y selección de una población de células supervivientes que tienen morfología epitelioide;
(ii) expandir la población de células supervivientes que tienen morfología epitelioide cultivando en un medio de cultivo que contenga suero, que contenga glucosa, suplementado con hEGF (factor de crecimiento epitelial humano) y bFGF (factor de crecimiento fibroblástico básico) y que comprenda sales inorgánicas habituales, 25 aminoácidos y vitaminas necesarios para el crecimiento de células de mamíferos.
11. El procedimiento según la reivindicación 10, en el que los hepatocitos maduros se congelan en un medio de cultivo que contiene suero en presencia de un agente crioprotector y después se descongelan antes de cultivar según la etapa (i).
12. El procedimiento según la reivindicación 11, en el que el agente crioprotector es dimetilsulfóxido. 30
13. El procedimiento según cualquiera de las reivindicaciones 10 a 12, en el que el medio de cultivo celular de la etapa (i) es un medio de cultivo celular de hepatocitos.
14. El procedimiento según cualquiera de las reivindicaciones 10 a 13, en el que el medio de cultivo que contiene suero de la etapa (ii) es una mezcla de αMEM–EBM (3:1 vol/vol) suplementado con suero fetal bovino (FCS) o suero humano (HS), antibióticos y glutamina. 35
15. El procedimiento según cualquiera de las reivindicaciones 10 a 14, en el que los hepatocitos maduros se cultivan según la etapa (i) durante al menos dos semanas.
16. El procedimiento según cualquiera de las reivindicaciones 10 a 15, en el que la línea de células progenitoras pluripotentes hepáticas humanas no ovales aislada se somete además a inmortalización condicional.
17. El procedimiento según cualquiera de las reivindicaciones 10 a 16, en el que la línea de células 40 progenitoras pluripotentes hepáticas humanas no ovales aislada se somete adicionalmente a selección metabólica reemplazando glucosa por galactosa en el medio de cultivo.
18. Un procedimiento de diferenciación de la línea de células progenitoras pluripotentes hepáticas humanas no ovales según cualquiera de las reivindicaciones 1 a 9 en células hepáticas maduras capaces de expresar el marcador de células de hepatocitos maduros citocromo P450 y capaces de sintetizar urea, que comprende cultivar 45 dicha línea celular en un medio de cultivo que contiene suero suplementado con factor de crecimiento de hepatocitos (HGF) y factor 4 de crecimiento de fibroblastos (FGF–4).
19. El procedimiento según la reivindicación 18, en el que dicho medio de cultivo que contiene suero es MEM–EBM suplementado con HS, HGF o FCS al 10% y FGF–4.
20. Un procedimiento de diferenciar la línea de células progenitoras pluripotentes hepáticas humanas no ovales según cualquiera de las reivindicaciones 1 a 9 en células productoras de insulina, que comprende cultivar dicha línea celular en un medio de cultivo que contiene suero en presencia de al menos 2g/l de glucosa. 5
21. El procedimiento según la reivindicación 20, en el que el medio de cultivo que contiene suero comprende además nicotinamida.
22. El procedimiento según la reivindicación 20 ó 21, en el que el medio de cultivo que contiene suero es DMEM suplementado con HS o FCS al 2%, 4,5 g/l de glucosa y nicotinamida 10 mM.
23. Un procedimiento de diferenciar la línea de células progenitoras pluripotentes hepáticas humanas no 10 ovales según cualquiera de las reivindicaciones 1 a 9 en células osteogénicas, que comprende cultivar dicha línea celular en un medio de cultivo que contiene suero suplementado con ascorbato–2–fosfato y dexametasona con fosfato inorgánico.
24. El procedimiento según la reivindicación 23, en el que el medio de cultivo que contiene suero es MEM suplementado con FCS al 10%, HS al 10%, dexametasona 1 nM y ascorbato–2–fosfato 0,5 μM. 15
25. Un procedimiento de diferenciar la línea de células progenitoras pluripotentes hepáticas humanas no ovales según cualquiera de las reivindicaciones 1 a 9 en células endoteliales, que comprende cultivar dicha línea celular en un medio basal celular endotelial suplementado con factor de crecimiento endotelial vascular (VEGF).
26. El procedimiento según la reivindicación 25, en el que el medio basal celular endotelial es EBM–2 suplementado con 10 ng/ml de VEGF. 20
27. El procedimiento según cualquiera de las reivindicaciones 18 a 26, en el que dicha línea de células progenitoras pluripotentes hepáticas humanas no ovales se cultiva en un biorreactor.
28. Una línea de células progenitoras pluripotentes hepáticas humanas no ovales según cualquiera de las reivindicaciones 1 a 9, para usar como un medicamento.
29. La utilización de una línea de células progenitoras pluripotentes hepáticas humanas no ovales según 25 cualquiera de las reivindicaciones 1 a 9, para preparar un medicamento para el tratamiento terapéutico de daño hepático.1/2
Patentes similares o relacionadas:
 EXPANSION DE POBLACIONES DE CELULAS MADRE RENOVABLES, del 23 de Agosto de 2010, de GAMIDA CELL LTD: Un método de expansión de una población de células madre hematopoyéticas ex vivo, mientras al mismo tiempo, se inhibe sustancialmente la diferenciación de dichas […]
EXPANSION DE POBLACIONES DE CELULAS MADRE RENOVABLES, del 23 de Agosto de 2010, de GAMIDA CELL LTD: Un método de expansión de una población de células madre hematopoyéticas ex vivo, mientras al mismo tiempo, se inhibe sustancialmente la diferenciación de dichas […]
 LINEAS CELULARES DE HEPATOMAS HUMANOS, SU OBTENCION Y SUS APLICACIONES, del 1 de Julio de 2010, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Línea celular de hepatomas como la depositada el 5 de abril de 2001 en el CNCM, con el nº I-2652
LINEAS CELULARES DE HEPATOMAS HUMANOS, SU OBTENCION Y SUS APLICACIONES, del 1 de Julio de 2010, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Línea celular de hepatomas como la depositada el 5 de abril de 2001 en el CNCM, con el nº I-2652
 COMPOSICIONES Y METODOS UTILES PARA LA INFECCION POR HCV, del 13 de Noviembre de 2009, de VERTEX PHARMACEUTICALS INCORPORATED: Una composición que comprende una mezcla de células que comprende células hepáticas y células hematopoiéticas liberadas desde el hígado de un ser humano de tres meses […]
COMPOSICIONES Y METODOS UTILES PARA LA INFECCION POR HCV, del 13 de Noviembre de 2009, de VERTEX PHARMACEUTICALS INCORPORATED: Una composición que comprende una mezcla de células que comprende células hepáticas y células hematopoiéticas liberadas desde el hígado de un ser humano de tres meses […]
Anticuerpos monoclonales humanos contra CD20 para su uso en el tratamiento de esclerosis múltiple, del 5 de Junio de 2019, de GENMAB A/S: Un anticuerpo monoclonal humano aislado que se une a CD20 humano, y que comprende: (i) regiones CDR1, CDR2 y CDR3 de cadena pesada que tienen las regiones de […]
Sistemas y procedimientos de anticuerpos anti p40, del 3 de Abril de 2019, de Biocare Medical, LLC: Preparación aislada de anticuerpos que se unen específicamente a una proteína p40, en la que dichos anticuerpos se unen a un epítopo en un péptido que comprende una mezcla […]
Medio y método de cultivo de células madre, del 2 de Mayo de 2018, de RIKEN: Un método para cultivar células madre pluripotentes humanas, que comprende tratar las células madre con un inhibidor de ROCK (Rho-quinasa).
Neuquinasa, una proteína corriente abajo de neuregulina, del 1 de Marzo de 2017, de Zensun (Shanghai) Science & Technology, Co., Ltd: Un método de cribado de un agente que afecta a la actividad de neuquinasa, que comprende: (a) poner en contacto in vitro dicho agente con una célula […]
 Neuquinasa, una proteína secuencia abajo de la neuregulina, del 4 de Enero de 2016, de ZENSUN (SHANGHAI) SCIENCE AND TECHNOLOGY LIMITED (100.0%): Un ácido nucleico aislado, en donde el ácido nucleico aislado codifica un polipéptido que comprende la secuencia de aminoácidos de SEQ ID NO: 25; […]
Neuquinasa, una proteína secuencia abajo de la neuregulina, del 4 de Enero de 2016, de ZENSUN (SHANGHAI) SCIENCE AND TECHNOLOGY LIMITED (100.0%): Un ácido nucleico aislado, en donde el ácido nucleico aislado codifica un polipéptido que comprende la secuencia de aminoácidos de SEQ ID NO: 25; […]