VECTORES DE EXPRESION QUE COMPRENDEN EL PROMOTOR HS1 DEL ONCOGEN VAV1 Y SU USO PARA LA ELABORACION DE COMPOSICIONES FARMACEUTICAS DESTINADAS A TERAPIA GENICA SOMATICA.
Vectores de expresión que comprenden el promotor HS1 del oncogén VAV1 y su uso para la elaboración de composiciones farmacéuticas destinadas a terapia génica somática.
La presente invención se refiere al uso del promotor HS1 del oncogén VAV en la producción de vectores seleccionados de los grupos de vectores integrativos y, de los no integrativos, los no plasmídicos, para ser utilizados en la elaboración de composiciones farmacéuticas destinadas a terapia génica somática. Mediante la generación de vectores que contengan el promotor HS1 del oncogén VAV1, se consiguió la generación de vectores en los que el transgén marcador o terapéutico se expresa a niveles moderados, aunque estables, en varios linajes celulares tanto in vitro como in vivo
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200601477.
Solicitante: CENTRO DE INVESTIGACIONES ENERGETICAS, MEDIOAMBIENTALES Y TECNOLOGICAS (CIEMAT).
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: BUEREN,JUAN ANTONIO, ALMARZA,ELENA, ALDEA,MONTSERRAT, GUENECHEA,GUILLERMO, SEGOVIA,JOSE CARLOS.
Fecha de Solicitud: 1 de Junio de 2006.
Fecha de Publicación: .
Fecha de Concesión: 28 de Mayo de 2010.
Clasificación Internacional de Patentes:
- A61K48/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/86 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Vectores virales.
Clasificación PCT:
Fragmento de la descripción:
Vectores de expresión que comprenden el promotor HS1 del oncogén vav1 y su uso para la elaboración de composiciones farmacéuticas destinadas a terapia génica somática.
Campo de la invención
La presente invención se engloba dentro del campo de la ingeniería genética. Concretamente la invención se refiere al uso del promotor HS1 del oncogen vav en la producción de vectores seleccionados de los grupos de vectores integrativos y de los no integrativos, los no plasmídicos, para ser utilizados en la elaboración de composiciones farmacéuticas destinadas a terapia génica somática. Mediante el uso del promotor HS1 del oncogén vav, se consiguió la generación de vectores en los que el transgén se expresa a niveles moderados, aunque estables, en varios linajes celulares tanto in vitro como in vivo.
Antecedentes de la invención
El desarrollo de la terapia génica como procedimiento generalizado para el tratamiento de enfermedades dependerá del equilibrio positivo entre el beneficio clínico y el riesgo asociado a esta nueva intervención terapéutica. Aunque ya es evidente la eficacia de la terapia génica para producir una mejoría clínica en pacientes con trastornos hereditarios1-6, recientemente han surgido reservas relativas a la seguridad de dicha terapia. Los estudios experimentales han demostrado la generación de leucemias en ratones asociadas con la activación de oncogenes endógenos por provirus integrados.7,8 Además, se han observado resultados similares en pacientes humanos, cuyas células madre hematopoyéticas (CMHs) fueron transducidas con vectores gamma-retrovirales que contenían promotores virales9,10.
Hasta ahora se conocía la eficacia de las secuencias reguladoras del oncogén vav para dirigir la expresión de transgenes en células linfo-hematopoyéticas, incluidas las CMHs autorenovables17. Las secuencias reguladoras del oncogen vav están constituidas por cinco regiones HS (hipersensibles a DNasa), siendo la región HS1 el promotor proximal del gen16. Esta región HS1 fue capaz de dirigir la expresión específica de transgenes en líneas celulares hematopoyéticas in vitro, transfectadas de forma estable16, quedando demostrado que la región promotora HS1 es suficiente para conseguir la expresión en líneas celulares hematopoyéticas. A diferencia de lo que ocurre in vitro, no se han podido realizar estudios in vivo de expresión dirigida por HS1, pues para generar ratones transgénicos fue necesario insertar otras regiones HS adicionales a HS1. Por otro lado, los vectores utilizados en el estado de la técnica para realizar la transfección celular eran vectores plasmídicos15,16.
A diferencia de los estudios iniciales de terapia génica en los que se perseguían altos porcentajes de transducción con vectores que contenían promotores de actividad potente, las nuevas tendencias indican la conveniencia de controlar el número de inserciones provirales en el genoma de la célula y el uso de promotores incapaces, a ser posible, de transactivar genes endógenos tras su inserción estable en el genoma de la célula6. El interés de limitar la influencia del promotor presente en el vector sobre la expresión de genes próximos a su sitio de integración se ha visto reforzada por observaciones recientes que indican que, tanto los vectores gamma-retrovirales, como los vectores lentivirales, tienen una alta probabilidad de inserción en regiones de ADN próximas o dentro de los genes11-14.
Descripción de la invención
En la presente invención se han desarrollado vectores integrativos que comprenden el promotor HS1 del oncogén vav sin necesidad de ninguna otra región HS, particularmente sin que HS2 o HS5 deban estar presentes en la construcción génica reivindicada. Los resultados obtenidos, al demostrar la expresión moderada y estable del transgén marcador presente en el vector lentiviral, indicaron que los vectores que contienen el promotor vavHS1 constituyen una herramienta capaz de dirigir la expresión estable y moderada de transgenes en células de mamífero tanto in vitro como in vivo. Con ello se limita la problemática circunscrita a los vectores presentes en el estado de la técnica los cuales, al comprender promotores que dirigen una muy elevada expresión de los transgenes, facilitan la transactivación de otros genes, incluyendo oncogenes, tras la integración en el genoma del hospedador. Por lo tanto, el uso de vectores con promotores que dirigen una expresión moderada del transgén constituye una herramienta más segura para la terapia génica.
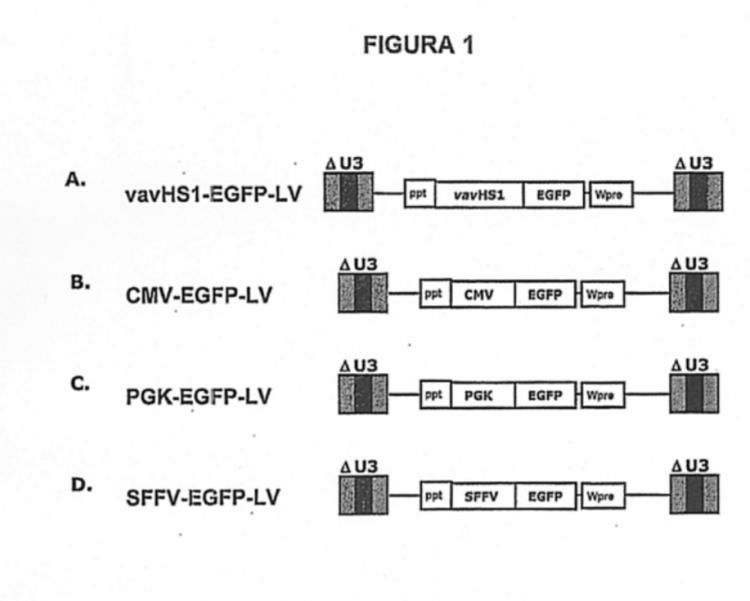
Figura 1
A. El vector lentiviral vavHS1-EGFP-LV es un vector de 8393 pb en el que el gen EGFP está bajo el control del promotor HS1-vav.
B. El vector lentiviral CMV-EGFP-LV es un vector de 7418 pb en el que el gen EGFP está bajo el control del promotor del citomegalovirus (CMV).
C. El vector lentiviral PGK-EGFP-LV es un vector de 7384 pb en el que el gen EGFP está bajo el control del promotor del gen fosfoglicerato quinasa (PGK).
D. El vector lentiviral SFFV-EGFP-LV es un vector de 8029 pb en el que el gen EGFP está bajo el control del promotor del "spleen focus forming virus" (SFFV).
Figura 2
La presente figura muestra un análisis representativo de la actividad de los promotores CMV y vavHS1 al transducir linfoblastos B humanos (células EBV-B) y células epiteliales HeLa con los vectores CMV-EGFP-LV y vavHS1-EGFP-LV en condiciones experimentales en las cuales las eficacias de transducción correspondientes a cada vector en cada línea fueron similares. En cada histograma se muestra el porcentaje de células positivas para EGFP así como la intensidad media de fluorescencia (IMF) en las líneas celulares hematopoyéticas transducidas con los vectores CMV-EGFP-LV y vavHS1-EGFP-LV.
Figura 3
La presente figura muestra la actividad de los promotores CMV y vavHS1 en siete líneas celulares hematopoyéticas: CEM (linfocitos T humanos), B (linfoblastos B humanos), HL60 (células mieloides humanas), WEHI (células mieloides de ratón), HEL (células eritroides humanas), MEL (células eritroides de ratón) y FDCP1 (células hematopoyéticas primitivas de ratón). Se representan los resultados transcurridos 3-50 días desde la transducción de cada línea celular con dos vectores que contenían los promotores CMV y vavHS1. Para la infección de cada línea se utilizaron multiplicidades de infección (MOI) similares. La MOI representa el número de partículas virales infectivas con respecto al número de células a infectar. Se calcula dividiendo el número de partículas virales (ml añadidos x unidades infectivas (u.i.)/ml) entre el número de células a infectar. A mayor valor de MOI es esperable un mayor número de copias del provirus integrado por célula. Según estudios publicadosunderline{20}, la relación entre el porcentaje de células que expresan el transgén y el número de copias del provirus integradas, sigue una distribución de Poisson. En A) se muestran los porcentajes de células positivas para EGFP, y en B) se representa la intensidad media de fluorescencia (IMF) en las líneas celulares hematopoyéticas transducidas con los vectores CMV-EGFP-LV (barras negras) y vavHS1-EGFP-LV (barras blancas).
Figura 4
La Figura muestra la intensidad de expresión del transgén EGFP (medido por la IMF) en dos líneas hematopoyéticas mieloides humanas, HL60 y K562 y dos líneas no hematopoyéticas 293T (epitelial humano) y 3T3 (fibroblasto de ratón), transducidas con vectores lentivirales que contienen cuatro promotores diferentes: promotor CMV (barras negras), promotor vavHS1 (barras blancas), promotor fosfoglicerato quinasa (PGK; barras punteadas), y promotor del virus "spleen focus forming virus" (SFFV; barras rayadas). En todos los casos el nivel de expresión del transgén fue más modesta en células transducidas con el vector vavHS1-EGFP-LV.
Figura 5
La presente figura muestra la actividad del promotor vavHS1 en células de médula ósea de ratón en cultivo: Se puede observar la expresión estable de EGFP tras la transducción de células progenitoras que no expresan marcadores de diferenciación (Lin-), con el vector lentiviral vavHS1-EGFP-LV a dos MOI diferentes: 2 (puntos grises) y 0,2 (puntos blancos), y cultivadas...
Reivindicaciones:
1. Un vector integrativo caracterizado por que comprende el promotor HS1 del oncogén vav que consiste en el promotor de SEQ ID NO:1.
2. Vector integrativo según la reivindicación 1, caracterizado por ser un Gamma- retrovirus.
3. Vector integrativo según la reivindicación 1, caracterizado por ser un Lentivirus.
4. Vector integrativo según la reivindicación 1, caracterizado por ser un Foamy virus (Espumavirus).
5. Vector integrativo según la reivindicación 1, caracterizado por ser un virus Adeno-asociado.
6. Células transducidas por los vectores de las reivindicaciones 1 a 5 que expresan un gen bajo el control del promotor HS1 del oncogén vav que consiste en el promotor de SEQ ID NO:1.
7. Uso de los vectores de las reivindicaciones 1 a 5 para la elaboración de composiciones farmacéuticas destinadas a ser utilizadas en terapia génica somática.
8. Uso de las células de la reivindicación 6 para la elaboración de composiciones farmacéuticas destinadas a ser utilizadas en terapia génica somática.
9. Composiciones farmacéuticas que comprenden vectores de las reivindicaciones 1 a 5 y vehículos farmacéuticamente aceptables.
10. Composiciones farmacéuticas que comprenden células de la reivindicación 6 y vehículos farmacéuticamente aceptables.
Patentes similares o relacionadas:
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Terapia génica para la diabetes, del 8 de Julio de 2020, de UCL Business Ltd: Una molécula de ácido nucleico que comprende una secuencia de nucleótidos que codifica una proteína preproinsulina funcional en donde la secuencia de nucleótidos tiene al menos […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Ácido nucleico antisentido, del 24 de Junio de 2020, de NIPPON SHINYAKU CO., LTD.: Un oligómero antisentido de 14 a 32 bases de longitud, que comprende dos unidades de oligómeros conectadas seleccionadas del grupo que consiste […]
Plekhg5 como diana farmacéutica para trastornos neurológicos, del 15 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Plekhg5 como diana farmacéutica para trastornos neurológicos. La invención hace referencia al uso del gen Plekhg5 como diana farmacológica para el cribado, […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Método para activar células T auxiliares, del 10 de Junio de 2020, de OTSUKA PHARMACEUTICAL CO., LTD.: Una composición para su uso en el tratamiento o prevención del cáncer mediante la activación de células T auxiliares en un sujeto, en donde dicha composición […]