UNIDADES POSOLOGICAS EN FORMA DE MULTIPLES PARTICULAS DE LIBERACION SOSTENIDA EN EL TIEMPO DE PROPANOLOL.
Una unidad posológica farmacéutica que contiene partículas de liberación temporal sostenida (TSR),
cuyas partículas TSR se caracterizan por:
a. una partícula base que contiene propranolol o una sal derivada farmacéuticamente correcta;
b. una primera membrana con recubrimiento de etilcelulosa de dicha base para lograr una liberación controlada; y
c. una segunda membrana externa con una mezcla de etilcelulosa y un polímero entérico, ofreciendo dicha segunda membrana una demora antes de la liberación del fármaco;
d. donde las partículas TSR, en una prueba con un aparato USP tipo II a 50 rpm usando un medio de disolución en dos etapas (primeras dos horas en 700 ml 0,1 IN HCl a 37ºC seguidas por la disolución en un pH de 6,8 obtenidos por la adición de 200 ml de modificante de pH), exhiben un perfil de disolución correspondiente al siguiente patrón: después de 2 horas, el 0-10% del propranolol total se libera; después de 4 horas, el 5-15% del propranolol total se libera; después de 6 horas, el 20-45% del propranolol total se libera; después de 10 horas, el 55-70% del propranolol total se libera; después de 16 horas, no menos del 70% del propranolol total se libera
Tipo: Resumen de patente/invención. Número de Solicitud: W0231535US.
Solicitante: EURAND, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 845 CENTER DRIVE,VANDALIA, OH 45377.
Inventor/es: VISHNUPAD, KRISHNA S., VENKATESH, GOPI M., PERCEL,PHILLIP,J.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- A61K31/138 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Ariloxialquilaminas, p. ej. propranolol, tamoxifeno, fenoxibenzamina (atenolol A61K 31/165; pindolol A61K 31/404; timolol A61K 31/5377).
- A61K9/50K2
- A61K9/50M
Clasificación PCT:
- A61K31/138 A61K 31/00 […] › Ariloxialquilaminas, p. ej. propranolol, tamoxifeno, fenoxibenzamina (atenolol A61K 31/165; pindolol A61K 31/404; timolol A61K 31/5377).
- A61K9/62 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › que contienen hidratos de carbono o sus derivados (A61K 9/60 tiene prioridad).
Clasificación antigua:
- A61K31/138 A61K 31/00 […] › Ariloxialquilaminas, p. ej. propranolol, tamoxifeno, fenoxibenzamina (atenolol A61K 31/165; pindolol A61K 31/404; timolol A61K 31/5377).
- A61K9/62 A61K 9/00 […] › que contienen hidratos de carbono o sus derivados (A61K 9/60 tiene prioridad).
Fragmento de la descripción:
Unidades posológicas en forma de múltiples partículas de liberación sostenida en el tiempo de propanolol.
Campo técnico
Un objetivo importante de la cronoterapia para las enfermedades cardiovasculares es administrar el fármaco en concentraciones más altas durante el periodo de mayor necesidad, típicamente durante las primeras horas del día, y en concentraciones más bajas cuando la necesidad es menor, por ejemplo a última hora de la tarde y durante las primeras horas de sueño. Esto se puede lograr con la administración de la posología de la presente invención, relacionada con una absorción controlada del propranolol a través de unidades posológicas. Particularmente, la presente invención se relaciona con una unidad posológica de uno o varios conjuntos de comprimidos, cada uno de los cuales está diseñado para liberar uno o más agentes terapéuticos como administración sostenida o rápida tras un periodo de tiempo predeterminado (administración del fármaco "controlada por tiempo" en vez de "controlada por cantidad") con concentraciones de propranolol en plasma resultantes que varían a un ritmo circadiano después de la administración de una única dosificación a la hora de acostarse, reduciendo así al mínimo los riesgos potenciales de sufrir un ataque o crisis cardíaca y aumentando la conformidad del paciente y la eficacia terapéutica, a la vez que se reducen los costes del tratamiento.
Antecedentes de la invención
Muchos agentes terapéuticos son más eficaces cuando se administran de forma constante en el lugar de absorción o cerca de él. La absorción de agentes terapéuticos administrados de esta manera da como resultado generalmente las concentraciones en plasma deseadas que conllevan una máxima eficacia y unos mínimos efectos secundarios tóxicos. Se ha dedicado mucho esfuerzo a desarrollar sofisticados sistemas de administración de fármacos, como dispositivos osmóticos, para administración oral. Sin embargo, hay casos en que no es deseable mantener un nivel constante de fármaco en sangre. Por ejemplo, un sistema de administración de fármacos "controlado por posición" (p.ej., tratamiento de enfermedades del colón o el uso del colon como lugar de absorción para productos a base de proteínas o péptidos) puede demostrar ser más eficaz. Un sistema de administración pulsátil es capaz de proporcionar uno o más pulsos de liberación inmediata en puntos temporales predeterminados después de un periodo de retraso controlado o en lugares específicos. Sin embargo, solamente existen unos cuantos sistemas pulsátiles de liberación oral de este tipo debido a la limitación potencial del tamaño o de los materiales usados para las formas de dosificación. Ishino et al. divulgan un comprimido recubierto en seco en Chemical Pharm. Bull. Vol. 40 (11), 3036-041 (1992). La patente de los EE.UU. Nº 4.851.229 publicada a Magruder et al., la patente de los EE.UU. Nº 5.011.692 publicada a Fujioka et al., la patente de los EE.UU. Nº 5.017.381 publicada a Maruyama et al., la patente de los EE.UU. Nº 5.229.135 publicada a Philippon et al. y la patente de los EE.UU. Nº 5.840.329 publicada a Bai divulgan la preparación de sistemas de administración pulsátil. Otros dispositivos se divulgan en la patente de los EE.UU. Nº 4.871.549 publicada a Ueda et al. y las patentes de los EE.UU. Nº 5.260.068, 5.260.069 y 5.508.040 publicadas a Chen. Las patentes de los EE.UU. Nº 5.229.135 y 5.567.441, ambas publicadas a Chen, divulgan un sistema de administración pulsátil de píldoras recubiertas con membranas poliméricas de disolución retardada o insolubles en agua que incorporan agentes hidrofóbicos insolubles en agua o polímeros entéricos para alterar la permeabilidad de la membrana. La Patente de los EE.UU. Nº 5.837.284 publicada a Mehta et al. divulga una unidad posológica que proporciona una dosis de liberación inmediata de metilfenidato en el momento de la administración oral, seguida por una o más dosis adicionales separadas por varias horas.
La incidencia de muchas enfermedades cardiovasculares varía en tiempo de forma predecible en 24 horas, es decir, a ritmo circadiano (véase, p. ej., Y.A. Anwar y W.B. White, Chronotherapeutics for Cardiovascular Disease, Drugs 1998, 55, pp 631 -643). Por ejemplo, se ha informado de un rápido aumento en el infarto agudo de miocardio y la presión arterial sistólica en estudios bien controlados en pacientes reales. En tales casos, la administración de un tipo distinto de unidad de dosificación que administra el fármaco en concentraciones más altas durante el periodo de mayor necesidad, típicamente durante las primeras horas del día, y en concentraciones más bajas cuando la necesidad es menor, por ejemplo a última hora de la tarde y durante las primeras horas de sueño. La solicitud de los E.E.U.U. cedida comúnmente y pendiente con número de serie 09/778.645, presentada el 7 de febrero de 2001, divulga un sistema de administración pulsátil que incluye una combinación de dos o tres pastillas, cada una con un perfil de administración bien definido. De acuerdo con la presente invención, se obtiene un perfil del plasma que varía a ritmo circadiano después de la administración de la nueva unidad posológica.
El propranolol [1-(isopropilamino)-3-(1-naftiloxi)-2-propanol] es un agente de bloqueo beta adrenérgico y como tal es un potente inhibidor de los efectos de las catecolaminas en los lugares receptores de beta adrenérgicos. El efecto principal del propranolol es reducir la actividad cardiaca disminuyendo o evitando la estimulación beta adrenérgica. Reduciendo la velocidad y la fuerza de contracción del corazón y disminuyendo el índice de conducción de impulsos a través del sistema conductor, se reduce la respuesta del corazón al estrés y al ejercicio. Estas propiedades se utilizan en el tratamiento de la angina en un esfuerzo por reducir el consumo del oxígeno y aumentar la tolerancia del corazón al ejercicio. El propranolol también se utiliza en el tratamiento de arritmias cardiacas para bloquear la estimulación adrenérgica de los potenciales marcapasos. El propranolol también es beneficioso en el tratamiento a largo plazo de la hipertensión. También se usa propranolol en el tratamiento de la migraña y la ansiedad. El propranolol se administra normalmente como comprimidos de propranolol clorhidrato.
EP0391518 divulga una preparación farmacéutica de liberación sostenida que incluye micropartículas, en la que cada micropartícula está compuesta de un fármaco base, un recubrimiento entérico interno y un recubrimiento de control externo, como un copolímero o una etilcelulosa de éster ácido polimetacrílico.
US4780318 divulga una unidad posológica farmacéutica compuesta por una base terapéutico-activa recubierta con una capa interna de etilcelulosa o un copolímero recubierto por una segunda capa de un polímero aniónico y/o de un ácido graso.
US4138475 divulga una composición farmacéutica de liberación sostenida en la cual las micropartículas van dentro de una cápsula de gelatina; las micropartículas se componen de una base del propranolol recubierta con etilcelulosa, opcionalmente combinada con hidroxipropilmetilcelulosa y/o un plastificante.
Resumen de la invención
La presente invención proporciona una unidad posológica de multipartículas de liberación sostenida y temporal de acuerdo con las reivindicaciones anexas, consistente en una base de propranolol con una primera membrana de un polímero de liberación sostenida y una segunda membrana de una mezcla de polímero insoluble en agua y de polímero entérico (2ª capa o capa externa), donde el polímero insoluble en agua y el polímero entérico pueden estar presentes en una proporción de peso de 10:1 a 1:2, y el peso total de las capas representa entre el 10 y el 60% por peso del peso total de las comprimidos recubiertos. En algunos casos, dependiendo del tipo de perfil de administración del fármaco necesario, puede incluirse un componente de liberación inmediata para proporcionar una unidad posológica de administración sostenida, temporal y modificada. Cuando se administra a la hora de acostarse, la unidad posológica compuesta por uno o más grupos de comprimidos libera el fármaco en concentraciones más bajas cuando la necesidad es menor, por ejemplo a última hora de la tarde y durante las primeras horas de sueño, y en concentraciones más altas durante el periodo de mayor necesidad, típicamente durante las primeras horas del día.
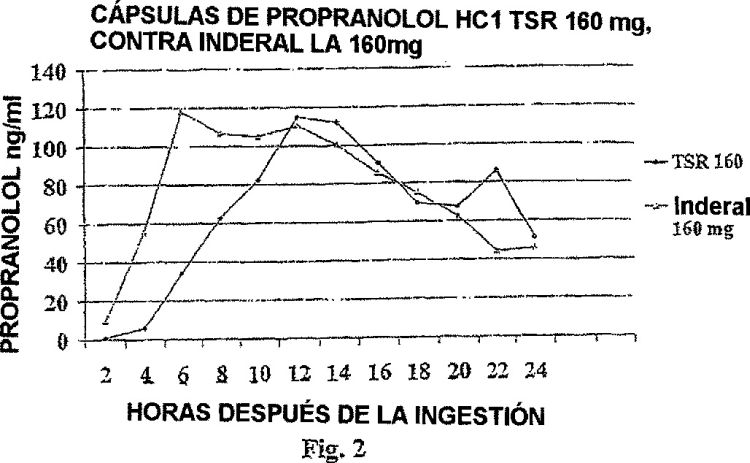
Breve descripción de las figuras
La invención será descrita en detalle haciendo referencia a las figuras que se acompañan, en donde:
Reivindicaciones:
1. Una unidad posológica farmacéutica que contiene partículas de liberación temporal sostenida (TSR), cuyas partículas TSR se caracterizan por:
a. una partícula base que contiene propranolol o una sal derivada farmacéuticamente correcta;
b. una primera membrana con recubrimiento de etilcelulosa de dicha base para lograr una liberación controlada; y
c. una segunda membrana externa con una mezcla de etilcelulosa y un polímero entérico, ofreciendo dicha segunda membrana una demora antes de la liberación del fármaco;
d. donde las partículas TSR, en una prueba con un aparato USP tipo II a 50 rpm usando un medio de disolución en dos etapas (primeras dos horas en 700 ml 0,1 IN HCl a 37ºC seguidas por la disolución en un pH de 6,8 obtenidos por la adición de 200 ml de modificante de pH), exhiben un perfil de disolución correspondiente al siguiente patrón:
2. Una unidad posológica farmacéutica según lo definido en la reivindicación 1, donde el perfil de disolución corresponde sustancialmente al siguiente patrón:
3. Una unidad posológica farmacéutica según lo definido en la reivindicación 1, donde la partícula base es un gránulo único de azúcar recubierto con propranolol en un aglutinante polimérico o la partícula base es una partícula preparada por granulación y molido o extrusión/esferificación para formar una partícula base que contiene propranolol.
4. Una unidad posológica farmacéutica según lo definido en la reivindicación 1, donde dicho polímero entérico se selecciona de un grupo que consiste en ésteres de celulosa, ftalato de acetato de polivinilo, copolímeros metacrílicos de ácido-metilmetacrilato sensibles al pH, goma laca y sus derivados.
5. Una unidad posológica farmacéutica según lo definido en la reivindicación 4, donde dicho polímero entérico se selecciona de un grupo compuesto por ftalato del acetato de celulosa, ftalato hidroxipropil de metilcelulosa, succcinato hidroxipropil de metilcelulosa y combinaciones de los anteriores.
6. Una unidad posológica farmacéutica según lo definido en la reivindicación 1, donde por lo menos una de las dichas membranas primera y segunda además incluye un plastificante.
7. Una unidad posológica farmacéutica según lo definido en la reivindicación 6, donde dicho plastificante se selecciona de un grupo que consistente en triacetina, citrato de tributilo, citrato trietil, citrato tri-nbutyl de acetilo, ftalato dietílico, sebacate dibutil, glicol de polietileno, glicol de polipropileno, aceite de ricino y mono y diglicérido acetilizado, y mezclas de los anteriores.
8. Una unidad posológica farmacéutica según lo definido en la reivindicación 1, donde dicha etilcelulosa y dichos polímeros entéricos están presentes en la membrana externa mencionada con una proporción de 10:1 a 1:2.
9. Una unidad posológica farmacéutica según lo definido en la reivindicación 8, donde la proporción referida de etilcelulosa y polímero entérico es de 2:1 a 1:1.
10. Una unidad posológica farmacéutica según lo definido en la reivindicación 9, donde dicho polímero entérico es ftalato de metilcelulosa hidroxipropil.
11. Una unidad posológica farmacéutica según lo definido en la reivindicación 10, donde la proporción referida es de aproximadamente 1:1.
12. Una unidad posológica farmacéutica según lo definido en la reivindicación 1, donde la unidad posológica referida además incluye gránulos de liberación inmediata (IR), y esos gránulos IR contienen una partícula base que incluye propranolol.
13. Una unidad posológica farmacéutica según lo definido en la reivindicación 12, donde los referidos gránulos IR proporcionan una dosis de ataque liberando prácticamente todo el propranolol contenido en dicho gránulo IR dentro de la primera hora después de la administración de la unidad posológica.
14. Una unidad posológica farmacéutica según lo definido en la reivindicación 1, donde el peso total del recubrimiento de las membranas referidas es del 10-60% del peso total de los gránulos TSR referidos.
15. Una unidad posológica farmacéutica según lo definido en la reivindicación 14, donde la primera membrana referida representa cerca del 1,5-4% del peso total de las partículas TSR referidas y la dicha segunda membrana representa el 10-56% del peso total de los gránulos TSR referidos.
16. Una unidad posológica farmacéutica según lo definido en la reivindicación 1, donde dicha unidad posológica contiene un total de 80-160 mg de propranolol o de sal farmacéuticamente aceptada derivada del anterior.
17. Un método para la preparación de la unidad posológica de la reivindicación 1, que incluye los siguientes pasos:
a. preparación de una base que contiene propranolol;
b. recubrimiento de dicha base con una etilcelulosa plastificada para formar una membrana de etilcelulosa alrededor de dicha base;
c. recubrimiento de dicha base recubierta de etilcelulosa con una mezcla de etilcelulosa plastificada y de un polímero entérico para formar una partícula de fármaco de liberación temporal sostenida (TSR) recubierta; y
d. relleno de cápsulas con dichos gránulos TSR.
18. El método de la reivindicación 17, donde la referida base que contiene propranolol se obtiene recubriendo una partícula seleccionada del grupo consistente en gránulos únicos, cristales de tampón ácido y alcalino con una composición filmógena soluble en agua que incluye propranolol y un aglutinador polimérico.
19. El método de la reivindicación 17, donde la referida base que contiene propranolol se obtiene mediante granulado y molido y/o por extrusión/esferificación de una composición de polímero que contiene propranolol.
20. La unidad posológica de la reivindicación 1 para su uso en un método para proveer un paciente de una administración temporal sostenida de propranolol, que incluye la administración al paciente de dicha unidad posológica.
21. La unidad posológica según la reivindicación 20, donde dicha unidad posológica se administra oralmente.
22. La unidad posológica de la reivindicación 21, donde dicha unidad posológica se administra al última hora de la tarde.
23. La unidad posológica según la reivindicación 21, donde dicha unidad posológica proporciona una cantidad terapéuticamente eficaz de propranolol en las primeras horas del día y posteriormente ofrece una liberación sostenida de cantidades terapéuticas de propranolol.
24. La unidad posológica según la reivindicación 20, donde dicha unidad posológica proporciona un Tmax aproximadamente a las 12 horas después de la administración de dicha unidad posológica.
Patentes similares o relacionadas:
Régimen de dosificación para un agonista del receptor S1P, del 3 de Junio de 2020, de NOVARTIS AG: Uso de un modulador o agonista del receptor S1P en la fabricación de un medicamento para el tratamiento de una enfermedad autoinmune, mediante […]
Métodos para el tratamiento de la retinopatía diabética proliferativa, del 22 de Abril de 2020, de Acucela, Inc: Un compuesto para su uso en el tratamiento de la retinopatía diabética proliferativa en un paciente que lo necesita, en donde el compuesto tiene la estructura […]
Composiciones farmacéuticas transdérmicas que comprenden un SERM, del 4 de Marzo de 2020, de Besins Healthcare Luxembourg SARL: Composición farmacéutica transdérmica para administración transdérmica a una superficie cutánea, donde dicha composición comprende: (i) 0,01 a 10 % (p/p), preferiblemente […]
Activación de procaspasa 3 mediante terapia de combinación, del 19 de Febrero de 2020, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ILLINOIS: Una composición que comprende: (a) un compuesto PAC-1: **(Ver fórmula)** (b) un segundo agente activo, en donde el segundo agente activo es bortezomib, […]
Alcoxifenilpropilaminas para el tratamiento de la degeneración macular relacionada con la edad, del 8 de Enero de 2020, de Acucela, Inc: Un compuesto para su uso en el tratamiento de la enfermedad de Stargardt, en donde dicho compuesto se selecciona del grupo que consiste en: **(Ver fórmula)** […]
COMPUESTOS PARA EL TRATAMIENTO DE LA INFECCIÓN POR VIH Y OTRAS ENFERMEDADES CAUSADAS POR VIRUS ARN, del 2 de Enero de 2020, de Universidad Católica de Valencia "San Vicente Mártir": La presente invención está dirigida al uso de compuestos orgánicos para el tratamiento de la infección causada por el virus de la inmunodeficiencia humana tipo (VIH-1) así como […]
Compuestos para el tratamiento de la infección por VIH y otras enfermedades causadas por virus ARN, del 27 de Diciembre de 2019, de Universidad Católica de Valencia "San Vicente Mártir": Compuestos para el tratamiento de la infección por VIH y otras enfermedades causadas por virus ARN. La presente invención está dirigida al uso de compuestos orgánicos para […]
Furoato de fluticasona en el tratamiento de la EPOC, del 18 de Diciembre de 2019, de GlaxoSmithKline Intellectual Property Development Limited: Un producto farmacéutico que comprende furoato de fluticasona para su uso en el tratamiento de la EPOC en un paciente, en el que el paciente tiene un recuento […]