SUSPENSIONES LIQUIDAS FARMACEUTICAS.
Una composición farmacéutica que comprende un ingrediente activo transportado por partículas de cristal de azúcar que tienen un diámetro en el intervalo de 0,
1 a 100 micrómetros, estando estas partículas suspendidas en un líquido de perfluorocarbono biocompatible, que se caracteriza porque las densidades de las partículas y el líquido biocompatible coinciden de modo que las partículas permanecen en una suspensión estable.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E04013422.
Solicitante: CAMBRIDGE BIOSTABILITY LTD.
Fecha de Publicación: .
Fecha Solicitud PCT: 13 de Octubre de 2000.
Fecha Concesión Europea: 2 de Diciembre de 2009.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia, Chipre.
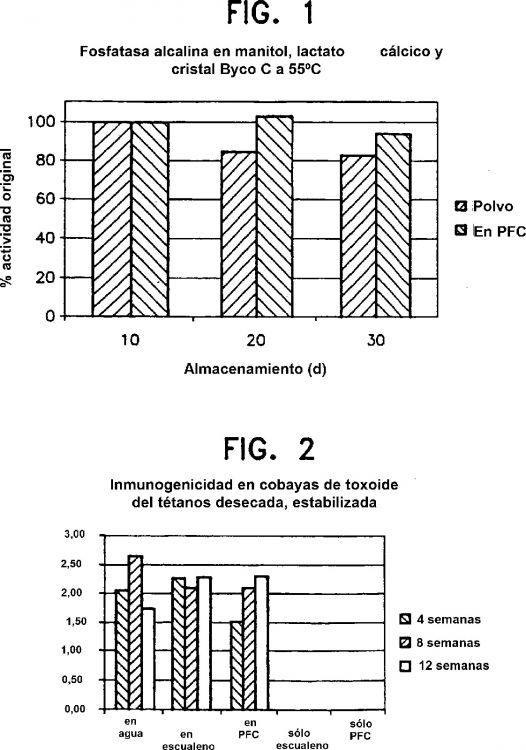
Fragmento de la descripción:
Suspensiones líquidas farmacéuticas.
Las vacunas o fármacos en solución listas para inyectar son inherentemente inestables y necesitan refrigeración. Tradicionalmente, la industria farmacéutica ha abordado el problema de la inestabilidad mediante liofilización de los fármacos. Esto es caro, inconveniente e inherentemente peligroso, dado que la incorrecta reconstitución de fármacos secos puede tener como resultado dosis equivocadas o soluciones contaminadas. Durante los últimos 100 años se han realizado muchos intentos de desarrollar formulaciones líquidas robustas, estables y listas para inyectar con una penosa falta de éxito. Sólo los fármacos de moléculas pequeñas inherentemente resistentes pueden sobrevivir en soluciones acuosas con una duración de almacenaje útil.
Este problema es particularmente agudo en la industria de las vacunas. En el año 2005 se ha estimado que tendrán que administrarse 3,6 billones de dosis de vacunas en todo el mundo. La Organización Mundial de la Salud (OMS) ha indicado que esto no será posible usando los formatos estándar de vacunas que necesitan estar refrigeradas en todo momento ("Revolutionizing Immunizations". Jodar L., Aguado T., Lloyd J. and Lambert P-H. Genetic Engineering News Feb 15 1998). Actualmente se está usando una "cadena fría" de refrigeradores que se extiende desde la fábricas de vacunas a las ciudades provinciales del mundo en desarrollo. El coste de la cadena fría para la industria de las vacunas y para las organizaciones de salud no gubernamentales que dirigen campañas de inmunización es enorme. La OMS ha estimado que sólo los costes de mantenimiento de la cadena fría son de más de 200 millones de dólares americanos anualmente. Además, las campañas de inmunización sólo pueden alcanzar a los que viven cerca del último vínculo de la cadena fría.
Las campañas de vacunación requieren personal médicamente formado para garantizar que la dosis se inyecta correctamente y no muestra signos de degradación. La necesidad de reconstituir algunas vacunas, como las del sarampión, la fiebre amarilla y la BCG, en el campo es también un problema grave. Esto puede realizarse de un modo preciso para garantizar la dosificación correcta y también introduce una potencial fuente de contaminación, que con frecuencia ha conducido a desastres clínicos. Además, a menudo es necesario administrar más de una vacuna en una sesión y esto puede requerir múltiples inyecciones, dado que es posible que mezclas concretas o vacunas "multivalentes" no estén disponibles debido a la incompatibilidad química de algunos de los componentes. La OMS ha enfocado estos problemas mediante la estimulación activa de la investigación de la siguiente generación de vacunas estables que no tienen necesidad de refrigeración y que no necesitan refrigeración ("Pre-Filled Monodose Injection Devices: A safety standard for new vaccines, or a revolution in the delivery of immunizations?" Lloyd J. and Aguado M.T. WHO publication May 1998. "General policy issues: injectable solid vaccines: a role in future immunization?" Aguado M T, Jodar L, Lloyd J, Lambert P.H. WHO publication No A59781.).
Una solución ideal para este problema sería formulaciones listas para inyectar y completamente estables. Dichas vacunas estables podrían concentrarse en forma de dosis individuales en un dispositivo de inyección o, para las campañas de inmunización en masa, enviarse en volúmenes más granes y administrarse por medio de un inyector en chorro sin aguja. Se ha descrito la administración transdérmica de sólidos secos mediante inyección en chorro de gas (Sarphie DF, Burkoth TL. Method for providing dense particle compositions for use in transdermal particle delivery. Nº de pub. PCT WO 9748485 (1996)) y la vacunación trasndémrica con vacunas secas de ADN es, aparentemente, muy eficaz ("PowderJect's Hepatitis B DNA Vaccine First to Successfully Elicit Protective Immune Response In-Humans" en http://www.powderject.com/pressreleases.htm (1998)).
La onda de choque hipersónica de gas helio que se usa para dirigir estos inyectores de polvo tiene un poder limitado y no puede administrar su dosis de partículas finas intramuscularmente. Esto es porque las partículas de masa baja no pueden alcanzar un momento adecuado para la penetración profunda. Aunque la administración intradérmica de vacunas de ADN recubiertas en partículas de oro coloidal es adecuada para una buena inmunogenicidad, las vacunas habituales, adyuvadas con sales insolubles, de calcio o de aluminio, inducen una irritación cutánea inaceptable. Puede administrarse por vía intramuscular. Lo que se requiere es un sistema flexible capaz de una serie de profundidades de administración, desde intradérmica a profunda intramuscular, de un modo similar al que se puede conseguir con la tecnología existente de la aguja y la jeringuilla. Para las campañas de vacunación en masa, esto se ha resuelto con el desarrollo del inyector de chorro líquido capaz de acelerar una estrecha (diámetro de aproximadamente 0,15 mm) corriente de líquido, usando presiones de alrededor de 20.384,27 kPa, en una "uña líquida". Este dispositivo administra su dosis de un modo indoloro a través de la piel en el profundo tejido subcutáneo o muscular mediante la perforación de un diminuto orificio a través de la epidermis. El elevado momento impartido a la corriente de líquido garantiza una profunda penetración. Hasta la fecha, los fármacos y vacunas inyectados están basados en agua, pero debido a los problemas de inestabilidad tratados anteriormente, la gama de productos acuosos estables accesibles a esta tecnología es muy limitada.
Actualmente, se ha reconocido que una amplia gama de moléculas bioactivas puede estabilizarse secando en cristales, particularmente cristales de azúcar (Roser B. "Protection of proteins and the like" 5 UK patente del Reino Unido Nº 2.187.191. Roser B y Colaco C. "Stabilization of biological macro-molecular substances and other organic compounds" Nº Pub. PCT WO 91/18091. Roser B. y Sen S. "New stabilizing glasses". Solicitud de patente PCT Nº: 9805699.7. 1998). Estas sustancias activas secas y estabilizadas no se ven afectadas por ambientes hostiles tales como temperaturas elevadas y radiación ionizante.
El mecanismo subyacente a la considerable estabilización de las moléculas con azúcares es la transformación en cristal. Dado que la solución de azúcar que contiene una molécula activa se seca, puede cristalizar cuando se alcanza el límite de solubilidad del azúcar o puede convertirse en jarabe supersaturado. La capacidad del azúcar para aguantar la cristalización es una propiedad crucial de un buen estabilizante. La trehalosa es buena para esto (Green JL. & Angel CA. Phase relations and vitrification in saccharide water solution and the trehalose anomaly J. Phys. Chem. 93 2880-2882 (1989)) pero no única. La desecación adicional solidifica progresivamente el jarabe que, a su vez, se convierte en un cristal a un bajo contenido de agua residual. De forma imperceptible, las moléculas activas cambian de solución líquida en el agua a solución sólida en el cristal de azúcar seco. La difusión química es insignificante en un cristal y, por tanto, las reacciones químicas cesan prácticamente. Dado que la desnaturalización es un cambio químico, no se puede producir en el cristal t las moléculas se estabilizan. De este modo, las moléculas pueden permanecer invariables con la condición de que se cumpla otra condición. Esta es la segunda propiedad crucial de un buen estabilizante VIZ que es químicamente inerte y no reactivo. Muchos cristales no pasan porque reaccionan con el producto durante el almacenamiento. Con los azúcares reductores se producen problemas obvios, que pueden formar buenos cristales físicos pero, después, sus grupos aldehído atacan a los grupos amino sobre los productos en una reacción típica de Maillard. Esta es la razón principal por la que muchos productos farmacéuticos liofilizados requieren almacenamiento en refrigeración. Los azúcares no reactivos proporcionan productos estables, que no requieren ninguna refrigeración.
Las biomoléculas inmovilizadas en cristal de azúcar son también estables en disolventes industriales no acuosos en los que ellos mismos y el azúcar son insolubles (Cleland JL. and Jones AJS. "Excipient stabilization of polypeptides treated with organic solvents" US Patent No. 5, 589,167. (1994)). Dado que el cristal de azúcar actúa como una barrera impermeable en un líquido no disolvente, las biomoléculas en solución sólida en el cristal están protegidas tanto de la reactividad química del disolvente como del ambiente. Siempre que el propio...
Reivindicaciones:
1. Una composición farmacéutica que comprende un ingrediente activo transportado por partículas de cristal de azúcar que tienen un diámetro en el intervalo de 0,1 a 100 micrómetros, estando estas partículas suspendidas en un líquido de perfluorocarbono biocompatible, que se caracteriza porque las densidades de las partículas y el líquido biocompatible coinciden de modo que las partículas permanecen en una suspensión estable.
2. Una composición de acuerdo con la reivindicación 1, que se caracteriza porque las partículas contienen una sal inorgánica como agente regulador de la densidad.
3. Una composición de acuerdo con la reivindicación 2, que se caracteriza porque la sal inorgánica es fosfato cálcico.
4. Una composición de acuerdo con cualquiera de las reivindicaciones precedentes, que se caracteriza porque las partículas contienen lactato cálcico.