PROCEDIMIENTOS Y ENSAYOS PARA DISTINGUIR ENTRE DIFERENTES FORMAS DE ENFERMEDADES Y TRASTORNOS CARACTERIZADOS POR LA TROMBOCITOPENIA Y/O POR LA INTERACCION ESPONTANEA ENTRE EL FACTOR DE VON WILLEBRAND (vWF) Y LAS PLAQUETAS.
- Un procedimiento para distinguir entre diferentes estados o formas de enfermedades y trastornos que se caracterizan por la trombocitopenia y/o por la interacción espontánea entre el factor de Von Willebrand (vWF) y las plaquetas,
y/o para predecir el avance de dicha enfermedad o trastorno, comprendiendo dicho procedimiento las etapas de: a) proporcionar al menos una muestra biológica que contenga vWF obtenida a partir de un paciente que padece, o que se sospecha que padece, al menos una enfermedad o un trastorno caracterizado por la trombocitopenia y/o por la interacción espontánea entre el vWF y las plaquetas; b) determinar la cantidad de vWF que está en una conformación de unión a Gplb en dicha muestra biológica; y c) comparar la cantidad obtenida de vWF que está en una conformación de unión a Gplb con un valor de referencia obtenido a partir de un paciente o de un grupo de pacientes con o sin un estado o forma diferente de dicha enfermedad o trastornos; y d) en el que la cantidad de vWF que está en una conformación de unión a Gplb se determina poniendo en contacto la muestra biológica con un agente de unión que es capaz de unirse de modo selectivo al vWF que está en una conformación de unión a Gplb en presencia de vWF que está en una conformación de no unión a Gplb, y después determinando la cantidad de vWF que está en una conformación de unión a Gplb unido al agente de unión. en el que el agente de unión tiene un sitio de unión diferenciado del sitio de unión de Gplbα, y en el que el agente de unión es un anticuerpo; una parte o un fragmento de un anticuerpo; o una proteína o un polipéptido que contiene una o más partes o fragmentos de un anticuerpo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/000273.
Solicitante: ABLYNX N.V.
UMC UTRECHT HOLDING B.V.
Nacionalidad solicitante: Bélgica.
Dirección: TECHNOLOGIEPARK 4 9052 ZWIJNAARDE BELGICA.
Inventor/es: SILENCE,KAREN, DE GROOT,PHILIP,G, LENTING,PETER,J, FIJNHEER,ROB.
Fecha de Publicación: .
Fecha Solicitud PCT: 13 de Enero de 2006.
Fecha Concesión Europea: 7 de Julio de 2010.
Clasificación Internacional de Patentes:
- G01N33/68V
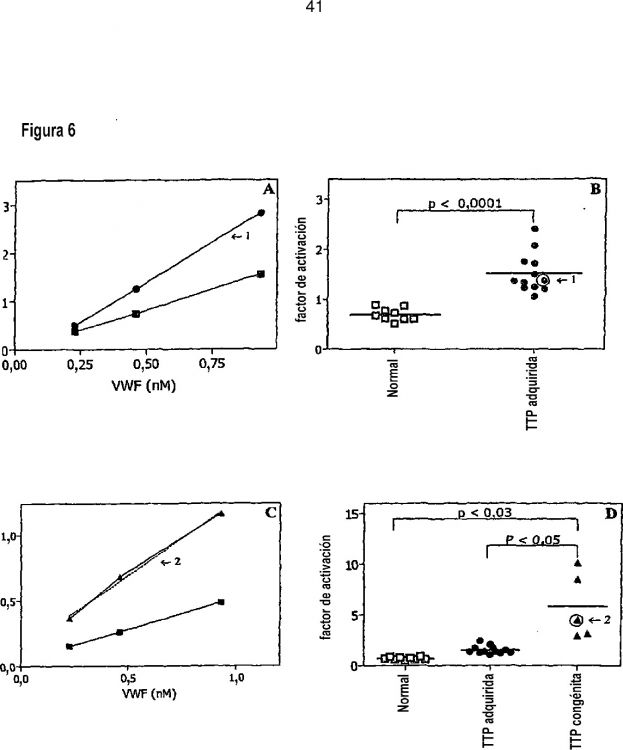
- G01N33/86 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que interviene el tiempo de coagulación de la sangre.
Clasificación PCT:
Fragmento de la descripción:
La presente invención se refiere a procedimientos para distinguir entre diferentes estados
En particular, la presente invención se refiere a procedimientos para proporcionar parámetros que pueden utilizarse para distinguir entre diferentes estados o formas de enfermedades y trastornos caracterizados por la trombocitopenia y/o por la interacción espontánea entre el factor de Von Willebrand (vWF) y las plaquetas; para seguir el avance de dicha enfermedad o trastorno; para realizar predicciones acerca del avance de dicha enfermedad Otros aspectos, realizaciones, usos, aplicaciones y ventajas de la invención serán evidentes a partir de la descripción que aparece a continuación. La invención se basa en el sorprendente descubrimiento de que los niveles de vWF activado en una muestra biológica obtenida a partir de un paciente que padece o que se sospecha que padece al menos una enfermedad o un trastorno caracterizado por la trombocitopenia y/o por la interacción espontánea entre el factor de Von Willebrand (vWF) y las plaquetas pueden utilizarse para distinguir entre diferentes estados o formas de enfermedades y trastornos caracterizados por la trombocitopenia y/o por la interacción espontánea entre el factor de Von Willebrand (vWF) y las plaquetas; para seguir el avance de dicha enfermedad o trastorno; para realizar predicciones acerca del avance de dicha enfermedad o trastorno; para determinar un tratamiento adecuado para dicha enfermedad o trastorno; para determinar la eficacia terapéutica de dicho tratamiento; y/o para modificar dicho tratamiento cuando sea aconsejable. Por tanto, en un primer aspecto la invención se refiere a un procedimiento para distinguir entre diferentes estados o formas de enfermedades y trastornos caracterizados por la trombocitopenia y/o por la interacción espontánea entre el factor de Von Willebrand (vWF) y las plaquetas, y/o para predecir el avance de dicha enfermedad o trastorno según se define en la reivindicación 1. La muestra biológica utilizada en el procedimiento de la invención es una muestra que contiene vWF, preferiblemente una muestra que contiene vWF y plaquetas. En particular, la muestra biológica puede elegirse entre sangre completa, plasma, suero u otras fracciones sanguíneas adecuadas. En el procedimiento de la invención, la cantidad (por ejemplo, la cantidad absoluta, el nivel y/o la concentración) de vWF activado en la muestra puede compararse con un valor de referencia para la cantidad de vWF activado, por ejemplo con un valor de referencia obtenido a partir de un paciente o de un grupo de pacientes sin la enfermedad o el trastorno; con un valor de referencia obtenido a partir de un paciente o de un grupo de pacientes con la enfermedad o el trastorno; con un valor de referencia obtenido a partir de un paciente o un grupo de pacientes con una forma diferente de la enfermedad o del trastorno. La cantidad de vWF activado en la muestra también puede compararse con la cantidad de vWF en una o más muestras diferentes obtenidas del mismo paciente (por ejemplo, obtenidas en un momento anterior y/o posterior). Se hace alusión a la sección experimental que aparece a continuación. La cantidad de vWF activado también puede compararse con otro parámetro adecuado de la muestra. Por ejemplo, la cantidad de vWF activado en la muestra también puede compararse con la cantidad de vWF no activado y/o con la cantidad total de vWF (activado y no activado) en la misma muestra. Además, una proporción adecuada de la cantidad de vWF activado y vWF no activado en la muestra (como el porcentaje de vWF activado en la muestra con relación a la cantidad total de vWF en la muestra) puede compararse con un valor de referencia, por ejemplo con un valor de referencia obtenido a partir de un paciente o de un grupo de pacientes sin la enfermedad o el trastorno y/o con un valor de referencia obtenido a partir de un paciente o de un grupo de pacientes con la enfermedad o el trastorno. Para este fin, la cantidad de vWF no activado y/o la cantidad total de vWF puede determinarse de una manera conocida per se. De nuevo se hace alusión a la sección experimental que aparece a continuación. Cuando la muestra empleada contiene vWF y plaquetas, la cantidad de vWF activado en la muestra también puede compararse con el número de plaquetas en la misma muestra. Además, una proporción adecuada de la cantidad de vWF activado en la muestra y el número de plaquetas en la muestra puede compararse con un valor de referencia, por ejemplo con un valor de referencia obtenido a partir de un paciente o de un grupo de pacientes sin la enfermedad o el trastorno y/o con un valor de referencia obtenido a partir de un paciente o de un grupo de pacientes con la enfermedad o el trastorno. Para este fin, el número de plaquetas de la muestra puede determinarse de una manera conocida per se. De nuevo se hace alusión a la sección experimental que aparece a continuación. El procedimiento según la invención puede utilizarse en particular para (proporcionar uno o más parámetros que puedan ser utilizados por el médico para) distinguir entre diferentes estados o formas, para seguir el avance, para realizar predicciones acerca del avance, para determinar un tratamiento o un régimen de tratamiento adecuados, para determinar la eficacia terapéutica de un tratamiento y/o para modificar dicho tratamiento cuando sea aconsejable, de las siguientes enfermedades y trastornos: púrpura trombocitopénica (TTP), síndrome de HELLP, enfermedad de Von Willebrand de tipo 2, sepsis, o síndrome de antifosfolípidos. Según una realización preferida, pero no limitante, el procedimiento según la invención se emplea para distinguir entre diferentes estados o formas, para seguir el avance, para realizar predicciones acerca del avance, para determinar un tratamiento o un régimen de tratamiento adecuados, para determinar la eficacia terapéutica de un tratamiento y/o para modificar dicho tratamiento cuando sea aconsejable, de la púrpura trombocitopénica (TTP). En particular, según esta realización, el procedimiento puede utilizarse para distinguir entre pacientes con TTP adquirida y pacientes con TTP congénita. Como se describe en la parte experimental que aparece a continuación, una muestra obtenida a partir de un paciente con la forma congénita de TTP contendrá significativamente más vWF activado que una muestra obtenida a partir de un paciente con la forma adquirida de TTP, permitiendo distinguir con ello a los pacientes con la forma congénita de TTP de los pacientes con la forma adquirida de TTP (por ejemplo, esto puede hacerlo un médico). Según otra realización preferida, pero no limitante, el procedimiento según la invención se emplea para distinguir entre diferentes estados o formas, para seguir el avance, para realizar predicciones acerca del avance, para determinar un tratamiento o un régimen de tratamiento adecuados, para determinar la eficacia terapéutica de un tratamiento y/o para modificar dicho tratamiento cuando sea aconsejable, del síndrome de HELLP. Por ejemplo, según esta realización, el procedimiento de la invención puede utilizarse para distinguir entre pacientes con preeclampsia y pacientes con síndrome de HELLP (una forma grave de preeclampsia). Esta realización también puede utilizarse para seguir y/o predecir el avance de la preeclampsia, y en particular para predecir cuántos pacientes con preeclampsia desarrollarán HELLP y/o para determinar cuántos pacientes con preeclampsia tienen un mayor riesgo de desarrollar HELLP. Como se describe en la parte experimental que aparece a continuación, una muestra obtenida a partir de un paciente con HELLP contendrá significativamente más vWF activado que una muestra obtenida a partir de un sujeto encinta sano y que una muestra obtenida a partir de un paciente con preeclampsia, permitiendo distinguir con ello a los pacientes con el síndrome de HELLP de los sujetos sanos y de los pacientes con preeclampsia (por ejemplo, esto puede hacerlo un médico), y también seguir y/o predecir el avance de la preeclampia, y en particular predecir cuántos pacientes con preeclampsia desarrollarán... o formas de enfermedades y trastornos caracterizados por la trombocitopenia y/o por la interacción espontánea entre el factor de Von Willebrand (vWF) y las plaquetas, y/o para predecir el avance de dicha enfermedad o trastorno.
Reivindicaciones:
1. Un procedimiento para distinguir entre diferentes estados o formas de enfermedades y trastornos que se caracterizan por la trombocitopenia y/o por la interacción espontánea entre el factor de Von Willebrand (vWF) y las plaquetas, y/o para predecir el avance de dicha enfermedad
o trastorno, comprendiendo dicho procedimiento las etapas de:
a) proporcionar al menos una muestra biológica que contenga vWF obtenida a partir de un paciente que padece, o que se sospecha que padece, al menos una enfermedad o un trastorno caracterizado por la trombocitopenia y/o por la interacción espontánea entre el vWF y las plaquetas;
b) determinar la cantidad de vWF que está en una conformación de unión a Gplb en dicha muestra biológica; y
c) comparar la cantidad obtenida de vWF que está en una conformación de unión a Gplb con un valor de referencia obtenido a partir de un paciente o de un grupo de pacientes con o sin un estado o forma diferente de dicha enfermedad o trastornos; y
d) en el que la cantidad de vWF que está en una conformación de unión a Gplb se determina poniendo en contacto la muestra biológica con un agente de unión que es capaz de unirse de modo selectivo al vWF que está en una conformación de unión a Gplb en presencia de vWF que está en una conformación de no unión a Gplb, y después determinando la cantidad de vWF que está en una conformación de unión a Gplb unido al agente de unión.
en el que el agente de unión tiene un sitio de unión diferenciado del sitio de unión de Gplbα, y en el que el agente de unión es un anticuerpo; una parte o un fragmento de un anticuerpo; o una proteína o un polipéptido que contiene una o más partes o fragmentos de un anticuerpo.
2. Un procedimiento según la reivindicación 1, en el que el agente de unión es capaz de distinguir entre vWF que está en una conformación de no unión a Gplb y vWF activado por ristocetina.
3. Un procedimiento según la reivindicación 1 ó 2, en el que el agente de unión es una proteína o un polipéptido que es capaz de unirse de modo específico a vWF que está en una conformación de unión a Gplb en presencia de vWF que está en una conformación de no unión a Gplb.
4. Un procedimiento según la reivindicación 1 ó 2, en el que el agente de unión es un anticuerpo de cadena pesada que es capaz de unirse de modo específico a vWF que está en una conformación de unión a Gplb en presencia de vWF que está en una conformación de no unión a Gplb; una parte o un fragmento de un anticuerpo de cadena pesada, en el que dicha parte o fragmento es capaz de unirse de modo específico a vWF que está en una conformación de unión a Gplb en presencia de vWF que está en una conformación de no unión a Gplb; o una proteína o un polipéptido que contiene una o más partes o fragmentos de un anticuerpo de cadena pesada, en el que al menos una de dichas partes o fragmentos es capaz de unirse de modo específico a vWF que está en una conformación de unión a Gplb en presencia de vWF que está en una conformación de no unión a Gplb.
5. Un procedimiento según la reivindicación 1 ó 2, en el que el agente de unión es un dominio variable de un anticuerpo, en el que dicho dominio variable es capaz de unirse de modo específico a vWF que está en una conformación de unión a Gplb en presencia de vWF que está en una conformación de no unión a Gplb; o una proteína o un polipétido que contiene uno o más dominios variables, en el que al menos uno de dichos dominios variables es capaz de unirse de modo específico a vWF que está en una conformación de unión a Gplb en presencia de vWF que está en una conformación de no unión a Gplb.
6. Un procedimiento de la reivindicación 5, en el que al menos uno de dichos dominios variables es un dominio variable de cadena pesada.
7. Un procedimiento de la reivindicación 5, en el que al menos uno de dichos dominios variables es un dominio variable de un anticuerpo de cadena pesada.
8. Un procedimiento según una cualquiera de las reivindicaciones 1-7, en el que el agente de unión es un nanocuerpo que es capaz de unirse de modo específico a vWF que está en una conformación de unión a Gplb en presencia de vWF que está en una conformación de no unión a Gplb; o una proteína o un polipéptido que contiene uno o más nanocuerpos, en el que al menos al menos uno de dichos nanocuerpos es capaz de unirse de modo específico a vWF que está en una conformación de unión a Gplb en presencia de vWF que está en una conformación de no unión a Gplb.
9. Un procedimiento según una cualquiera de las reivindicaciones 1-8, en el que el agente de unión es el anticuerpo de cadena pesada AU/VWFa-11; una parte o un fragmento del anticuerpo de cadena pesada AU/VWFa-11 y en particular el dominio variable del anticuerpo de cadena pesada AU/VWFa-11; o una proteína o un polipéptido que contiene una o más partes o fragmentos del anticuerpo de cadena pesada AU/VWFa-11, y que en particular contiene al menos un dominio variable del anticuerpo de cadena pesada AU/VWFa-11.
10. Un procedimiento según una cualquiera de las reivindicaciones anteriores, en el que la muestra biológica es una muestra que contiene vWF y plaquetas.
11. Un procedimiento según una cualquiera de las reivindicaciones anteriores, en el que la muestra biológica se elige de sangre completa, plasma, suero u otras fracciones sanguíneas adecuadas.
12. Un procedimiento según una cualquiera de las reivindicaciones anteriores, en el que
se determinan la cantidad de vWF que está en la conformación de unión a Gplb en la muestra y el número de plaquetas en la muestra y opcionalmente se comparan entre sí.
13. Un procedimiento según una cualquiera de las reivindicaciones anteriores, en el que las enfermedades y los trastornos que se caracterizan por la trombocitopenia y/o por la interacción espontánea entre el vWF y las plaquetas se eligen del grupo que consiste en púrpura trombocitopénica (TTP), síndrome de HELLP, enfermedad de Von Willebrand de tipo 2, sepsis y síndrome de antifosfolípidos.
14. Un procedimiento según la reivindicación 13, en el que las enfermedades y los trastornos que se caracterizan por la trombocitopenia y/o por la interacción espontánea entre el vWF y las plaquetas son la púrpura trombocitopénica (TTP), y en el que el procedimiento se utiliza para distinguir entre pacientes con TTP adquirida y pacientes con TTP congénita.
15. Un procedimiento según la reivindicación 13, en el que las enfermedades y los trastornos que se caracterizan por la trombocitopenia y/o por la interacción espontánea entre el vWF y las plaquetas son la preeclampsia o el síndrome de HELLP, y en el que el procedimiento se utiliza para distinguir entre pacientes con preeclampsia y pacientes con el síndrome de HELLP.
16. Un procedimiento según la reivindicación 13, en el que las enfermedades y los trastornos que se caracterizan por la trombocitopenia y/o por la interacción espontánea entre el vWF y las plaquetas son la preeclampsia, y en el que el procedimiento se utiliza para predecir el avance de dicha preeclampsia, y en particular para predecir cuántos pacientes con preeclampsia desarrollarán HELLP y/o para determinar cúantos pacientes tienen un mayor riesgo de desarrollar HELLP.
17. Un procedimiento según una cualquiera de las reivindicaciones 1-16, en el que el agente de unión está inmovilizado sobre un soporte adecuado.
18. El uso de un anticuerpo que es capaz de unirse de modo específico a vWF que está en una conformación de unión a Gplb en presencia de vWF que está en una conformación de no unión a Gplb; de una parte o un fragmento de un anticuerpo, en el que dicha parte o fragmento es capaz de unirse de modo específico a vWF que está en una conformación de unión a Gplb en presencia de vWF que está en una conformación de no unión a Gplb; o de una proteína o un polipéptido que contiene una parte o un fragmento de un anticuerpo, en el que dicha parte o fragmento es capaz de unirse de modo específico a vWF que está en una conformación de unión a Gplb en presencia de vWF que está en una conformación de no unión a Gplb; para distinguir entre diferentes estados o formas de enfermedades o trastornos que se caracterizan por la trombocitopenia y/o por la interacción espontánea entre el vWF y las plaquetas, y/o para predecir el avance de dicha enfermedad o trastorno; y/o en un procedimiento para realizar esto, en el que
el anticuerpo tiene un sitio de unión diferenciado del sitio de unión de Gplbα.
19. El uso de un anticuerpo según la reivindicación 18, en el que el anticuerpo se utiliza
como agente trazador para localizar trombos o condiciones de alta velocidad de cizallamiento en
la vasculatura de pacientes.
Patentes similares o relacionadas:
Procedimiento de prueba de plaquetas en sangre, del 15 de Julio de 2020, de FUJIMORI KOGYO CO., LTD: Procedimiento para someter a prueba la agregación plaquetaria, que comprende someter sangre anticoagulada a un tratamiento débil de activación […]
Composición para la determinación de las características de coagulación de un líquido de ensayo, del 6 de Mayo de 2020, de C A CASYSO AG: Una composición de diagnóstico para su uso en el análisis viscoelástico de un líquido de ensayo seleccionado de entre sangre entera o plasma sanguíneo, que comprende: […]
Concentración de células raras, del 23 de Octubre de 2019, de SIEMENS HEALTHCARE DIAGNOSTICS INC.: Método para aumentar una razón de células raras con respecto a células no raras en una muestra de sangre que se sospecha que contiene células raras y células no raras, comprendiendo […]
Procedimiento de detección de coagulación intravascular diseminada o coagulación intravascular diseminada infecciosa, del 2 de Octubre de 2019, de LSI Medience Corporation: Un procedimiento in vitro de detección de coagulación intravascular diseminada, que comprende medir sCD14-ST en una muestra.
Interfaz y procedimientos de un interpretador de resultados de un sistema de examen de sangre, del 18 de Septiembre de 2019, de C A Casyso GmbH: Un procedimiento para proporcionar un producto de interpretación de resultados, que comprende: recibir, en una máquina analizadora de sangre […]
 Ensayo para determinar anticoagulantes en sangre o plasma sanguíneo, del 31 de Julio de 2019, de Ravmarker AB: Un ensayo para determinar los anticoagulantes en una muestra de sangre o de plasma sanguíneo, en el que los anticoagulantes determinados en dicho ensayo son inhibidores […]
Ensayo para determinar anticoagulantes en sangre o plasma sanguíneo, del 31 de Julio de 2019, de Ravmarker AB: Un ensayo para determinar los anticoagulantes en una muestra de sangre o de plasma sanguíneo, en el que los anticoagulantes determinados en dicho ensayo son inhibidores […]
Dispositivo que incluye componentes sanguíneos para separar moléculas o partículas diana de muestras, del 24 de Julio de 2019, de Debiopharm International S.A: Dispositivo de recogida de muestras para separar agentes infecciosos, toxinas, ácidos nucleicos y/o proteínas de una muestra que comprende: (i) un código […]
Reactivo de tiempo de protrombina que contiene un quelante de hierro, del 6 de Junio de 2019, de SIEMENS HEALTHCARE DIAGNOSTICS PRODUCTS GMBH: Reactivo de tiempo de protrombina que contiene proteína de factor tisular y fosfolípidos, caracterizado porque el reactivo contiene además al menos un quelante de hierro, […]