METODOS PARA LA DETECCION DIRECTA DE METABOLITOS DE METOTREXATO INDIVIDUALES.
Método para determinar un nivel de un poliglutamato de metotrexato (MXTPG) en un extracto celular,
caracterizado por:
(a) la precipitación de material proteínico en el extracto celular y la inyección directa del sobrenadante resultante en un sistema de cromatografía de líquidos de alta resolución para resolver al menos un MTXPG; (b) irradiar dicho al menos un MTXPG resuelto, produciendo de ese modo al menos un producto fotolítico de MTXPG fluorescente resuelto; y (c) detectar dicho al menos un producto fotolítico de MTXPG fluorescente resuelto, determinando de ese modo el nivel de dicho MTXPG, en el que la detección de dicho producto fotolítico de MTXPG fluorescente resuelto se produce sin fraccionamiento de dicho producto fotolítico de MTXPG fluorescente resuelto a partir de otras especies de MTXPG
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/006312.
Solicitante: PROMETHEUS LABORATORIES, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 5739 PACIFIC CENTER BOULEVARD,SAN DIEGO, CA 92121-4203.
Inventor/es: DERVIEUX,THIERRY, RICHERSON,RUSSELL.
Fecha de Publicación: .
Fecha Concesión Europea: 28 de Octubre de 2009.
Clasificación Internacional de Patentes:
- G01N33/94 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen narcóticos.
Clasificación PCT:
- A01N1/02 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01N CONSERVACION DE CUERPOS HUMANOS O ANIMALES O DE VEGETALES O DE PARTES DE ELLOS (conservación de alimentos o productos alimenticios A23 ); BIOCIDAS, p. ej. EN TANTO QUE SEAN DESINFECTANTES, PESTICIDAS O HERBICIDAS (preparaciones de uso médico, dental o para el aseo que eliminan o previenen el crecimiento o la proliferación de organismos no deseados A61K ); PRODUCTOS QUE ATRAEN O REPELEN A LOS ANIMALES; REGULADORES DEL CRECIMIENTO DE LOS VEGETALES. › A01N 1/00 Conservación de cuerpos humanos o animales, o partes de ellos. › Conservación de partes vivas.
- C12Q1/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones.
- C12Q1/02 C12Q […] › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen microorganismos vivos.
- G01N21/62 G01N […] › G01N 21/00 Investigación o análisis de los materiales por la utilización de medios ópticos, es decir, utilizando rayos infrarrojos, visibles o ultravioletas (G01N 3/00 - G01N 19/00 tienen prioridad). › Sistemas en los cuales el material analizado se excita de forma que emita luz o produzca un cambio de la longitud de onda de la luz incidente.
- G01N21/75 G01N 21/00 […] › Sistemas en los cuales el material se somete a una reacción química, siendo analizado la mejora o el resultado de la reacción (sistemas en los cuales el material se quema con llama o plasma G01N 21/72, G01N 21/73).
- G01N30/02 G01N […] › G01N 30/00 Investigación o análisis de materiales por separación en constituyentes utilizando la adsorción, la absorción o fenómenos similares o utilizando el intercambio iónico, p. ej. la cromatografía (G01N 3/00 - G01N 29/00 tienen prioridad). › Cromatografía sobre columna.
- G01N33/00 G01N […] › Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00.
- G01N33/48 G01N 33/00 […] › Material biológico, p. ej. sangre, orina (G01N 33/02, G01N 33/26, G01N 33/44, G01N 33/46 tienen prioridad ); Hemocitómetros (cómputo de glóbulos repartidos sobre una superficie por barrido óptico de la superficie G06M 11/02).
Clasificación antigua:
- A01N1/02 A01N 1/00 […] › Conservación de partes vivas.
- C12Q1/00 C12Q […] › Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones.
- C12Q1/02 C12Q 1/00 […] › en los que intervienen microorganismos vivos.
- G01N21/62 G01N 21/00 […] › Sistemas en los cuales el material analizado se excita de forma que emita luz o produzca un cambio de la longitud de onda de la luz incidente.
- G01N21/75 G01N 21/00 […] › Sistemas en los cuales el material se somete a una reacción química, siendo analizado la mejora o el resultado de la reacción (sistemas en los cuales el material se quema con llama o plasma G01N 21/72, G01N 21/73).
- G01N30/02 G01N 30/00 […] › Cromatografía sobre columna.
- G01N33/00 G01N […] › Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00.
- G01N33/48 G01N 33/00 […] › Material biológico, p. ej. sangre, orina (G01N 33/02, G01N 33/26, G01N 33/44, G01N 33/46 tienen prioridad ); Hemocitómetros (cómputo de glóbulos repartidos sobre una superficie por barrido óptico de la superficie G06M 11/02).
Fragmento de la descripción:
Métodos para la detección directa de metabolitos de metotrexato individuales.
Campo de la invención
Esta invención se refiere en general a métodos para monitorizar el tratamiento con fármacos y, más específicamente, a métodos para monitorizar la eficacia y la toxicidad del tratamiento farmacológico con metotrexato.
Antecedentes de la invención
El folato (ácido fólico) es una vitamina que es esencial para los procesos que mantienen la vida de síntesis, replicación y reparación de ADN. El folato también es importante para la biosíntesis de proteínas, otro proceso que es fundamental para la viabilidad de las células. El compuesto de pteridina, metotrexato (MTX), es estructuralmente similar al folato y como resultado puede unirse a los sitios activos de una serie de enzimas que normalmente usan folato como coenzima para la biosíntesis de precursores de nucleótidos de purina y pirimidina del ADN y para la interconversión de aminoácidos durante la biosíntesis de proteínas. A pesar de su similitud estructural con el ácido fólico, el metotrexato no puede usarse como cofactor por las enzimas que requieren folato, y en su lugar compite con el cofactor folato por los sitios de unión a enzimas, inhibiendo de este modo la biosíntesis de proteínas y ADN y, por tanto, la división celular.
La capacidad del metotrexato para inhibir la división celular se ha aprovechado en el tratamiento de una serie de enfermedades y estados que se caracterizan por un crecimiento celular rápido o aberrante. Como ejemplo, las enfermedades autoinmunitarias se caracterizan por una respuesta inmunitaria inapropiada dirigida contra los tejidos autólogos (propios) normales y están mediadas por células B o células T que se replican rápidamente. Las enfermedades autoinmunitarias que se han tratado con metotrexato incluyen, sin limitación, artritis reumatoide y otras formas de artritis, psoriasis, esclerosis múltiple, la fase autoinmunitaria de la diabetes mellitus (diabetes tipo 1 o de aparición juvenil), uveorretinitis autoinmunitaria, miastenia grave, tiroiditis autoinmunitaria y lupus eritematoso sistémico.
Puesto que muchas células malignas proliferan más rápidamente que las células normales, el metotrexato también puede usarse para afectar de manera selectiva al crecimiento de células cancerosas. Como consecuencia, el metotrexato es un agente antineoplásico usado ampliamente, empleado, por ejemplo, en el tratamiento de leucemia linfocítica aguda, cáncer de mama, cánceres epidermoides de cabeza y cuello, micosis fungoide avanzada, cáncer de pulmón, linfomas no de Hodgkins, coriocarcinoma gestacional, mola invasiva y molas hidatiformes.
A pesar de su eficacia terapéutica para una amplia variedad de enfermedades y estados, el tratamiento con metotrexato puede presentar un riesgo para el paciente. En particular, dado que el metotrexato interfiere en los procesos requeridos para la replicación y división de células normales así como enfermas, niveles inapropiadamente altos del fármaco pueden conducir a la destrucción de tejidos no diana que proliferan activamente tales como la médula ósea y la mucosa intestinal. Se ha asociado al metotrexato con la toxicidad renal y hepática cuando se administra en el régimen de dosis altas
que se requiere para algunos estados. Además, el tratamiento con metotrexato a dosis bajas puede conducir a toxicidad y efectos secundarios no deseados en algunos pacientes, cuando la dosificación no es apropiada debido a la variabilidad individual en los parámetros farmacocinéticos que influyen, por ejemplo, en la absorción, selección como diana y aclaramiento del fármaco. Esta situación es especialmente problemática en el tratamiento de estados crónicos tales como la artritis reumatoide, en la que el metotrexato puede administrarse durante un periodo de muchos años.
Puesto que las diferencias individuales en los parámetros farmacocinéticos pueden ser difíciles de predecir, las estrategias seguras y eficaces de tratamiento con metotrexato requieren que se monitoricen los niveles de metotrexato o metabolitos de metotrexato en los pacientes en tratamiento. Se han desarrollado una variedad de métodos para monitorizar las concentraciones farmacológicas de metotrexato en plasma que incluyen bioensayos, ensayos cromatográficos y de detección inmunológicos. Tales métodos de detección en plasma han sido útiles para monitorizar el tratamiento con metotrexato a dosis altas en algunas aplicaciones clínicas. Sin embargo, debido a las limitaciones en su sensibilidad, estos métodos de detección en plasma no han sido útiles para monitorizar el tratamiento con metotrexato a dosis bajas, para el que deben analizarse los niveles intracelulares de los metabolitos de metotrexato.
El metotrexato se metaboliza tras la captación por las células de mamífero, de manera que se añaden uno o más restos de glutamilo al metotrexato dando una mezcla de poliglutamatos de metotrexato (MTXPG). El número de restos de glutamilo que pueden añadirse al MTX generalmente varía de dos a siete. Los MTXPG no se liberan fácilmente de las células y por tanto pueden ejercer sus efectos citotóxicos durante largos periodos de tiempo. Se ha demostrado que los niveles de MTXPG intracelulares son mayores en pacientes que respondieron al tratamiento con metotrexato en comparación con los niveles intracelulares en pacientes que no respondieron. Los métodos disponibles actualmente para medir los niveles intracelulares de poliglutamatos de metotrexato se basan en un ensayo con la enzima dihidrofolato reductasa en el que los niveles de poliglutamatos de metotrexato se calculan basándose en su capacidad para inhibir a la enzima dihidrofolato reductasa. Sin embargo, el alcance de la inhibición de la enzima en estos ensayos depende del número de restos de glutamilo unidos al metotrexato, haciendo imposible una determinación exacta de los niveles intracelulares de poliglutamatos de metotrexato mediante este método. La variabilidad de los ensayos basados en la hidrofolato reductasa puede agravarse además en algunas situaciones porque los folatos, que están presentes en diferentes cantidades dependiendo de la respuesta de un individuo al tratamiento con metotrexato y la cantidad de folato aportada por la dieta, también influyen en los resultados del ensayo actual con la enzima.
La publicación PCT número WO 2004/020622 describe un método para determinar de manera indirecta los niveles de MTXPG convirtiendo en primer lugar los MTXPG en MTX y cuantificando después los niveles de MTX, en el que los niveles cuantificados de MTX se correlacionan con los niveles de MTXPG.
Brouwer et al. (FASEB J., 14:A720 (2000)) describe un método para cuantificar los niveles de MTXPG usando el fraccionamiento de los MTXPG de glóbulos rojos (GR). El método no detecta los MTXPG de GR en una única ejecución, sino que requiere dos etapas de separación en columna: (1) separación para elución total de las especies de MTXPG mediante cromatografía de afinidad, seguida por (2) otra separación para fraccionar y recoger los MTXPG en un único tubo antes de la fotólisis.
Por tanto, existe una necesidad de nuevos métodos para determinar los niveles intracelulares de poliglutamatos de metotrexato y para monitorizar la eficacia y la toxicidad del tratamiento con metotrexato incluyendo el tratamiento con metotrexato a dosis bajas. La presente invención satisface esta necesidad y también proporciona ventajas relacionadas.
Sumario de la invención
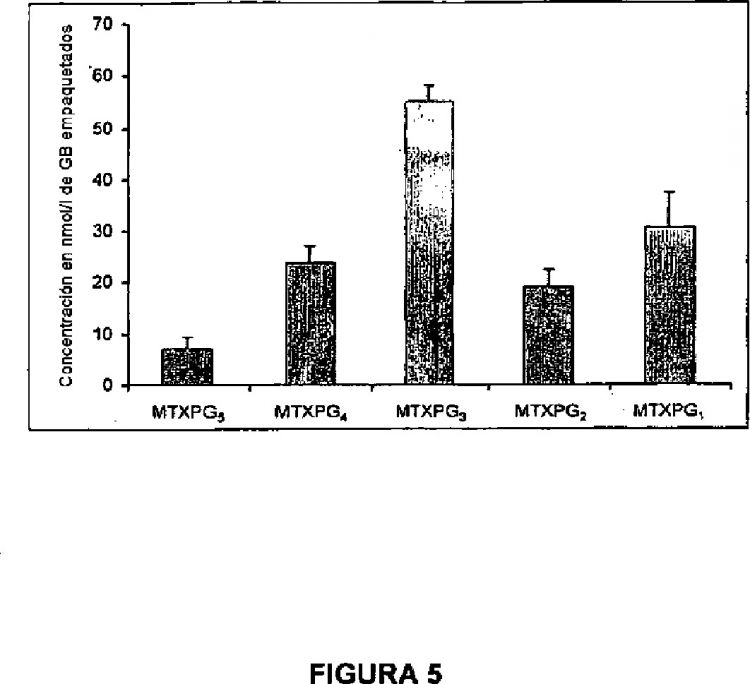
La presente invención proporciona un método para determinar un nivel de un poliglutamato de metotrexato en un extracto celular caracterizado por la precipitación de material proteínico en el extracto celular y la inyección directa del sobrenadante resultante en un sistema de cromatografía de líquidos de alta resolución (HPLC) para resolver al menos un MTXPG en el extracto celular; irradiar el al menos un MTXPG, produciendo de ese modo al menos un producto fotolítico de MTXPG fluorescente resuelto; y detectar el al menos un producto fotolítico de MTXPG fluorescente resuelto, determinando de ese modo un nivel del MTXPG. Un método de la invención puede ser útil, por ejemplo, para determinar un nivel de MTXPG3, MTXPG4 o MTXPG5, o para determinar un nivel de cada una de las especies de MTXPG1 a MTXPG7 presentes en el extracto celular.
El método de la invención puede usarse para optimizar la eficacia terapéutica o reducir la toxicidad asociada con el tratamiento con metotrexato administrado a un ser humano seleccionando un fármaco o una dosificación que...
Reivindicaciones:
1. Método para determinar un nivel de un poliglutamato de metotrexato (MXTPG) en un extracto celular, caracterizado por:
en el que la detección de dicho producto fotolítico de MTXPG fluorescente resuelto se produce sin fraccionamiento de dicho producto fotolítico de MTXPG fluorescente resuelto a partir de otras especies de MTXPG.
2. Método según la reivindicación 1, en el que dicha precipitación de material proteínico es precipitación con ácido perclórico.
3. Método según la reivindicación 1, en el que dicha cromatografía de líquidos de alta resolución se lleva a cabo en una columna de fase inversa.
4. Método según la reivindicación 1, en el que dicha cromatografía de líquidos de alta resolución se lleva a cabo en una columna de fase inversa C18 con un tampón acetato de amonio/acetonitrilo.
5. Método según la reivindicación 1, en el que dicho producto fotolítico de MTXPG fluorescente tiene dos picos de excitación en el intervalo de 240 nm a 420 nm, incluyendo un pico de desde 240 nm hasta 300 nm, y un pico de desde 360 nm hasta 410 nm, y un pico de emisión en el intervalo de 440 nm a 520 nm.
6. Método según la reivindicación 1, en el que la etapa (b) comprende irradiar con UV dicho al menos un MTXPG resuelto.
7. Método según la reivindicación 6, en el que dicha irradiación con UV utiliza radiación que tiene una longitud de onda en el intervalo de 225 nm a 275 nm.
8. Método según la reivindicación 7, en el que dicha irradiación con UV utiliza radiación que tiene una longitud de onda de 254 nm.
9. Método según la reivindicación 1, en el que la etapa (b) se lleva a cabo irradiando dicho al menos un MTXPG resuelto en un disolvente que tiene del 0,05% al 1% de H2O2.
10. Método según la reivindicación 9, en el que la etapa (b) se lleva a cabo irradiando dicho al menos un MTXPG resuelto en un disolvente que tiene del 0,1% al 0,3% de H2O2.
11. Método según la reivindicación 1, en el que la etapa (b) comprende irradiar dicho al menos un MTXPG resuelto durante de 0,5 a 60 segundos.
12. Método según la reivindicación 11, en el que la etapa (b) comprende irradiar dicho al menos un MTXPG durante de 0,5 a 15 segundos.
13. Método según la reivindicación 1, en el que la etapa (c) comprende detectar la fluorescencia tras la excitación en el intervalo de 240 nm a 420 nm.
14. Método según la reivindicación 13, en el que la etapa (c) comprende detectar la fluorescencia tras la excitación en el intervalo de 240 nm a 300 nm.
15. Método según la reivindicación 14, en el que la etapa (c) comprende detectar la fluorescencia tras la excitación con radiación UV a 274 nm.
16. Método según la reivindicación 13, en el que la etapa (c) comprende detectar la fluorescencia tras la excitación en el intervalo de 360 nm a 410 nm.
17. Método según la reivindicación 1, en el que la etapa (c) comprende detectar la fluorescencia a una longitud de onda de emisión en el intervalo de 320 nm a 550 nm.
18. Método según la reivindicación 17, en el que la etapa (c) comprende detectar la fluorescencia a una longitud de onda de emisión en el intervalo de 440 nm a 500 nm.
19. Método según la reivindicación 18, en el que la etapa (c) comprende detectar la fluorescencia a una longitud de onda de emisión de 464 nm.
20. Método según la reivindicación 19, en el que la etapa (c) comprende detectar la fluorescencia tras la excitación con radiación UV a 274 nm y a una longitud de onda de emisión de 464 nm.
21. Método según la reivindicación 1, en el que dicho extracto celular es un extracto de células humanas.
22. Método según la reivindicación 1, en el que dicho extracto celular es de un ser humano sometido a tratamiento con metotrexato.
23. Método según la reivindicación 1, en el que el dicho extracto celular es de un ser humano sometido a tratamiento con metotrexato a dosis bajas.
24. Método según la reivindicación 22 ó 23, que comprende seleccionar un fármaco o una dosificación que debe administrarse posteriormente a dicho ser humano basándose en dicho nivel de MTXPG.
25. Método según la reivindicación 1, que comprende determinar un nivel de MTXPG3, MTXPG4 o MTXPG5.
26. Método según la reivindicación 1, que comprende determinar un nivel de cada uno de MTXPG1 a MTXPG7.
27. Método según la reivindicación 24, que comprende alterar una dosificación de MTX administrada posteriormente a dicho ser humano.
28. Método según la reivindicación 27, que comprende reducir una dosificación de MTX administrada posteriormente a dicho ser humano.
29. Método según la reivindicación 27, que comprende aumentar una dosificación de MTX administrada posteriormente a dicho ser humano.
30. Método según la reivindicación 24, que comprende alterar una dosis de ácido fólico, o un derivado del mismo, administrada posteriormente a un ser humano.
31. Método según la reivindicación 1, en el que dicho extracto celular es un extracto de glóbulos rojos.
32. Método según la reivindicación 1, en el que dicho extracto celular es un extracto de leucocitos.
33. Método según la reivindicación 1, que puede detectar menos de 500 nmol de cada especie de MTXPG individual por litro de glóbulos rojos empaquetados.
34. Método según la reivindicación 1, que puede detectar menos de 50 nmol de cada especie de MXTPG individual por litro de glóbulos rojos empaquetados.
35. Método según la reivindicación 22 ó 23, en el que dicho ser humano tiene una enfermedad autoinmunitaria.
36. Método según la reivindicación 35, en el que dicha enfermedad autoinmunitaria es artritis.
37. Método según la reivindicación 35, en el que dicha enfermedad autoinmunitaria se selecciona del grupo que consiste en artritis reumatoide, poliartritis, lupus eritematoso sistémico y psoriasis.
38. Método según la reivindicación 22 ó 23, en el que dicho ser humano tiene cáncer.
39. Método según la reivindicación 1, en el que la etapa (c) comprende fluorimetría.
40. Método según la reivindicación 1, en el que la etapa (c) comprende espectrofotometría
41. Método según la reivindicación 1, en el que la etapa (c) comprende espectrometría de masas.
Patentes similares o relacionadas:
Anticuerpos para olanzapina y uso de los mismos, del 8 de Julio de 2020, de JANSSEN PHARMACEUTICA NV: Un anticuerpo aislado o un fragmento de unión del mismo, que se une a olanzapina y que se selecciona del grupo que consiste de: i) un anticuerpo aislado o un fragmento […]
Anticuerpos para haptenos de quetiapina y uso de los mismos, del 26 de Febrero de 2020, de JANSSEN PHARMACEUTICA NV: Un anticuerpo aislado o un fragmento de enlace del mismo, que enlaza específicamente con la quetiapina, y se genera en respuesta a un conjugado de un compuesto de Fórmula […]
Kits de detección de lectura directa para contaminación de superficie por fármacos antineoplásicos, del 12 de Febrero de 2020, de Centers for Disease Control and Prevention: Un procedimiento para detectar la contaminación por fármacos antineoplásicos de una superficie, que comprende: proporcionar una solución humectante […]
Método para la medición de anticuerpos anti-fármaco, del 25 de Diciembre de 2019, de JIMRO CO., LTD: Un método para medir anticuerpos anti-fármaco (ADA) en un analito a medir, comprendiendo el método: una etapa de proporcionar una muestra […]
Procedimiento diagnóstico para detectar una enfermedad autoinmunitaria relacionada con gaba(a) y materia objeto relacionada, del 27 de Noviembre de 2019, de Institut D'Investigaciones Biomèdiques August Pi i Sunyer: Uso in vitro de un GABA(A)R, fragmento de GABA(A)R, u homólogo del mismo o de una célula que expresa el GABA(A)R, fragmento de GABA(A)R, u homólogo del mismo para el pronóstico […]
Matriz multisensor y su uso para la detección de analitos o mezclas de los mismos en la fase gaseosa y procedimiento para su preparación, del 27 de Noviembre de 2019, de DANMARKS TEKNISKE UNIVERSITET: Una matriz multisensor para la detección de un analito o mezclas del mismo en la fase gaseosa, que comprende al menos dos compuestos quimioselectivos […]
Composiciones y métodos para la detección de metabolitos de metadona, del 5 de Noviembre de 2019, de SIEMENS HEALTHCARE DIAGNOSTICS INC.: Un compuesto que comprende una unidad estructural, seleccionada del grupo que consiste en unidades estructurales de etiqueta de poli(aminoácido), […]
Anticuerpos contra haptenos de olanzapina y uso de los mismos, del 15 de Mayo de 2019, de JANSSEN PHARMACEUTICA NV: Un método para producir un anticuerpo que se une a la olanzapina, el método comprendiendo: (i) seleccionar un huésped no humano para la producción de anticuerpos; […]