FORMULACIONES ORALES DE CLADRIBINA.
Una composición farmacéutica que comprende un complejo de cladribina-ciclodextrina compuesto que es una mezcla íntima amorfa de (a) un complejo de inclusión amorfo de cladribina con una ciclodextrina amorfa y (b) cladribina libre amorfa asociada con ciclodextrina amorfa como un complejo de no inclusión,
formulada en una forma sólida de dosificación oral
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/009387.
Solicitante: ARES TRADING S.A..
Nacionalidad solicitante: Suiza.
Dirección: ZONE INDUSTRIELLE DE L'OURIETTAZ 1170 AUBONNE SUIZA.
Inventor/es: BODOR, NICHOLAS, S., DANDIKER,YOGESH.
Fecha de Publicación: .
Fecha Solicitud PCT: 26 de Marzo de 2004.
Fecha Concesión Europea: 4 de Agosto de 2010.
Clasificación PCT:
- A61K31/52 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Purinas, p. ej. adenina.
- A61K47/48
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Formulaciones orales de cladribina.
Campo de la invención
La invención se refiere a una composición que comprende un complejo de cladribina-ciclodextrina compuesto, formulado en una forma sólida de dosificación oral, y a un método para aumentar la biodisponibilidad oral de la cladribina.
Antecedentes de la invención
La cladribina, que es un fármaco lábil frente a los ácidos tiene una estructura química mostrada a continuación:
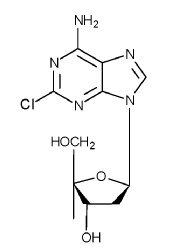
También se conoce como 2-cloro-2'-desoxiadenosina o 2-CdA. La cladribina existe como un polvo cristalino, blanco, no higroscópico, que consiste en cristales individuales y agregados cristalinos.
La cladribina es un antimetabolito que se usa en el tratamiento de trastornos linfoproliferativos. Se ha usado para tratar leucemias experimentales tales como la L1210 y clínicamente para la leucemia de células pilosas y la leucemia linfocítica crónica así como la macroglobulinemia de Waldenstrom. Se ha usado también como un agente inmunosupresor y como una modalidad para el tratamiento de una variedad de enfermedades autoinmunes que incluyen artritis reumatoide, enfermedad inflamatoria intestinal, (por ejemplo, enfermedad de Crohn, colitis ulcerosa) y esclerosis múltiple (ver por ejemplo J. Liliemark, Clin. Parmacokinet, 32(2): 120-131, 1997). Se han investigado también, experimental o clínicamente, por ejemplo linfomas, histiocitosis de células de Langerhan, lupus eritematoso, psoriasis en placas crónica, síndrome de Sezary, síndrome de Bing-Neel, glioma recurrente, y tumores sólidos.
Se prefiere frecuentemente el suministro oral de fármacos al suministro parenteral por una variedad de razones, en primer lugar la conformidad del paciente, o por consideraciones de coste o terapéuticas. Se aumenta la conformidad del paciente en la medida en que las formas de dosificación oral alivian las visitas repetidas del proveedor de asistencia sanitaria, o la incomodidad de inyecciones o tiempos de inyección prolongados asociados con algunos fármacos activos. A la vez que los costes de asistencia sanitaria en continuo aumento, los costes reducidos asociados a la administración oral frente a los costes de la administración parenteral ganan importancia. El coste de la administración parenteral es mucho mayor debido a la necesidad de que un profesional sanitario administra la cladribina en el entorno del proveedor de la asistencia sanitaria, que también incluye todos los costes de asistencia asociados a tal administración. Además, en algunos casos, consideraciones terapéuticas tales como la necesidad de una liberación lenta de cladribina a lo largo de un periodo prolongado de tiempo se pueden satisfacer solamente por suministro oral o transmucoso.
Sin embargo, hasta la fecha el suministro oral de cladribina ha estado dificultado por la baja biodisponibilidad (ver, por ejemplo, J. Liliemark et al., J. Clin. Oncol., 10(10): 1514-1518, 1992), y la variación sub-óptima entre pacientes (ver, por ejemplo, J. Liliemark, Clin. Pharmacokinet, 32(2): 120-131, 1997). Ver también A. Tarasuik, et al. que describen mala absorción y labilidad dependiente del pH (Arch. Immunol. et Therapiae Exper., 42: 13-15, 1994).
Las ciclodextrinas son oligosacáridos cíclicos compuestos por unidades cíclicas de D-glucopiranosa unidas por enlaces α-(1
Recientemente, Schultz et al., en la Patente de U.S. No. 6.194.395 B1, han descrito la complejación y disolución de cladribina con ciclodextrina. La patente de Schultz et al. aborda principalmente los problemas inherentes en formulaciones acuosas de cladribina previamente descritas, en particular para inyección subcutánea e intramuscular. Schultz et al. han descubierto que la cladribina es no solo significativamente más soluble en medios acuosos cuando se formula con ciclodextrina, sino que también es más estable frente a la hidrólisis catalizada por ácidos cuando se combina con ciclodextrina. Se cree que el último hallazgo es de particular utilidad en la formulación de formas sólidas de dosificación oral, donde el compuesto sufriría normalmente hidrólisis a pH ácido del contenido del estómago. Schultz et al. no parecen haber descrito trabajo alguno real en conexión con formas sólidas de dosificación oral. De hecho describen solamente un método para preparar la forma sólida de dosificación, que es un proceso de extrusión de masa fundida en el que la cladribina y ciclodextrina se mezclan con otros aditivos opcionales y después se calientan hasta que ocurre la fusión. Además, los amplios intervalos de dosificación de 1 mg a 15 mg de cladribina y 100 mg a 500 mg de ciclodextrina indicados en la patente no sugieren criticidad alguna para la cantidad concreta de ciclodextrina que esté presente con una cantidad dada de cladribina en una forma sólida de dosificación oral. Realmente estos intervalos de dosificación incluyen muchas combinaciones que pueden ser adecuadas como mezclas, pero no para formación de complejos. Por ejemplo, una relación de 1 mg de cladribina a 500 mg de ciclodextrina contiene demasiada ciclodextrina, de manera que el fármaco no abandonaría fácilmente el complejo para realizar su función terapéutica. Por otra parte, 15 mg de cladribina y solamente 100 mg de ciclodextrina no serían suficientes para acomplejar esa cantidad de cladribina.
La patente de Schultz et al., sí sugiere mejorar la estabilidad de la cladribina en formas de dosificación oral combinándola/complejándola con ciclodextrina, pero no sugiere mejorar la biodisponibilidad oral del fármaco por tales medios; en efecto, la patente no describe o sugiere un método para aumentar o maximizar la biodisponibilidad de la cladribina de una forma sólida de dosificación oral de cladribina y ciclodextrina, o una composición ideada especialmente para comportarse así.
Muchos investigadores han estudiado la solubilidad de fármacos específicos en agua que contiene diversas concentraciones de ciclodextrinas seleccionadas con el fin de demostrar que concentraciones crecientes de ciclodextrinas aumentan la solubilidad de los fármacos a temperaturas y pH seleccionados, como por ejemplo se describe en la patente de Schultz et al. Se han realizado también estudios de solubilidad de fases por diversos investigadores con el fin de aclarar la naturaleza de la formación de complejos, por ejemplo si la ciclodextrina y fármaco forman un complejo 1:1 o un complejo 1:2; ver por ejemplo la Patente de U.S. No. 4.497.803 de Harada et al., que se refiere a complejos de inclusión de antibióticos del grupo de la lankacidina con ciclodextrina, y la Patente de U.S. No. 4.478.995 de Shinoda et al. que se refiere a un complejo de una sal de adición ácida de trans-4-guanidinometilciclohexanocarboxilato de (2'-benciloxicarbonil)fenilo con una ciclodextrina.
Aunque Schultz et al. enseñan que un complejo de cladribina-ciclodextrina mejora la solubilidad de la cladribina en agua y su estabilidad frente a los ácidos, la técnica no sugiere cómo maximizar o aumentar los beneficios de la complejación en términos de biodisponibilidad y variación interpaciente cuando el complejo se ha de administrar en una forma sólida de dosificación oral.
Sumario de la invención
Se ha descubierto ahora que se pueden combinar ciclodextrinas amorfas con cladribina para formar un producto particularmente conveniente que se puede incorporar a una forma sólida de dosificación oral. Este producto es un complejo de cladribina-ciclodextrina compuesto, y la forma sólida de dosificación oral que lo contiene mejora la biodisponibilidad oral y/o consigue variación interpaciente y/o intrapaciente inferior del fármaco.
La...
Reivindicaciones:
1. Una composición farmacéutica que comprende un complejo de cladribina-ciclodextrina compuesto que es una mezcla íntima amorfa de (a) un complejo de inclusión amorfo de cladribina con una ciclodextrina amorfa y (b) cladribina libre amorfa asociada con ciclodextrina amorfa como un complejo de no inclusión, formulada en una forma sólida de dosificación oral.
2. La composición farmacéutica de acuerdo con la reivindicación 1, donde el complejo está saturado de cladribina.
3. La composición de acuerdo con la reivindicación 1 ó 2, donde la ciclodextrina amorfa es hidroxipropil-β-ciclodextrina, hidroxipropil-γ-ciclodextrina, β-ciclodextrina metilada al azar, carboximetil-β-ciclodextrina o sulfobutil-β-ciclodextrina.
4. La composición de acuerdo con la reivindicación 1 ó 2, donde la ciclodextrina amorfa es hidroxipropil-β-ciclodextrina.
5. La composición de acuerdo con la reivindicación 1 ó 2, donde la ciclodextrina amorfa es hidroxipropil-γ-ciclodextrina.
6. La composición de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde la relación en peso de cladribina a ciclodextrina amorfa es desde aproximadamente 1:10 a aproximadamente 1:16.
7. La composición de acuerdo con la reivindicación 6, donde la ciclodextrina amorfa es hidroxipropil-β-ciclodextrina.
8. La composición de acuerdo con la reivindicación 7, donde la relación en peso de cladribina a hidroxipropil-β-ciclodextrina es aproximadamente 1:14.
9. La composición de acuerdo con la reivindicación 7, donde la relación en peso de cladribina a hidroxipropil-β-ciclodextrina es aproximadamente 1:11.
10. La composición de acuerdo con la reivindicación 6, donde la ciclodextrina amorfa es hidroxipropil-γ-ciclodextrina.
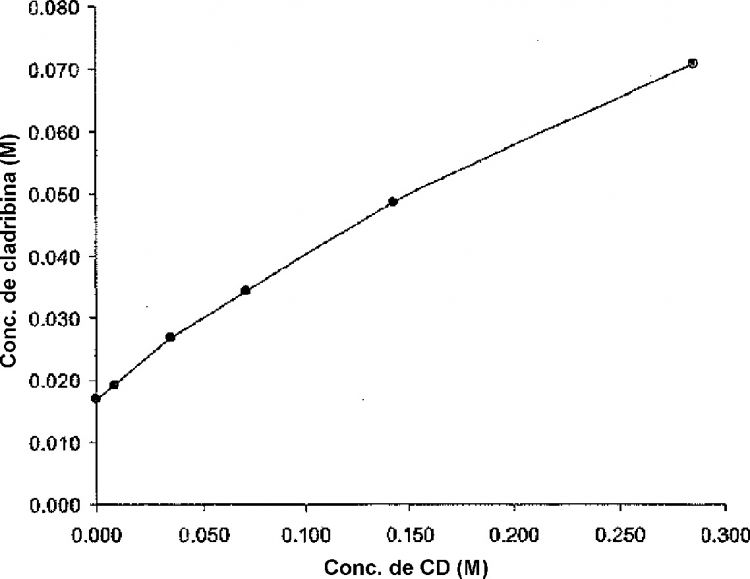
11. La composición de cuerdo con una cualquiera de las reivindicaciones 1 a 10, donde la relación molar aproximada de cladribina a ciclodextrina amorfa corresponde a un punto situado en un diagrama de solubilidad de fases para complejos saturados de cladribina en concentraciones variables de la ciclodextrina.
12. La composición de acuerdo con una cualquiera de las reivindicaciones 1 a 11, donde desde aproximadamente 30 a aproximadamente 40 por ciento en peso de la cladribina está en el complejo de inclusión (a) y desde aproximadamente 70 a aproximadamente 60 por ciento en peso de la cladribina está en el complejo de no inclusión (b).
13. Uso de un complejo de cladribina-ciclodextrina compuesto que es una mezcla íntima amorfa de (a) un complejo de inclusión amorfo de cladribina con una ciclodextrina amorfa y (b) cladribina libre amorfa asociada con ciclodextrina amorfa como un complejo de no inclusión, en la formulación de una forma sólida de dosificación oral, para administración en el tratamiento de síntomas de una enfermedad que responde a la cladribina.
14. Uso de acuerdo con la reivindicación 13, donde el complejo está saturado de cladribina.
15. Uso de acuerdo con la reivindicación 13 ó 14, donde la enfermedad que responde a la cladribina se selecciona del grupo consistente en esclerosis múltiple, artritis reumatoide y leucemia.
16. Uso de acuerdo con la reivindicación 15, donde la enfermedad que responde a la cladribina es esclerosis múltiple.
17. Uso de acuerdo con la reivindicación 13, 14, 15 ó 16, donde la ciclodextrina amorfa es hidroxipropil-β-ciclodextrina, hidroxipropil-γ-ciclodextrina, β-ciclodextrina metilada al azar, carboximetil-β-ciclodextrina o sulfobutil-β-ciclodextrina.
18. Uso de acuerdo con una cualquiera de las reivindicaciones 13 a 17, donde la relación en peso de cladribina a ciclodextrina amorfa es desde aproximadamente 1:10 a aproximadamente 1:16.
19. Uso de acuerdo con una cualquiera de las reivindicaciones 13 a 18, donde la ciclodextrina amorfa es hidroxipropil-β-ciclodextrina.
20. Uso de acuerdo con la reivindicación 19, donde la relación en peso de cladribina a hidroxipropil-β-ciclodextrina es aproximadamente 1:14.
21. Uso de acuerdo con la reivindicación 19, donde la relación en peso de cladribina a hidroxipropil-β-ciclodextrina es aproximadamente 1:11.
22. Uso de acuerdo con una cualquiera de las reivindicaciones 13 a 18, donde la ciclodextrina amorfa es hidroxipropil-γ-ciclodextrina.
23. Uso de acuerdo con una cualquiera de las reivindicaciones 13 a 22, donde desde aproximadamente 30 a aproximadamente 40 por ciento en peso de la cladribina está en el complejo de inclsuión (a) y desde aproximadamente 70 a aproximadamente 60 por ciento en peso de la cladribina está en el complejo de no inclusión (b).
24. Uso de un complejo de cladribina-ciclodextrina compuesto que es una mezcla íntima amorfa de (a) un complejo de inclusión amorfo de cladribina con una ciclodextrina amorfa y (b) cladribina libre amorfa asociada con ciclodextrina amorfa como un complejo de no inclusión, en la formulación de una forma sólida de dosificación oral, para aumentar la biodisponibilidad de la cladribina.
25. Uso de acuerdo con la reivindicación 24, donde el complejo está saturado de cladribina.
26. Uso de acuerdo con la reivindicación 24 ó 25, donde la ciclodextrina amorfa es hidroxipropil-β-ciclodextrina, hidroxipropil-γ-ciclodextrina, β-ciclodextrina metilada al azar, carboximetil-β-ciclodextrina o sulfobutil-β-ciclodextrina.
27. Uso de acuerdo con una cualquiera de las reivindicaciones 24 a 26, donde la relación en peso de cladribina a ciclodextrina amorfa es desde aproximadamente 1:10 a aproximadamente 1:16.
28. Uso de acuerdo con una cualquiera de las reivindicaciones 24 a 27, donde la ciclodextrina amorfa es hidroxipropil-β-ciclodextrina.
29. Uso de acuerdo con la reivindicación 28, donde la relación en peso de cladribina a hidroxipropil-β-ciclodextrina es aproximadamente 1:14.
30. Uso de acuerdo con la reivindicación 28, donde la relación en peso de cladribina a hidroxipropil-β-ciclodextrina es aproximadamente 1:11.
31. Uso de acuerdo con una cualquiera de las reivindicaciones 24 a 27, donde la ciclodextrina amorfa es hidroxipropil-γ-ciclodextrina.
32. Uso de acuerdo con una cualquiera de las reivindicaciones 24 a 31, donde desde aproximadamente 30 a aproximadamente 40 por ciento en peso de la cladribina está en el complejo de inclusión (a) y desde aproximadamente 70 a aproximadamente 60 por ciento en peso de la cladribina está en el complejo de no inclusión (b).
33. Un complejo de cladribina-ciclodextrina compuesto que es una mezcla íntima amorfa de (a) un complejo de inclusión amorfo de cladribina con una ciclodextrina amorfa y (b) cladribina libre amorfa asociada con ciclodextrina amorfa como un complejo de no inclusión.
34. El complejo de acuerdo con la reivindicación 33, saturado de cladribina.
35. El complejo de acuerdo con la reivindicación 33 ó 34, donde la ciclodextrina amorfa es hidroxipropil-β-ciclodextrina, hidroxipropil-γ-ciclodextrina, β-ciclodextrina metilada al azar, carboximetil-β-ciclodextrina o sulfobutil-β-ciclodextrina.
36. El complejo de acuerdo con la reivindicación 33 ó 34, donde la ciclodextrina amorfa es hidroxipropil-β-ciclodextrina.
37. El complejo de acuerdo con la reivindicación 33 ó 34, donde la ciclodextrina amorfa es hidroxipropil-γ-ciclodextrina.
38. El complejo de acuerdo con una cualquiera de las reivindicaciones 33 a 35, donde la relación en peso de cladribina a ciclodextrina amorfa es desde aproximadamente 1:10 a aproximadamente 1:16.
39. El complejo de acuerdo con la reivindicación 38, donde la ciclodextrina amorfa es hidroxipropil-β-ciclodextrina.
40. El complejo de acuerdo con la reivindicación 39, donde la relación en peso de cladribina a hidroxipropil-β-ciclodextrina es aproximadamente 1:14.
41. El complejo de acuerdo con la reivindicación 39, donde la relación en peso de cladribina a hidroxipropil-β-ciclodextrina es aproximadamente 1:11.
42. El complejo de acuerdo con la reivindicación 38, donde la ciclodextrina amorfa es hidroxipropil-γ-ciclodextrina.
43. El complejo de acuerdo con una cualquiera de las reivindicaciones 33 a 42, donde desde aproximadamente 30 a aproximadamente 40 por ciento en peso de la cladribina está en el complejo de inclusión (a) y desde aproximadamente 70 a aproximadamente 60 por ciento en peso de la cladribina está en el complejo de no inclsuión (b).
44. Un procedimiento para la preparación de un complejo de cladribina-ciclodextrina compuesto que comprende las etapas de:
45. Un procedimiento de acuerdo con la reivindicación 44, que comprende además una etapa de filtración que sigue a la etapa (ii).
46. Un procedimiento de acuerdo con la reivindicación 44 ó 45, donde la etapa (i) se realiza a una temperatura de desde aproximadamente 45 a aproximadamente 60ºC.
47. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 44 a 46, donde la etapa (i) se realiza a una temperatura de desde aproximadamente 45 a aproximadamente 50ºC.
48. Un procedimiento de acuerdo con la reivindicación 46 ó 47, donde la etapa (i) se realiza con agitación.
49. Un procedimiento de acuerdo con la reivindicación 48, donde la etapa (i) se realiza durante un periodo de desde aproximadamente 6 a aproximadamente 9 horas.
50. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 44 a 49, donde la etapa (ii) se realiza durante un periodo de desde aproximadamente 6 a aproximadamente 9 horas.
51. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 44 a 50, donde la etapa (iii) comprende una etapa inicial de congelación en la que la disolución se enfría a desde aproximadamente -40 a aproximadamente -80ºC, y se mantiene a dicha temperatura durante un periodo de desde aproximadamente 2 a aproximadamente 4 horas.
52. Un procedimiento de acuerdo con la reivindicación 51, donde en la etapa inicial de congelación (iii) la disolución se enfría a aproximadamente -45ºC.
53. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 44 a 52, donde 12,00 partes en peso de cladribina y 172,50 partes en peso de hidroxipropil-β-ciclodextrina se introducen en la etapa (i).
54. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 44 a 52, donde 16,35 partes en peso de cladribina y 172,50 partes en peso de hidroxipropil-β-ciclodextrina se introducen en la etapa (i).
55. Un procedimiento de acuerdo con la reivindicación 53 ó 54, donde 825 partes en volumen de agua se introducen en la etapa (i).
56. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 44 a 55, donde la etapa de liofilización (iii) comprende:
57. Un procedimiento de acuerdo con la reivindicación 56, donde la etapa (a) de la liofilización se realiza a aproximadamente -45ºC durante aproximadamente 3 a 4 horas.
58. Un procedimiento de acuerdo con la reivindicación 56 ó 57, donde la etapa (b) de la liofilización se realiza bajo una presión de aproximadamente 13,3 Pa.
59. Una composición farmacéutica obtenible por un procedimiento que comprende las etapas de:
60. Una composición farmacéutica de acuerdo con la reivindicación 59, donde el procedimiento comprende además una etapa de filtración que sigue a la etapa (i) o (ii).
61. Una composición farmacéutica de acuerdo con la reivindicación 59 ó 60, donde la etapa (i) del procedimiento se realiza a una temperatura de desde aproximadamente 45 a aproximadamente 60ºC.
62. Una composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 59 a 61, donde la etapa (i) del procedimiento se realiza a una temperatura de desde aproximadamente 45 a aproximadamente 50ºC.
63. Una composición farmacéutica de acuerdo con la reivindicación 61 ó 62, donde la etapa (i) del procedimiento se realiza con agitación.
64. Una composición farmacéutica de acuerdo con la reivindicación 63, donde la etapa (i) del procedimiento se realiza durante una periodo de desde aproximadamente 6 a aproximadamente 9 horas.
65. Una composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 59 a 64, donde la etapa (ii) del procedimiento se realiza durante un periodo de desde aproximadamente 6 a aproximadamente 9 horas.
66. Una composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 59 a 65, donde la etapa (iii) comprende una fase inicial de congelación en la que la disolución se enfría a desde aproximadamente -40 a aproximadamente -80ºC, y se mantiene a dicha temperatura durante un periodo de desde aproximadamente 2 a aproximadamente 4 horas.
67. Una composición farmacéutica de acuerdo con la reivindicación 66, donde en la fase inicial de congelación de la etapa (iii) la disolución se enfría a aproximadamente -45ºC.
68. Una composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 59 a 67, donde 12,00 partes en peso de cladribina y 172,50 partes en peso de la hidroxipropil-β-ciclodextrina se introducen en la etapa (i) del procedimiento.
69. Una composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 59 a 67, donde 16,35 partes en peso de cladribina y 172,50 partes en peso de la hidroxipropil-β-ciclodextrina se introducen en la etapa (i) del procedimiento.
70. Una composición farmacéutica de acuerdo con la reivindicación 68 ó 69, donde 825 partes en volumen de agua se introducen en la etapa (i) del procedimiento.
71. Una composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 59 a 70, donde la etapa de liofilización (iii) del procedimiento comprende:
72. Una composición farmacéutica de acuerdo con la reivindicación 71, donde la fase (a) de la liofilización se realiza a aproximadamente -45ºC durante aproximadamente 3 a 4 horas.
73. Una composición farmacéutica de acuerdo con la reivindicación 71 ó 72, donde la fase (b) de la liofilización se realiza bajo una presión de aproximadamente 13,3 Pa.
74. Una composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 59 a 73, donde la etapa de formulación (iv) del procedimiento comprende mezclar el complejo con estearato de magnesio y comprimir en comprimidos.
75. Una composición farmacéutica de acuerdo con la reivindicación 74, donde se premezcla estearato de magnesio con sorbitol en polvo antes de mezclar con el complejo.
Patentes similares o relacionadas:
Derivativos del ácido siálico para la derivatización y conjugación de proteínas, del 20 de Diciembre de 2019, de LIPOXEN TECHNOLOGIES LIMITED: Un procedimiento de producción de un derivativo aldehído de un ácido siálico en el que un material de partida que tiene una unidad de ácido siálico en el […]
GELES DE QUITOSANO(A) CONTENIENDO NANOPARTICULAS METALICAS DE COBRE, PLATA Y ANTIBIOTICOS (CIPROFLOXACINO, CEFOTAXIME, GENTAMICINA Y CLOXACILINA), del 12 de Diciembre de 2019, de CARDENAS Y CIA LTDA: En la presente invención se describen geles de quitosano (poli-beta-glucosamina) con propiedades bactericidas y fungicidas en mezcla con nanopartículas […]
Compuestos de polímero de polialquileno y usos de los mismos, del 20 de Noviembre de 2019, de Biogen MA Inc: Una composición farmacéutica que comprende un conjugado y un vehículo, adyuvante, diluyente, conservante y/o solubilizante farmacéuticamente […]
Composiciones y métodos para la liberación dirigida de fármacos in vitro e in vivo a células de mamíferos mediante minicélulas intactas derivadas de bacterias, del 23 de Octubre de 2019, de ENGENEIC MOLECULAR DELIVERY PTY LTD: Una composición que comprende: (a) una pluralidad de minicélulas intactas derivadas de bacterias que tienen paredes celulares intactas, en donde la pluralidad […]
Moléculas con semividas prolongadas, composiciones y usos de las mismas, del 16 de Octubre de 2019, de MEDIMMUNE, LLC: Una molécula modificada que comprende una proteína o agente no de proteína y un dominio constante de IgG, en la que el dominio constante de IgG comprende un dominio CH3 humano […]
Método para la preparación de oligo etilenglicol monodisperso, del 19 de Junio de 2019, de NEKTAR THERAPEUTICS: Un método para preparar un oligo (etilenglicol) monodisperso, comprendiendo dicho método: (i) hacer reaccionar un oligo (etilenglicol) terminado […]
Construcciones de moléculas MHC y sus usos para el diagnóstico y terapia, del 29 de Mayo de 2019, de DAKO DENMARK A/S: Una construcción de moléculas MHC en forma soluble en un medio de solubilización o inmovilizada en un soporte sólido o semi-sólido, comprendiendo dicha construcción de moléculas […]
Usos terapéuticos de anticuerpos monoclonales frente al receptor de la angiotensina II tipo 1, del 17 de Mayo de 2019, de QUEEN MARY AND WESTFIELD COLLEGE: Un anticuerpo monoclonal o un fragmento del mismo que se une al péptido que consiste en la secuencia EDGIKRIQDD para su uso en el tratamiento de la proliferación […]