FORMULACIONES FARMACEUTICAS ESTABLES DE MONTELUKAST SODICO.
Composición farmacéutica estable en forma de comprimido recubierto de película,
que comprende montelukast o una sal del mismo y un excipiente farmacéuticamente aceptable seleccionado de entre por lo menos uno de entre diluyente, aglutinante, desintegrante, agente humectante, lubricante o deslizante, a condición de que el excipiente farmacéuticamente aceptable no sea la celulosa microcristalina, en la que la composición farmacéutica se prepara por compresión directa a partir de una mezcla seca
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06252449.
Solicitante: TEVA PHARMACEUTICAL INDUSTRIES LTD..
Nacionalidad solicitante: Israel.
Dirección: 5 BASEL STREET, P.O. BOX 3190,49131 PETAH TIQVA.
Inventor/es: TENENGAUZER, RUTH, HRAKOVSKY,JULIA, BOGOMOLNY,GRIGORY, DOLITSKY,YEHUDIT.
Fecha de Publicación: .
Fecha Solicitud PCT: 9 de Mayo de 2006.
Fecha Concesión Europea: 21 de Abril de 2010.
Clasificación Internacional de Patentes:
- A61K31/47 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Quinoleínas; Isoquinoleínas.
- A61K9/00M18B
- A61K9/20H4
- A61K9/20H4B
- A61K9/20H6B
- A61K9/20H6F2
- A61K9/20H6F4
- A61K9/28H4B
- A61K9/28H6F2
Clasificación PCT:
- A61K31/47 A61K 31/00 […] › Quinoleínas; Isoquinoleínas.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
- A61K9/28 A61K 9/00 […] › Grageas; Píldoras o comprimidos con revestimientos.
- A61P11/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 11/00 Medicamentos para el tratamiento de trastornos del aparato respiratorio. › Antiasmáticos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Formulaciones farmacéuticas estables de montelukast sódico.
Campo de la invención
La presente invención se refiere a composiciones farmacéuticas estables en forma de comprimido recubierto de película que comprenden montelukast o sales del mismo, y a procedimientos para prepararlas. Preferentemente, dicha sal es la sal sódica.
Antecedentes de la invención
Aparentemente, el montelukast es un antagonista selectivo, oralmente activo de los receptores de los leucotrienos que inhibe el receptor de los cisteinil leucotrienos CysLT1.
El nombre químico del montelukast sódico es sal monosódica del ácido [R-(E)]-1-[[[1-[3-[2-(7-cloro-2-quinolinil)etenil]fenil]-3-[2-(1-hidroxi-1-metiletil)fenil]propil]tio]metil]ciclopropanacético. Se entiende que la sal sódica de montelukast está representada por la siguiente fórmula estructural:
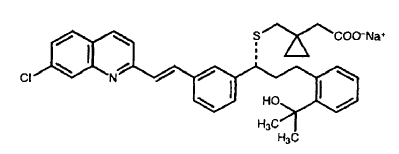
La patente US nº 5.565.473 está incluida en el FDA'S Orange Book para el montelukast sódico. La patente US nº 5.565.473 describe una amplia clase de antagonistas de los leucotrienos como ``agentes antiasmáticos, antialérgicos, antiinflamatorios y cicloprotectores representados por una fórmula química genérica. Patente US nº 5.565.473, col. 2, 1.3 a col. 4, 1.4. El montelukast se encuentra entre los muchos compuestos representados por dicha fórmula. La patente US nº 5.565.473 también se refiere a composiciones farmacéuticas de la clase de los antagonistas de los leucotrienos con esta fórmula con portadores farmacéuticamente aceptables. Id. en col. 10, II. 42-46.
El documento WO2003/074893 describe montelukast sódico amorfo y coprecipitados que lo contienen. Dicho documento también describe composiciones farmacéuticas que lo comprenden.
Actualmente, el montelukast sódico está comercializado por Merck en forma de comprimidos recubiertos de película y comprimidos masticables bajo el nombre comercial Singulair®. Los comprimidos recubiertos de película descritos contienen montelukast sódico y los ingredientes inactivos siguientes: celulosa microcristalina, lactosa monohidrato, croscarmelosa sódica, hidroxipropilcelulosa, estearato de magnesio, dióxido de titanio, óxido férrico rojo, óxido férrico amarillo y cera de carnauba. Los comprimidos masticables descritos contienen montelukast sódico y los ingredientes inactivos siguientes: manitol, celulosa microcristalina, hidroxipropilcelulosa, óxido férrico rojo, croscarmelosa sódica, aroma de cereza, aspartamo y estearato de magnesio. Physicians' Desk Reference, 59ª ed. (2005), p. 2141.
Sin embargo, existe una necesidad en la técnica de mejorar la estabilidad de las composiciones de montelukast, y particularmente de las de la sal sódica.
Sumario de la invención
Una forma de realización de la presente invención comprende una composición farmacéutica estable en forma de comprimido recubierto de película, que comprende montelukast o una sal del mismo y un excipiente farmacéuticamente aceptable seleccionado de entre por lo menos uno de entre diluente, aglutinante, desintegrante, agente humectante, lubricante o deslizante, a condición de que el excipiente farmacéuticamente aceptable no sea la celulosa microcristalina, en la que la composición farmacéutica se prepara por compresión directa a partir de una mezcla seca.
Preferentemente, dicha sal es el montelukast sódico.
En una forma de realización de la presente invención, la composición farmacéutica contiene montelukast sódico y también el correspondiente sulfóxido de montelukast de fórmula (I):
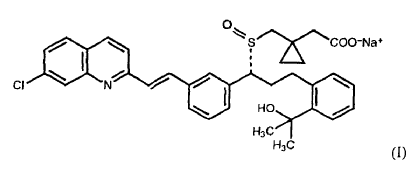
en el que el correspondiente sulfóxido de montelukast de fórmula (I) presente en la composición no aumenta más de 1% en peso con respecto a la cantidad inicial de montelukast tras el almacenamiento a aproximadamente 40ºC y una humedad relativa de aproximadamente 75% durante 3 meses.
Preferentemente, el contenido de sulfóxido no aumenta más de 0,5% en peso con respecto a la cantidad inicial de montelukast tras el almacenamiento a aproximadamente 40ºC y una humedad relativa de aproximadamente 75% durante 3 meses. Más preferentemente, el contenido de sulfóxido no aumenta más de 0,3% en peso con respecto a la cantidad inicial de montelukast tras el almacenamiento a aproximadamente 40ºC y una humedad relativa de aproximadamente 75% durante 3 meses. Todavía más preferentemente, el contenido de sulfóxido no aumenta más de 0,1% en peso con respecto a la cantidad inicial de montelukast tras el almacenamiento a aproximadamente 40ºC y una humedad relativa de aproximadamente 75% durante 3 meses.
En otra forma de realización de la presente invención, la composición farmacéutica comprende montelukast sódico.
En otra forma de realización de la presente invención, inmediatamente después de la preparación de la composición farmacéutica, el correspondiente sulfóxido está presente en una cantidad no superior a 0,2% en peso de montelukast.
Los comprimidos recubiertos de película pueden comprender la composición farmacéutica y un agente de recubrimiento, a condición de que dicho agente de recubrimiento no sea la celulosa microcristalina. Preferentemente, los comprimidos recubiertos de película comprenden montelukast sódico, lactosa monohidrato, hidroxipropilcelulosa, almidón, glicolato sódico de almidón, estearato de magnesio y un recubrimiento. El recubrimiento se puede preparar a partir de una mezcla en polvo comercializada para preparar suspensiones de recubrimiento, tal como Opadry®. Opadry®, disponible a través de Colorcon, contiene hidroxipropilcelulosa, hipromelosa, dióxido de titanio y óxido de hierro. Más preferentemente, el comprimido recubierto de película comprende aproximadamente un 5% en peso de montelukast sódico, aproximadamente un 62% en peso de lactosa, aproximadamente un 2% en peso de hidroxipropilcelulosa, aproximadamente un 18% en peso de almidón, aproximadamente un 9% en peso de glicolato sódico de almidón, aproximadamente un 1% en peso de estearato de magnesio y aproximadamente un 3% en peso de Opadry®. El experto en la materia apreciará que el recubrimiento se puede preparar a partir de los elementos constituyentes en lugar de a partir de la preparación premezclada y disponible comercialmente.
Descripción detallada
Las composiciones de montelukast están expuestas a degradación durante su preparación y almacenamiento. Se cree que el montelukast se degrada en su correspondiente sulfóxido. El sulfóxido es una impureza inactiva que reduce la dosis efectiva de montelukast cuando se administra a un paciente. La presente invención soluciona este problema proporcionando composiciones de montelukast estables a esta degradación.
Tal como se utiliza en la presente memoria, a menos que se defina de otro modo, el término "sulfóxido correspondiente" se refiere a montelukast o a una sal del mismo, en el que el grupo sulfuro en posición ß con respecto al grupo ciclopropano se ha oxidado a grupo sulfóxido, por ejemplo sulfóxido de fórmula (I), en el que la sal de montelukast es montelukast sódico y presenta la fórmula:
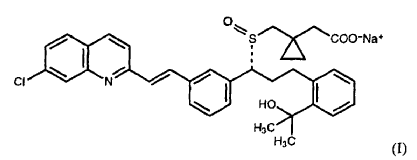
Tal como se utiliza en la presente memoria con respecto a composiciones farmacéuticas, a menos que se defina de otro modo, el término "estable" se refiere a que que la cantidad de sulfóxido correspondiente comprendido en el montelukast en la composición farmacéutica empaquetada no aumenta más de 1% en peso con respecto a la cantidad inicial de montelukast tras el almacenamiento a aproximadamente 40ºC y una humedad relativa de aproximadamente 75% durante 3 meses. Preferentemente, el contenido de sulfóxido correspondiente no aumenta más de 0,5% en peso con respecto a la cantidad inicial de montelukast tras el almacenamiento a aproximadamente 40ºC y una humedad relativa de aproximadamente 75% durante 3 meses. Más preferentemente, el contenido de sulfóxido correspondiente no aumenta más de 0,3% en peso con respecto a la cantidad inicial de montelukast tras el almacenamiento a aproximadamente 40ºC y una humedad relativa de aproximadamente 75% durante 3 meses. Todavía más preferentemente, el contenido de sulfóxido correspondiente no aumenta más de 0,1% en peso con respecto a la cantidad inicial de montelukast tras el almacenamiento...
Reivindicaciones:
1. Composición farmacéutica estable en forma de comprimido recubierto de película, que comprende montelukast o una sal del mismo y un excipiente farmacéuticamente aceptable seleccionado de entre por lo menos uno de entre diluyente, aglutinante, desintegrante, agente humectante, lubricante o deslizante, a condición de que el excipiente farmacéuticamente aceptable no sea la celulosa microcristalina, en la que la composición farmacéutica se prepara por compresión directa a partir de una mezcla seca.
2. Composición farmacéutica según la reivindicación 1, en la que la composición contiene el sulfóxido de montelukast correspondiente, en la que el sulfóxido de montelukast correspondiente en la composición no aumenta más de 1% en peso a partir de la cantidad inicial de montelukast tras el almacenamiento a aproximadamente 40ºC y una humedad relativa de aproximadamente 75% durante 3 meses.
3. Composición farmacéutica según la reivindicación 2, en la que la sal es el montelukast sódico y el sulfóxido correspondiente es el sulfóxido de fórmula (I):
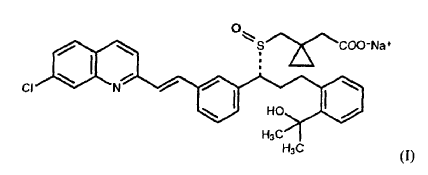
4. Composición farmacéutica según la reivindicación 2 ó 3, en la que la cantidad del sulfóxido de montelukast correspondiente no aumenta más de 0,5% en peso de la cantidad inicial de montelukast tras el almacenamiento a aproximadamente 40ºC y una humedad relativa de aproximadamente 75% durante 3 meses.
5. Composición farmacéutica según la reivindicación 4, en la que la cantidad del sulfóxido de montelukast correspondiente no aumenta más de 0,3% en peso de la cantidad inicial de montelukast tras el almacenamiento a aproximadamente 40ºC y una humedad relativa de aproximadamente 75% durante 3 meses.
6. Composición farmacéutica según la reivindicación 5, en la que la cantidad del sulfóxido de montelukast correspondiente no aumenta más de 0,1% en peso de la cantidad inicial de montelukast tras el almacenamiento a aproximadamente 40ºC y una humedad relativa de aproximadamente 75% durante 3 meses.
7. Composición farmacéutica en forma de comprimido recubierto de película que comprende montelukast o una sal del mismo y un excipiente farmacéuticamente aceptable, a condición de que el excipiente farmacéuticamente aceptable no sea la celulosa microcristalina, en la que el correspondiente sulfóxido de montelukast está presente en una cantidad no superior a 0,2% en peso de montelukast o una sal del mismo inmediatamente tras la preparación, en la que la composición farmacéutica se prepara por compresión directa a partir de una mezcla seca.
8. Composición farmacéutica según la reivindicación 7, en la que el sulfóxido correspondiente está presente en una cantidad no superior a 0,1% en peso de montelukast inmediatamente tras la preparación.
9. Composición farmacéutica según la reivindicación 7 u 8, en la que la sal es el montelukast sódico y el sulfóxido correspondiente es el sulfóxido de fórmula (I):

10. Composición farmacéutica según cualquiera de las reivindicaciones anteriores, en la que la composición comprende un agente humectante.
11. Composición farmacéutica según la reivindicación 10, en la que dicho agente humectante es el laurilsulfato de sodio.
12. Composición farmacéutica según cualquiera de las reivindicaciones 1 a 9, en la que el comprimido es un comprimido recubierto de película que comprende además un agente de recubrimiento, a condición de que dicho agente de recubrimiento no sea la celulosa microcristalina.
13. Composición farmacéutica según la reivindicación 12, que comprende montelukast sódico, lactosa monohidrato, hidroxipropilcelulosa, almidón, glicolato sódico de almidón y estearato de magnesio.
14. Composición farmacéutica según la reivindicación 13, en la que el montelukast sódico está presente en una cantidad de aproximadamente 5% en peso, la lactosa monohidrato está presente en una cantidad de aproximadamente 62% en peso, la hidroxipropilcelulosa está presente en una cantidad de aproximadamente 2% en peso, el almidón está presente en una cantidad de aproximadamente 18% en peso, el glicolato sódico de almidón está presente en una cantidad de aproximadamente 9% en peso, el estearato de magnesio está presente en una cantidad de aproximadamente 1% en peso, y el agente de recubrimiento está presente en una cantidad de aproximadamente 3% en peso.
15. Composición farmacéutica según la reivindicación 12, que comprende montelukast sódico, lactosa monohidrato, hidroxipropilcelulosa, almidón, laurilsulfato de sodio, glicolato sódico de almidón y estearato de magnesio.
16. Procedimiento para preparar una composición farmacéutica en forma de comprimido recubierto de película según cualquiera de las reivindicaciones anteriores, que comprende combinar montelukast o una sal farmacéuticamente aceptable del mismo con un excipiente farmacéuticamente aceptable seleccionado de entre por lo menos uno de entre diluyente, aglutinante, desintegrante, agente humectante, lubricante o deslizante, a condición de que el excipiente farmacéuticamente aceptable no sea la celulosa microcristalina.
17. Procedimiento según la reivindicación 16, en el que cada uno de los excipientes farmacéuticamente aceptables se somete primeramente a ensayo con el fin de evaluar su idoneidad en una composición farmacéutica estable de montelukast.
18. Procedimiento según la reivindicación 16 para preparar una composición farmacéutica según la reivindicación 15, que comprende mezclar montelukast sódico, lactosa monohidrato, hidroxipropilcelulosa, almidón, laurilsulfato de sodio, glicolato sódico de almidón y estearato de magnesio en un procedimiento de mezcla en seco, y comprimir los componentes mezclados en forma de comprimido.
Patentes similares o relacionadas:
Sal de sodio del inhibidor del transportador de ácido úrico y de su forma cristalina, del 1 de Julio de 2020, de Jiangsu Hengrui Medicine Co., Ltd: 1-((6-bromoquinolin-4-il)tio)ciclobutano-1-carboxilato de sodio de fórmula (I), **(Ver fórmula)**
Anticuerpo anti-Notch 4 humano, del 1 de Julio de 2020, de EISAI R&D MANAGEMENT CO., LTD: Un anticuerpo anti-Notch4 o un fragmento de unión a Notch4 de este, donde dicho anticuerpo o un fragmento de unión a Notch4 de este comprende cadenas pesadas y ligeras y […]
Compuestos de benzaldehído sustituidos y métodos para su uso en el aumento de la oxigenación tisular, del 27 de Mayo de 2020, de Global Blood Therapeutics, Inc: Un compuesto de Fórmula (I): **(Ver fórmula)** o un tautómero o una sal farmacéuticamente aceptable del mismo, para su uso en el tratamiento […]
Proteínas de unión a antígeno para proproteína convertasa subtilisina kexina tipo 9 (PCSK9), del 6 de Mayo de 2020, de AMGEN INC.: Una proteína de unión a antígeno, donde dicha proteína de unión a antígeno (i) comprende (a) un dominio variable de cadena ligera que comprende una secuencia […]
Composiciones congeladas fluidas que comprenden un agente terapéutico, del 8 de Abril de 2020, de Tavakoli, Zahra: Una composición fluida congelada que comprende un agente terapéutico y al menos un agente aromatizante para su uso en terapia, donde dicha composición […]
COMBINACIÓN FARMACÉUTICA SINÉRGICA DE UN ANTAGONISTA DE LOS RECEPTORES DE LEUCOTRIENOS Y UN AGONISTA INVERSO DE LA HISTAMINA H1, del 2 de Abril de 2020, de AMEZCUA AMEZCUA, Federico: La presente invención se refiere a una composición farmacéutica que comprende la combinación sinérgica de un antagonista de los receptores de […]
Moduladores de la ruta de hedgehog, del 1 de Abril de 2020, de NOVARTIS AG: Un compuesto que tiene la estructura seleccionada de: **(Ver fórmula)** en la que: L1 se selecciona de un enlace, -O-, -O(CR14R14)m-, -(CR14R14)mO- […]
Formulación compuesta, que comprende un comprimido esferoidal de múltiples unidades (MUST) encapsulado en una cápsula dura y un método para preparar el mismo, del 19 de Febrero de 2020, de HANMI PHARM. CO., LTD.: Una formulación compuesta de cápsula dura, que comprende dos o más principios farmacéuticamente activos, en donde cada principio farmacéuticamente […]