Uso de LH administrada en la fase folicular media o tardía para el tratamiento de mujeres anovulatorias.
El uso de LH y/o un análogo de la misma activa biológicamente en la producción de un medicamento para inducir paucifoliculogenesis o unifoliculogenesis en mujeres anovulatorias a una dosis diaria en el rango de 100 hasta 1500 IU,
donde el medicamento debe ser administrado iniciando la fase folicular media o tardía.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2000/001745.
Solicitante: MERCK SERONO SA.
Inventor/es: FRANKS,STEPHEN, HILLIER,STEPHEN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/24 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Hormona folículo-estimulante [FSH]; Gonadotropinas coriónicas, p. ej.: HCG; Hormona luteinizante [LH]; Hormona estimulante de la tiroides [TSH].
- A61P15/08 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 15/00 Medicamentos para el tratamiento de trastornos genitales o sexuales (para trastornos de las hormonas sexuales A61P 5/24 ); Anticonceptivos. › para los trastornos de las gónadas o para favorecer la fertilidad, p. ej. inductores de la ovulación o de la espermatogénesis.
PDF original: ES-2267531_T3.pdf
Fragmento de la descripción:
Uso de LH administrado en la fase folicular media o tardía para el tratamiento de mujeres anovulatorias.
La descripción se refiere al uso de gonadotrofinas en el tratamiento de mujeres anovulatorias. En particular se refiere al uso de hormona luteinizante (LH, por sus siglas en inglés) para promocionar el desarrollo folicular y especialmente el desarrollo paucifolicular y monofolicular cuando se induce ovulación en mujeres anovulatorias.
Las gonadotropinas se usan ampliamente en la clínica práctica para tratar mujeres con grupo II WHO y grupo I de WHO de anovulación (Informe Técnico 514 (1973) de la Organización Mundial de la Salud (WHO, por sus siglas en inglés) ) Convencionalmente, la foliculogénesis se induce administrando gonadotrofina humana menopáusica (hMG, por sus siglas en inglés) u hormona estimuladora de folículo humano urinario (u-hFSH, por sus siglas en inglés) con una dosis de 75 - 150 IU/día. Esta dosis se incrementa después de varios días (usualmente cinco) por pasos de 75 IU. Es raro excederse de 450 IU/día. Cuando hay por lo menos un folículo que tiene un diámetro promedio de por lo menos 18 mm y no más que dos folículos que tienen un diámetro promedio de por lo menos 16 mm, se administra una dosis alta (de 5000 IU por ejemplo) de hCG (gonadotrofina humana de corion) para inducir ovulación. Este protocolo convencional
ha sido usado con éxito por más de 20 años. Tiene sin embargo algunos riesgos, principalmente en pacientes con enfermedad ovárica poli-quística (PCOD, por sus siglas en inglés) . Estos riesgos incluyen la ocurrencia del síndrome de hiperestimulación ovárica (OHSS, por sus siglas en inglés) y una incidencia relativamente alta de múltiples embarazos (Schenker et al, Fertil. Esteril. 35:105-123 (1981) ) . Aunque la mayoría de embarazos múltiples son gemelos, la inducción de ovulación contribuye a un tercio de los nacimientos múltiples de alto rango en el Reino Unido (UK, por sus siglas en inglés) (Levene et al, Br. J. Obstet. Ginecol. 99:_607-613 (1992) ) .
Un monitoreo cuidadoso durante el tratamiento con ultrasonido (US) y evaluación de estradiol de suero (E2) han reducido estos riesgos pero no han podido prevenirlos en todos los pacientes. Estos problemas se refieren directamente a la dificultad de obtener el crecimiento de un folículo sencillo dominante que conduzca a un desarrollo multifolicular no fisiológico.
Durante los últimos 10 años se ha diseñado y probado un nuevo protocolo (el protocolo de dosis baja crónica
) para reducir aún más la incidencia de las complicaciones de la terapia de gonadotrofina (Seibel et al, Int. J. Fertil., 29: 338-339 (1984) ; Buvat et al, Fertil. Esteril., 52: 553-559 (1989) ; Hamilton-Fairley et al, Human Reprod 6: 1095-1099 (1991) ; Sagle et al, Fertil Esteril., 55: 56-60 (1991) ; Shoham et al, Fertil. Esteril., 55: 1051-1056 (1991) ; Meldrum, Fertil. Esteril., 55: 1039-1040 (1991) ) . Este protocolo inicia con una dosis baja de FSH o hMG (75 IU/día) y sin ajuste de dosis antes de siete o preferiblemente 14 días de tratamiento. Si se requiere un ajuste de dosis, éste se hace mediante pasos incrementales de solo 37, 5 IU. Adicionalmente cada incremento posterior se puede efectuar sólo después de siete días de tratamiento de una dosis dada. El concepto de este protocolo de dosis baja crónica es para encontrar la cantidad umbral de FSH necesaria para promover unifoliculogenesis. Hasta ahora se han publicado resultados alentadores que muestran que este enfoque reduce el número promedio de folículos preovulatorios, el nivel E2 preovulatorio promedio y el tamaño del ovario en la fase luteal media.
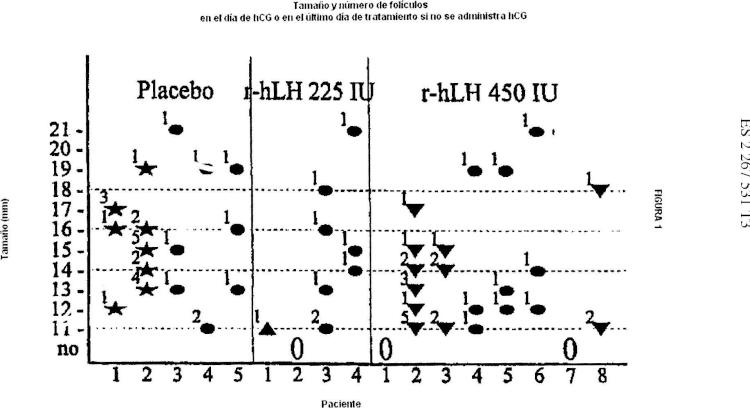
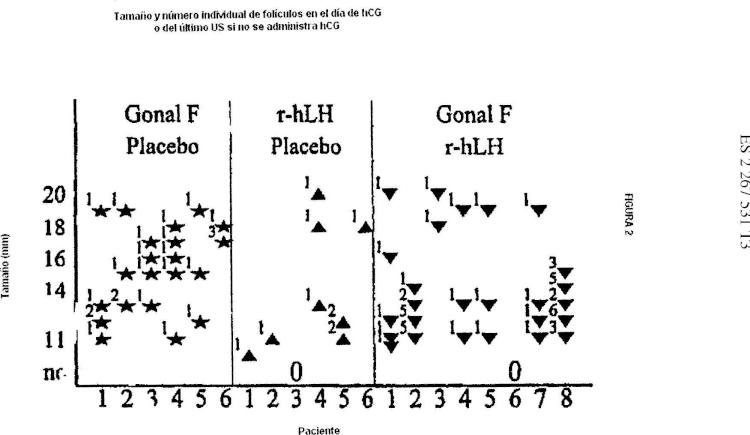
Sin embargo, a pesar del uso del protocolo de dosis baja crónica, algunos ciclos de tratamiento aún tienen que cancelarse debido a una respuesta desmedida (por ejemplo, cuando hay más de 3 folículos con un diámetro promedio de 16 mm o más) . Adicionalmente, la tasa de embarazo múltiple, aunque mejorada claramente si se compara con el protocolo convencional, es aún mayor que en los ciclos de concepción espontánea, es decir, 5 - 10% en ovulación inducida en oposición al 1, 5% en los ciclos espontáneos. Esto se debe a que el desarrollo de un folículo preovulatorio simple se obtiene en solo alrededor de dos tercios a tres cuartos de los ciclos inducidos y folículos que tienen un diámetro promedio de 15 mm o menos no se consideran usualmente al evaluar el número de folículos preovulatorios el día de la administración de hCG (Buvat et al, Fertil. Steril., 52:_553-559 (1989) ; Hamilton-Fairley et al, Human Reprod 6:1095-1099 (1991) ) . Sin embargo no es claro si los folículos con un diámetro promedio de 14 o 15 mm, o menos en el día de administración hCG ovulará y conducirá a la liberación de un oocito saludablemente fertilizable. De esa manera, sería deseable tener mejoramientos en el desarrollo folicular inducido por FSH en el cual se reducen las tasas de embarazos múltiples y de cancelación de ciclo.
El crecimiento de folículo de antro se induce mediante FSH. Continuamente a lo largo de la vida y hasta la menopausia algunos folículos entran a una fase de crecimiento que se interrumpe mediante regresión y atresia antes de alcanzar la etapa de plean madurez del estado preovulatorio (Hillier, Hum. Reprod., 9: 181-191 (1994) ) . Durante la fase de crecimiento se puede rescatar cualquier folículo de la atresia, siempre y cuando se exponga a una concentración suficiente de FSH. El nivel de FSH requerido para prevenir atresia y promover un crecimiento ulterior de un folículo se llama umbral de FSH
(Brown, Aus. NZ J. Obstet. Gynecol., 18: 47-55 (1987) . El nivel de umbral de FSH varía con el tiempo y en un punto de tiempo dado los folículos que en la actualidad estén en fase de crecimiento tienen diferentes niveles de umbral de FSH. Esta es la razón fundamental sobre la cual se basa el protocolo de dosis baja crónica
. Un incremento progresivo y cuidadoso en la dosis de FSH se usa para encontrar el nivel de umbral de un número mínimo de folículo y que, ojalá, logren mono-ovulación.
Se sabe que la hormona luteinizante (LH) también contribuye al fenómeno de dominancia de folículo y monoovulación. Realmente, aunque algo de LH es esencial para la síntesis de estrógeno durante la foliculogénesis, hay evidencia de que una exposición excesiva a LH detonará atresia folicular y suprimirá proliferación granulosa. De esta manera, los folículos que se desarrollan parecen tener requisitos finitos para estimulación por LH, más allá de lo cual cesa el desarrollo folicular. Este es el concepto de techo de LH
(Hillier, Hum. Reprod, 9: 181-191 (1994) ) . Se cree que en un determinado punto de tiempo los folículos que están actualmente en la fase de crecimiento tienen diferentes niveles de techo. Se sugiere que mientras más maduros están los folículos más resistentes son a la acción atrética de LH que los folículos menos maduros.
Se han reportado dos casos de anovulación de grupo I de la OMS, tratada ya sea por FSH sola o hMG usando un protocolo de aumento. (Glasier et al, Journal of Endocrinology, 119 A-159 (1988) ) . El ciclo de FSH solo
tenía un número mucho más grande de folículos maduros que el ciclo de hMG, soportando posiblemente un rol de LH en la atresia de folículos secundarios. Después fueron publicados dos estudios comparativos. En un primer estudio cruzado en 10 mujeres hipogonadotróficas hipogonadales se registro una diferencia impactante en términos de niveles E2 preovulatorios pero no se reportó conteo folicular (Couzinet et al, J. Clin. Endocrinol. Metab. 66: 552-556 (1988) ) .Un segundo estudio cruzado en 9 mujeres hipogonadotróficas hipogonadales reportó un número promedio de folículos que tienen un diámetro promedio de más de 16 mm en el día de la administración de hCG de 2.0 (0.7 en ciclos tratados con hMG y de 1.2 en ciclos tratados con FSH (Shoham et al, Fertil. Steril., 55: 1051-1056 (1991) ) . No hay información disponible sobre el número de folículos más pequeños.
Más recientemente se han publicado los resultados de administrar 150 IU de hFSH (FSH humana) y 75 IU de r-hLH (LH humana recombinante) a un solo paciente con concentraciones de FSH de suero, LH y oestradiol inmensurablemente bajas (Hall et al, The Lancet, 344 (8918) : 334-335 (1994) ) . La administración de r-hLH y hFSH causó que los niveles E2 aumentaran y se disminuyera el número total de folículos con diámetro de 10 mm o más, en comparación con la administración de hFSH sola. Sin embargo, el número de folículos grandes permaneció suficientemente... [Seguir leyendo]
Reivindicaciones:
1. El uso de LH y/o un análogo de la misma activa biológicamente en la producción de un medicamento para inducir paucifoliculogenesis o unifoliculogenesis en mujeres anovulatorias a una dosis diaria en el rango de 100 hasta 1500 IU, donde el medicamento debe ser administrado iniciando la fase folicular media o tardía.
2. El uso tal como se reivindica en la reivindicación 1, donde el medicamento se debe administrar cuando hay más de 3 folículos con un diámetro promedio en el rango de 8 a 13 mm y no más grandes.
3. El uso tal como se reivindica en la reivindicación 1 o reivindicación 2, donde la LH es r-hLH.
4. El uso tal como se reivindica en la reivindicación 1, 2 ó 3, donde la dosis diaria está en el rango desde 200 hasta 800 IU.
5. El uso tal como se reivindica en la reivindicación 4, donde la dosis diaria está en el rango desde 225 hasta 450 IU.
6. El uso tal como se reivindica en cualquiera de las reivindicaciones precedentes, donde FSH y/o un análogo biológicamente activo de la misma se usa en la producción del medicamento.
7. El uso tal como se reivindica en la reivindicación 6 donde la proporción de IU de LH con FSH está en el rango desde 1.5:1 hasta 20:1.
8. El uso tal como se reivindica en la reivindicación 7, donde la proporción está en el rango desde 1.5:1 hasta 10:1.
9. El uso tal como se reivindica en cualquiera de las reivindicaciones precedentes modificado en que LH y/o un análogo biológicamente activo de la misma se reemplaza por una dosis equivalente de hCG y/o un equivalente biológicamente activo de la misma.
Patentes similares o relacionadas:
Polipéptidos de acción prolongada y métodos para producir y administrar los mismos, del 13 de Mayo de 2020, de OPKO Biologics Ltd: Un polipeptido modificado con peptido carboxilo terminal (CTP) de gonadotropina corionica que comprende una hormona de crecimiento (GH), en donde un CTP se une al extremo […]
 Preparación farmacéutica que comprende HCG recombinante, del 25 de Marzo de 2020, de FERRING B.V.: Un método de producción de hCG recombinante (rhCG) que incluye sialilación a2,3 y a2,6, que comprende una etapa de producción o expresión de la rhCG […]
Preparación farmacéutica que comprende HCG recombinante, del 25 de Marzo de 2020, de FERRING B.V.: Un método de producción de hCG recombinante (rhCG) que incluye sialilación a2,3 y a2,6, que comprende una etapa de producción o expresión de la rhCG […]
FSH para el tratamiento de la infertilidad, del 12 de Febrero de 2020, de FERRING BV: Una composición para su uso en el tratamiento de la infertilidad, comprendiendo la composición de > 12 a 24 μg de hormona estimuladora […]
Hormona estimulante del folículo humana recombinante mejorada, del 18 de Diciembre de 2019, de GLYCOTOPE GMBH: Una preparación de FSH recombinante, en donde la FSH recombinante en la preparación tiene un patrón de glicosilación que comprende las siguientes características: […]
Polipéptidos de acción prolongada y métodos para producirlos y administrarlos, del 4 de Diciembre de 2019, de OPKO Biologics Ltd: Un polipéptido que comprende una actividad biológica, dicho polipéptido comprende un péptido de interés, un solo péptido carboxilo terminal (CTP) de gonadotropina coriónica unido […]
HORMONA FOLÍCULO ESTIMULANTE BOVINA RECOMBINANTE, COMPOSICIÓN QUE LA COMPRENDE Y MÉTODO PARA INDUCIR SUPEROVULACIÓN Y SINCRONIZACIÓN DEL CELO EN BOVINOS UTILIZANDO DICHA HORMONA, del 21 de Noviembre de 2019, de CENTRO DE BIOTECNOLOGÍA Y BIOMEDICINA SPA: La presente invención se relaciona con el campo técnico de la Biotecnología y la obtención de moléculas por vía recombinante, en particular se refiere […]
Sistema terapéutico transdérmico para la administración de péptidos, del 18 de Septiembre de 2019, de LTS LOHMANN THERAPIE-SYSTEME AG: Uso de al menos un péptido para la producción de un sistema terapéutico transdérmico (STT), que comprende una capa trasera, que está equipada con una capa […]
Combinación unitaria de FSH y hCG, del 7 de Agosto de 2019, de FERRING B.V.: Producto inyectable que comprende composiciones farmacéuticas que contienen FSH y hCG adecuadas para su administración de manera separada o conjunta, en el que la cantidad de […]