Terapia específica usando ligandos de integrinas para el tratamiento del cáncer.
Uso de al menos un ligando específico de integrinas, que comprende ciclo-(Arg-Gly-Asp-DPhe-NMeVal),
los solvatos y/o sales farmacéuticamente aceptables del mismo, para la fabricación de un medicamento para el tratamiento del cáncer, en donde el medicamento se usa en combinación con radiación de haz externo, en donde al menos el ligando de integrinas específico ciclo-(Arg-Gly-Asp-DPhe-NMeVal), los solvatos y/o sales farmacéuticamente aceptables del mismo se administra de 1 a 10 horas (h) antes de la aplicación de la radiación de haz externo.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E10015608.
Solicitante: MERCK PATENT GMBH.
Nacionalidad solicitante: Alemania.
Dirección: FRANKFURTER STRASSE 250 64293 DARMSTADT ALEMANIA.
Inventor/es: GOODMAN, SIMON, GRELL,MATTHIAS, HARSTRICK,ANDREAS, PICARD,MARTIN ANDREAS, NIPPGEN,JOHANNES, GRIMM,ULRIKE, STUPP,ROGER, MIKKELSEN,TOM, WELLER,MICHAEL PROF. DR.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/4188 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensados con heterocidos, p. ej. biotina, sorbinil.
- A61K38/08 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Péptidos que tienen de 5 a 11 aminoácidos.
- A61K41/00 A61K […] › Preparaciones medicinales obtenidas por tratamiento de sustancias mediante energía ondulatoria o por radiación corpuscular.
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
PDF original: ES-2521679_T3.pdf
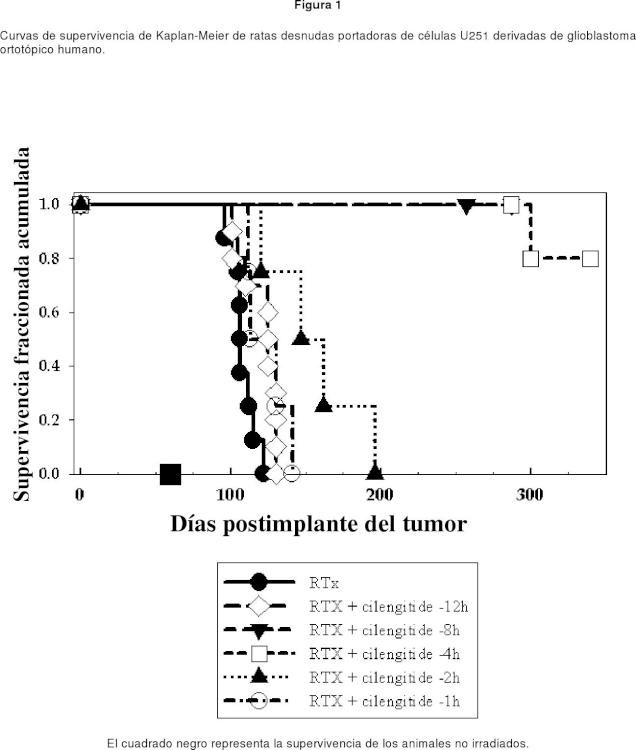
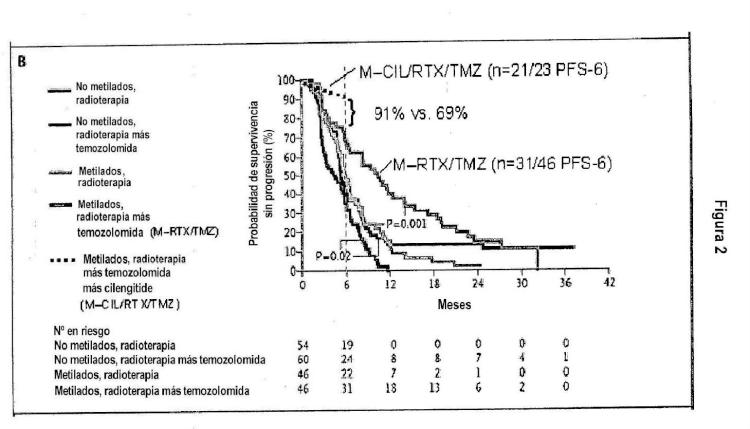
Fragmento de la descripción:
Terapia específica usando ligandos de integrinas para el tratamiento del cáncer Ámbito técnico de la invención:
La presente invención hace referencia a una forma de terapia específica para el tratamiento de tumores y metástasis tumorales que comprende al menos un ligando de integrina seleccionado entre ciclo-(Arg-Gly-Asp- DPhe-NMeVal), y los solvatos y/o sales farmacéuticamente aceptables del mismo, junto con la eficacia sinérgica de la radioterapia mediante haces externos, cuando se administra junto con dicho ligando de integrina de forma controlada en el tiempo. La terapia tendrá como consecuencia un posible aumento sinérgico del efecto de inhibición de cada fármaco individual sobre la proliferación de células tumorales y células endoteliales tumorales, produciendo un tratamiento más eficaz que el obtenido mediante la administración de un componente individual solo, combinado o en otro régimen terapéutico, excepto el régimen de la presente invención.
Antecedentes de la invención:
Se sabe que las células endoteliales vasculares contienen al menos tres integrinas dependientes de RGD, entre las que se incluyen los receptores de vitronectina av(33 o avps, así como los receptores de colágeno de tipos I y IV avpi y a2Pi, los receptores de laminina a6Pi y a3Pi y el receptor de fibronectina a5pi (Davis y col., 1993, J. Cell. Biochem. 51, 206). Se sabe que las células del músculo liso contienen al menos seis integrinas dependientes de RGD, que incluyen avp3 y avps.
La inhibición de la adhesión celular in vitro con anticuerpos monoclonales inmunoespecíficos para diversas subunidades a o p de las integrinas ha implicado al receptor de vitronectina avp3 en procesos de adhesión celular de diversos tipos celulares como las células endoteliales microvasculares (Davis y col., 1993, J. Cell. Biol. 51, 206).
Las integrinas son una clase de receptores celulares conocidos por unirse a las proteínas de la matriz extracelular y mediar en las interacciones célula-célula y célula-matriz extracelular, denominadas en general acontecimientos de adhesión celular. Los receptores de integrinas constituyen una familia de proteínas con características estructurales compartidas de complejos glucoproteicos heterodiméricos no covalentemente asociados, formados por subunidades a y p. El receptor de vitronectina, cuyo nombre se debe a su característica original de unión preferente a vitronectina, ahora se sabe que hace referencia a cuatro integrinas distintas denominadas avpi, avp3, avps y avps. La integrina avpi se une a fibronectina y a vitronectina, avp3 se une a una gran variedad de ligandos, como fibrina, fibrinógeno, laminina, trombospondina, vitronectina y factor de von Willebrand y avps se une a vitronectina. Es evidente que existen diferentes integrinas con diferentes funciones biológicas, así como diferentes integrinas y subunidades con especificidad y función biológicas compartidas. Un sitio de reconocimiento importante en un ligando para muchas integrinas es la secuencia tripeptídica Arg-Gly-Asp (RGD). RGD se encuentra en todos los ligandos identificados anteriormente para las integrinas receptoras de vitronectina. Se ha identificado la base molecular del reconocimiento de RGD por avp3 (Xiong y col., 2001). Este sitio de reconocimiento RGD se puede mimetizar mediante (poli)péptidos lineales y cíclicos que contengan la secuencia RGD. Estos péptidos RGD son conocidos como inhibidores o antagonistas, respectivamente, de la función integrina. Es importante destacar, sin embargo, que dependiendo de la secuencia y estructura del péptido RGD, la especificidad de la inhibición puede verse alterada para dirigirse a integrinas específicas. Se han descrito diversos polipéptidos con RGD con distinta especificidad por integrinas, por ejemplo, en Cheresh, y col., 1989, Cell 58, 945, Aumailley y col., 1991, FEBS Letts. 291, 50, y en numerosas solicitudes de patente y en patentes (por ejemplo, las patentes de EE. UU. 4.517.686, 4.578.079, 4.589.881, 4.614.517, 4.661.111, 4.792.525 y el documento EP 0770 622). La generación de nuevos vasos sanguíneos, o angiogénesis, tiene un papel fundamental en el crecimiento de enfermedades malignas, y este hecho ha generado mucho interés en el desarrollo de fármacos que inhiben la angiogénesis.
No obstante, aunque diversas politerapias que utilizan posibles inhibidores de la angiogénesis están en investigación, en ensayos clínicos y en el mercado, el resultado de estas terapias no es lo suficientemente fructífero. Por tanto, continúa existiendo la necesidad en la técnica de desarrollar más combinaciones que puedan demostrar mayor eficacia y menos efectos secundarios.
Hoy en día se sabe que la vasculatura tumoral es diferente de la vasculatura del tejido sano. La vasculatura es característica del tumor y distinta a la vasculatura estable y latente del tejido sano. A menudo se caracteriza por un aumento en la expresión y sensibilización de moléculas de adhesión celular específicas de la serie de integrinas alfa-v, especialmente avp3 y avps. Cuando estas integrinas se activan potencian la respuesta celular a los factores de crecimiento que dirigen la angiogénesis, por ejemplo, VEGFA y FGF2: VEGFA se denominó originalmente factor de permeabilidad vascular y actúa a través de la ruta de la SRC quinasa aumentando la permeabilidad vascular local. VEGRF2, cuando se activa, aumenta la actividad de la integrina avp3.
Adicionalmente, los tumores sólidos dependen de una vasculatura inducida y confinada del huésped para desarrollarse. Esta vasculatura tiene propiedades moleculares inusuales que la distinguen de la vasculatura normal del huésped: tiende a activarse, es decir, a progresar a lo largo del ciclo celular bajo la influencia de factores derivados del tumor, como los VEGF, los FGF y otros factores, y expresa marcadores de activación endotelial como 5 ICAM, VCAM e integrinas de las series alfa-v, por ejemplo, avp3 y avps, en un estado competente del ligando. Tiene una matriz extracelular defectuosa y se describe habitualmente como agujereada. Es de destacar que los tumores a menudo resisten a terapias aplicadas sistémicamente a través del torrente sanguíneo, debido a la naturaleza anómala de la vasculatura tumoral.
El proceso metastásico es un acontecimiento en varias etapas y representa el aspecto más atroz del cáncer. En el 10 momento del diagnóstico, los cánceres están con frecuencia bastante avanzados en su evolución natural y la presencia de metástasis es un acontecimiento común. De hecho, aproximadamente el 30% de los pacientes presenta metástasis detectables en el momento del diagnóstico clínico y otro 30% de los pacientes tiene metástasis ocultas. Las metástasis pueden diseminarse y pueden invadir diferentes órganos al mismo tiempo, o localizarse en un órgano específico. En el caso de enfermedad localizada, el tratamiento de elección es la cirugía; sin embargo, la 15 recurrencia y el pronóstico dependen de muchos criterios como: capacidad de resección, situación clínica del paciente y número de metástasis.
Tras la resección, es frecuente la recurrencia, lo que sugiere que los focos micrometastásicos están presentes en el momento del diagnóstico. La quimioterapia sistémica es un marco ideal pero solo algunos pacientes se curan gracias a ella, fracasando en la mayoría de casos. Muchas barreras fisiológicas y parámetros farmacocinéticos 20 contribuyen a disminuir su eficacia.
El hígado, los pulmones y los ganglios linfáticos son órganos de filtración y, por tanto, predispuestos a la metastatización. La escasa qulmlosensibilidad de las metástasis, especialmente las de origen colorrectal, ha inducido a muchos investigadores a utilizar métodos para aumentar el tiempo y la concentración de fármacos. La necesidad de disminuir o limitar los efectos secundarios para este órgano Importante y delicado ha llevado al 25 desarrollo de la técnica de aislamiento del hígado para la perfusión de agentes antlneoplásicos. (K. R. Aigner, Isolated liver perfusión. En: Morris DL, McArdle CS, Onlk GM, eds. Hepatlc Metastases. Oxford: Butterworth Heinemann, 1996. 101-107). Desde 1981, se han introducido continuamente modificaciones y mejoras técnicas. Las metástasis hepáticas pueden ser de diferente origen y su qulmlosensibilidad puede variar según el tipo histológico y su respuesta en presencia de calor.
Sigue existiendo en la técnica una necesidad creciente de desarrollar nuevas estrategias terapéuticas para el tratamiento sistémico del cáncer, especialmente las metástasis. Por tanto, el objeto de la presente invención era desarrollar esta nueva estrategia. Debería ser aplicable al tratamiento sistémico y debería reducirse la dosis y/o aumentar la eficacia de los agentes terapéuticos antineoplásicos... [Seguir leyendo]
Reivindicaciones:
1. Uso de al menos un ligando específico de integrinas, que comprende ciclo-(Arg-Gly-Asp-DPhe-NMeVal), los solvatos y/o sales farmacéuticamente aceptables del mismo, para la fabricación de un medicamento para el tratamiento del cáncer, en donde el medicamento se usa en combinación con radiación de haz externo, en donde al menos el ligando de integrinas específico ciclo-(Arg-Gly-Asp-DPhe-NMeVal), los solvatos y/o sales farmacéuticamente aceptables del mismo se administra de 1 a 10 horas (h) antes de la aplicación de la radiación de haz externo.
2. Uso según la reivindicación 1, en donde ciclo-(Arg-Gly-Asp-DPhe-NMeVal) se administra a un paciente en una
cantidad de aproximadamente 1000 mg a la semana, aproximadamente 1500 mg a la semana,
aproximadamente 2500 mg a la semana, aproximadamente 4000 mg a la semana o aproximadamente 6000 mg a la semana.
3. Uso según la reivindicación 2, en donde la cantidad de aproximadamente 1000 mg a la semana o
aproximadamente 4000 mg a la semana se administra en un programa de administración de dos veces a la
semana, y la cantidad de aproximadamente 1500 mg a la semana o aproximadamente 6000 mg a la semana se administra en un programa de administración de tres veces a la semana.
4. Uso según la reivindicación 2 o 3, en donde la cantidad de aproximadamente 1000 mg por semana se administra en un programa de administración de dos veces en semana que consiste en aproximadamente 500 mg por administración, o la cantidad de aproximadamente 4000 mg por semana se administra en un programa de administración de dos veces en semana de aproximadamente 2000 mg por administración.
5. Uso según una de las reivindicaciones de la 2 a la 4, en donde al menos el ligando de integrinas ciclo-(Arg- Gly-Asp-DPhe-NMeVal), los solvatos y/o sales farmacéuticamente aceptables del mismo se administra de 2 a 10 h, preferiblemente de 3 a 10 h y especialmente de 2 a 8 h antes de la aplicación de la radiación de haz externo.
6. Uso según una de las reivindicaciones de la 2 a la 4, en donde al menos el ligando específico de integrinas ciclo-(Arg-Gly-Asp-DPhe-NMeVal), los solvatos y/o sales farmacéuticamente aceptables del mismo se administra se administra de 1 a 10 horas (h), preferiblemente de 1 a 6, más preferiblemente de 2 a 8, incluso más preferiblemente de 3 a 8 h, incluso más preferiblemente de 3 a 6 y especialmente de 4 a 8 h antes de la aplicación de la radiación de haz externo.
7. Uso según una de las reivindicaciones de la 1 a la 6, en donde el cáncer se selecciona de cáncer intracerebral, cáncer de cabeza y cuello, cáncer rectal, cáncer de pulmón microcítico, cáncer de pulmón no microcítico, gliobastoma multiforme, cáncer de pulmón microcítico, cáncer de pulmón no microcítico, cáncer de mama, melanoma metastásico, cáncer de próstata no dependiente de andrógenos metastásico, cáncer de próstata dependiente de andrógenos metastásico, y metástasis cerebrales de los mismos.
8. Uso según una de las reivindicaciones de la 1 a la 7, en donde se aplica al menos un agente antineoplásico coterapéutico distinto de la radioterapia, preferiblemente seleccionado de agentes quimioterapéuticos, agentes citotóxicos y/o agentes inmunotóxicos, más preferiblemente seleccionado de Temozolomida, Cisplatino, Oxaliplatino, Carboplatino, 5-FU, Dacarbazina, Procarbazina, Vinblastina, Vincristina, Irinotecán, Taxol, Paclitaxel, Docetaxel, Gemcitabina, Gleevec, Iressa, Tarceva y Nexavar, Herceptin, Bevacizumab, Cetuximab, Nimotuzumab, Sorafenib, Sunitinib y ZD6474 (ZACTIMA), e incluso más preferiblemente seleccionado de Temozolomida, Cisplatino, Oxaliplatino, Vinblastina, Taxol, Gemcitabina, Gleevec e Iressa.
9. Uso según una de las reivindicaciones de la 1 a la 8, en donde adicionalmente se aplica un agente antineoplásico coterapéutico adicional, preferiblemente seleccionado de agentes quimioterapéuticos, agentes citotóxicos y/o agentes inmunotóxicos, más preferiblemente seleccionado de Temozolomida, Cisplatino, Oxaliplatino, Carboplatino, 5-FU, Dacarbazina, Procarbazina, Vinblastina, Vincristina, Irinotecán, Taxol, Paclitaxel, Docetaxel, Gemcitabina, Gleevec, Iressa, Tarceva y Nexavar, Herceptin, Bevacizumab, Cetuximab, Nimotuzumab, Sorafenib, Sunitinib y ZD6474 (ZACTIMA), e incluso más preferiblemente seleccionado de Temozolomida, Cisplatino, Oxaliplatino, Vinblastina, Taxol, Gemcitabina, Gleevec e Iressa.
10. Uso según una de las reivindicaciones de la 1 a la 9, en donde el medicamento se utiliza en el tratamiento de pacientes que presentan un estado de metilación aumentada del ADN.
11. Uso según una de las reivindicaciones de la 1 a la 10, en donde el medicamento se utiliza en el tratamiento de pacientes que muestran metilación parcial o completa de al menos un promotor de al menos un gen de MGMT.
12. Uso según una de las reivindicaciones de la 1 a la 11, en donde el medicamento se utiliza en el tratamiento de cáncer recién diagnosticado, preferiblemente en el ámbito de un tratamiento de primera línea.
13. Ciclo-(Arg-Gly-Asp-DPhe-NMeVal) y/o los solvatos y/o sales farmacéuticamente aceptables del mismo para su uso en el tratamiento del cáncer en combinación con radiación de haz externo, en donde el ciclo-(Arg-Gly-Asp- DPhe-NMeVal), los solvatos y/o las sales farmacéuticamente aceptables del mismo se administrade 1 a 10 horas (h) antes de la aplicación de la radiación de haz externo.
14. Ciclo-(Arg-Gly-Asp-DPhe-NMeVal) y/o los solvatos y/o sales farmacéuticamente aceptables del mismo para su uso según la reivindicación 13, en donde el cáncer es astrocitoma, gliobastoma o gliobastoma multiforme.
15. Ciclo-(Arg-Gly-Asp-DPhe-NMeVal) y/o los solvatos y/o sales farmacéuticamente aceptables del mismo para su uso según la reivindicación 13 y/o 14, en donde la radiación de haz externo es radiación de haz externo fraccionada.
16. Ciclo-(Arg-Gly-Asp-DPhe-NMeVal) y/o los solvatos y/o sales farmacéuticamente aceptables del mismo para su uso según una o más de las reivindicaciones de la 13 a la 15, en donde se aplica al menos un agente antineoplásico coterapéutico distinto de la radioterapia, preferiblemente seleccionado de agentes quimioterapéuticos, agentes citotóxicos y/o agentes inmunotóxicos, más preferiblemente seleccionado de Temozolomida, Cisplatino, Oxaliplatino, Carboplatino, 5-FU, Dacarbazina, Procarbazina, Vinblastina, Vincristina, Irinotecán, Taxol, Paclitaxel, Docetaxel, Gemcitabina, Gleevec, Iressa, Tarceva y Nexavar, Herceptin, Bevacizumab, Cetuximab, Nimotuzumab, Sorafenib, Sunitinib y ZD6474 (ZACTIMA), e incluso más preferiblemente seleccionado de Temozolomida, Cisplatino, Oxaliplatino, Vinblastina, Taxol, Gemcitabina, Gleevec e Iressa.
17. Ciclo-(Arg-Gly-Asp-DPhe-NMeVal) y/o los solvatos y/o sales farmacéuticamente aceptables del mismo para su uso según una o más de las reivindicaciones de la 13 a la 16, en donde adicionalmente se aplica un agente antineoplásico coterapéutico adicional, preferiblemente seleccionado de agentes quimioterapéuticos, agentes citotóxicos y/o agentes inmunotóxicos, más preferiblemente seleccionado de Temozolomida, Cisplatino, Oxaliplatino, Carboplatino, 5-FU, Dacarbazina, Procarbazina, Vinblastina, Vincristina, Irinotecán, Taxol, Paclitaxel, Docetaxel, Gemcitabina, Gleevec, Iressa, Tarceva y Nexavar, Herceptin, Bevacizumab, Cetuximab, Nimotuzumab, Sorafenib, Sunitinib y ZD6474 (ZACTIMA), e incluso más preferiblemente seleccionado de Temozolomida, Cisplatino, Oxaliplatino, Vinblastina, Taxol, Gemcitabina, Gleevec e Iressa.
18. Ciclo-(Arg-Gly-Asp-DPhe-NMeVal) y/o los solvatos y/o sales farmacéuticamente aceptables del mismo para su uso según la reivindicación 16 o 17, en donde el, al menos uno, agente antineoplásico coterapéutico distinto de la radiación de haz externo se aplica de manera sustancialmente concurrente o secuencial a la radiación de haz externo.
19. Ciclo-(Arg-Gly-Asp-DPhe-NMeVal) y/o los solvatos y/o sales farmacéuticamente aceptables del mismo para su uso según una o más de las reivindicaciones de la 13 a la 17, en donde dicho ciclo-(Arg-Gly-Asp-DPhe- NMeVal) se administra de 1 a 8 horas (h) antes de la aplicación de la radiación de haz externo.
20. Ciclo-(Arg-Gly-Asp-DPhe-NMeVal) y/o los solvatos y/o sales farmacéuticamente aceptables del mismo para su uso según una o más de las reivindicaciones de la 13 a la 18, en donde dicho ciclo-(Arg-Gly-Asp-DPhe- NMeVal) se administra de 2 a 6 horas antes de la aplicación de la radiación de haz externo.
21. Ciclo-(Arg-Gly-Asp-DPhe-NMeVal) y/o los solvatos y/o sales farmacéuticamente aceptables del mismo para su uso según una o más de las reivindicaciones de la 13 a la 19, en donde ciclo-(Arg-Gly-Asp-DPhe-NMeVal) se administra a un paciente en una cantidad de aproximadamente 1000 mg por semana, aproximadamente 1500 mg por semana, aproximadamente 2500 mg por semana, aproximadamente 4000 mg por semana o aproximadamente 6000 mg por semana.
22. Ciclo-(Arg-Gly-Asp-DPhe-NMeVal) y/o los solvatos y/o sales farmacéuticamente aceptables del mismo para su uso según la reivindicación 20, en donde la cantidad de aproximadamente 1000 mg por semana o de aproximadamente 4000 mg por semana se administra en un programa de administración de dos veces a la semana, y la cantidad de aproximadamente 1500 mg por semana o aproximadamente 6000 mg por semana se administra en un programa de administración de tres veces a la semana.
23. Ciclo-(Arg-Gly-Asp-DPhe-NMeVal) y/o los solvatos y/o sales farmacéuticamente aceptables del mismo para su uso según la reivindicación 20 o 21, en donde la cantidad de aproximadamente 1000 mg por semana se administra en un programa de administración de dos veces a la semana que consiste en aproximadamente
500 mg por administración, o la cantidad de aproximadamente 4000 mg por semana se administra en un programa de administración de dos veces a la semana de aproximadamente 2000 mg por administración.
24. Ciclo-(Arg-Gly-Asp-DPhe-NMeVal) y/o los solvatos y/o sales farmacéuticamente aceptables del mismo para su uso según una o más de las reivindicaciones de la 13 o 23, en donde el cáncer se selecciona de cáncer 5 intracerebral, cáncer de cabeza y cuello, cáncer rectal, cáncer de pulmón microcítico, cáncer de pulmón no
microcítlco, gliobastoma multiforme, cáncer de pulmón microcítico, cáncer de pulmón no microcítico, cáncer de mama, melanoma metastásico, cáncer de próstata no dependiente de andrógenos metastásico, cáncer de próstata dependiente de andrógenos metastásico, y metástasis cerebrales de los mismos.
Patentes similares o relacionadas:
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]