Procedimiento de preparación de tejidos biológicos para prótesis biológicas.
Procedimiento de tratamiento de un tejido biológico para prótesis biológicas,
comprendiendo dicho procedimiento las etapas:
-fijación del tejido biológico mediante un tratamiento con una solución de fijación que contiene glutaral- dehído;
-eliminación de los fosfolípidos procedentes del tejido biológico mediante un tratamiento con una solución de eliminación que contiene 1,2-octanodiol y etanol;
-desintoxicación mediante un tratamiento con una solución desintoxicante que contiene taurina o ácido homocistéico a una temperatura por encima de la temperatura ambiente, preferiblemente por encima de 30ºC, en el que la etapa de eliminación de los fosfolípidos se lleva a cabo antes de dicha etapa de fijación.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E11167695.
Solicitante: Sorin Group Italia S.r.l.
Nacionalidad solicitante: Italia.
Dirección: Via Crescentino sn 13040 Saluggia (VC) ITALIA.
Inventor/es: ROLANDO, GIOVANNI, STRASLY,MARINA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61L27/36 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › que contienen ingredientes de composición indeterminada o sus productos de reacción.
PDF original: ES-2547875_T3.pdf
Fragmento de la descripción:
Procedimiento de preparación de tejidos biológicos para prótesis biológicas Campo de la invención
La presente descripción se refiere a un procedimiento para la preparación de un tejido biológico para prótesis biológicas, tal como, por ejemplo, válvulas protésicas, preferiblemente válvulas cardíacas protésicas.
Antecedente técnico
Las prótesis biológicas son dispositivos médicos, cuya realización se basa en el uso de tejidos animales procedentes de diversas especies, por ejemplo, bovina, porcina, ovina o equina. Dependiendo de los diversos usos médicos, el tejido biológico puede comprender válvulas cardíacas, pericardio, tendones, ligamentos dura mater, piel, venas, etc.
Los tejidos destinados a la realización de prótesis biológicas están constituidos fundamentalmente de colágeno, una proteína con una unidad estructural representada por tres cadenas polipéptidas que se asocian para formar una triple hélice. Las moléculas de colágeno se unen para formar microfibrillas, las cuales, a su vez, se unen para formar fibrillas que, dispuestas en haces corrugados o paralelos, dan lugar a verdaderas fibras de colágeno. Dichos tejidos tienen buena resistencia a la tracción, son flexibles, pero substancialmente ¡nextensibles.
Los tejidos destinados para la realización de prótesis biológicas son sometidos, en primer lugar, a numerosos lavados para eliminar trazas de sangre y una cuidadosa eliminación de grasa y ligamentos. No obstante, las células o restos celulares procedentes del animal donante pueden permanecer retenidas en la estructura del propio tejido. Por ello, en este caso, es posible que el sistema inmune del huésped dé lugar a un fenómeno de rechazo que puede conducir a la destrucción del tejido que constituye la prótesis biológica.
La degradación del tejido biológico colagenoso una vez implantado en el organismo del huésped es un problema adicional con cara a la realización de prótesis biológicas. Por esta razón, los tejidos biológicos son sometidos a un tratamiento de fijación que tiene el objeto de proteger el tejido de dichos fenómenos de degradación y contribuir a prevenir el fenómeno de rechazo anteriormente mencionado.
Entre las substancias usadas para la fijación de tejidos biológicos, la más común es el glutaraldehído. Esta molécula bifuncional, que porta dos grupos aldehido, es capaz de unir conjuntamente de manera estable los grupos amino libres de los aminoácidos que constituyen las cadenas polipéptidas, tanto de dentro de una molécula de colágeno como de entre moléculas de colágeno adyacentes. De esta manera, el glutaraldehído forma estructuras puente intra- cadena e Ínter-cadena, dando lugar a la reticulación del tejido biológico. Dicha reticulación protege al tejido de la degradación por el huésped y confiere propiedades mecánicas favorables tales como, por ejemplo, una mejor resistencia a la tracción con respecto al tejido no tratado.
El glutaraldehído es una substancia altamente bactericida y viricida; por ello, además de la reticulación del tejido, la etapa de fijación determina igualmente al menos una esterilización parcial.
Además, el glutaraldehído es capaz de unirse a los restos amino libres de las proteínas de membrana de los componentes celulares aún presentes, enmascarando su potencial antigénico e impidiendo los fenómenos de activación inmunes y de rechazo por el huésped.
A pesar de la difusión de su uso, el glutaraldehído tiene la desventaja de ser uno de los factores que favorecen la calcificación patológica de los tejidos implantados. El calcio, presente en los fluidos corporales del organismo huésped, se acumula sobre el tejido proteináceo, dando lugar a un proceso de, por ejemplo en el caso de válvulas cardíacas biológicas, a una de las causas originales de fallo de la válvula. Los depósitos de calcio pueden causar flexibilidad reducida de la porción de tejido biológico que constituye la válvula (o las denominadas hojillas o cúspides de las válvulas) y conducir a la laceración del propio tejido, causando una pérdida parcial o total de función de la válvula. El mecanismo responsable de la calcificación no se conoce aún completamente y se atribuye a numerosos factores, pero se sabe que, después del proceso de fijación del glutaraldehído, los grupos aldehido libres que permanecen sobre el tejido pueden crear sitios de unión para el calcio.
Además, los fosfolípidos que comprenden las membranas celulares de las células o restos celulares procedentes del animal donante que permanecen retenidos en la estructura del tejido, constituyen igualmente sitios para la unión y acumulación de calcio.
Para limitar el proceso de calcificación en tejidos destinados a la realización de prótesis biológicas, se ha adoptado el recurso de diversos tratamientos para neutralizar los restos de aldehido que permanecen libres después de la etapa de fijación y para eliminar los fosfolípidos de membrana. Por ejemplo, el Documento US-A-2006/0193885 describe el uso de dos soluciones, la primera conteniendo alcoholes inferiores para eliminar los fosfolípidos de membrana y la segunda conteniendo arginina, histidina, lisina o sales de ácido aspártico o glutámico, para neutralizar los grupos aldehido presentes sobre el tejido biológico después de la fijación. El Documento US-B-6.479.079 describe el tratamiento de tejido biológico para la eliminación de los fosfolípidos de membrana con soluciones que
comprenden alcoholes constituidos por un cierto número de átomos de carbono variable entre 4 y 36. El Documento US-A-5.873.812 describe el uso de aminoácidos carboxílicos, por ejemplo ácido homocistéico, para neutralizar los restos de aldehido que permanecen libres sobre el tejido biológico después del proceso de fijación.
Pettenazzo y otros, describen estrategias de anticalcificación del tejido de xenoinjerto fijado con glutaraldehído para extraer lípidos o para neutralizar aldehidos tóxicos residuales. Los lípidos se eliminaron mediante un tratamiento con octanodiol (5%) en una solución etanólica (40%). El tratamiento de post-fijación se realizó en una cámara estéril durante 68 horas a 37°C.
No obstante, dichos procedimientos no son soluciones ideales dado que los sitios de unión para calcio permanecen sobre el tejido biológico, en particular, la neutralización de los grupos aldehido libres presentes después del proceso de fijación con glutaraldehido es frecuentemente parcial.
Sumario de la invención
Considerando estos preámbulos, se experimenta la necesidad, por ello, de soluciones más eficaces, mejoradas, que limiten la calcificación de los tejidos biológicos después de implantación en el huésped.
De acuerdo con la invención, dicho objetivo se logra mediante las soluciones específicamente recordadas en las reivindicaciones adjuntas, las cuales constituyen una parte integral de la presente descripción.
Una realización descrita en la presente invención se refiere a un procedimiento de tratamiento de un tejido biológico para prótesis biológicas, comprendiendo dicho procedimiento las etapas:
fijación del tejido biológico mediante un tratamiento con una solución de fijación que contiene glutaraldehl- do;
eliminación de los fosfollpidos procedentes del tejido biológico mediante un tratamiento con una solución de eliminación que contiene 1,2-octanodiol y etanol;
desintoxicación del material biológico fijado mediante un tratamiento con una solución desintoxicante que contiene taurina o ácido homocistéico a una temperatura por encima de la temperatura ambiente, preferiblemente por encima de 30°C.
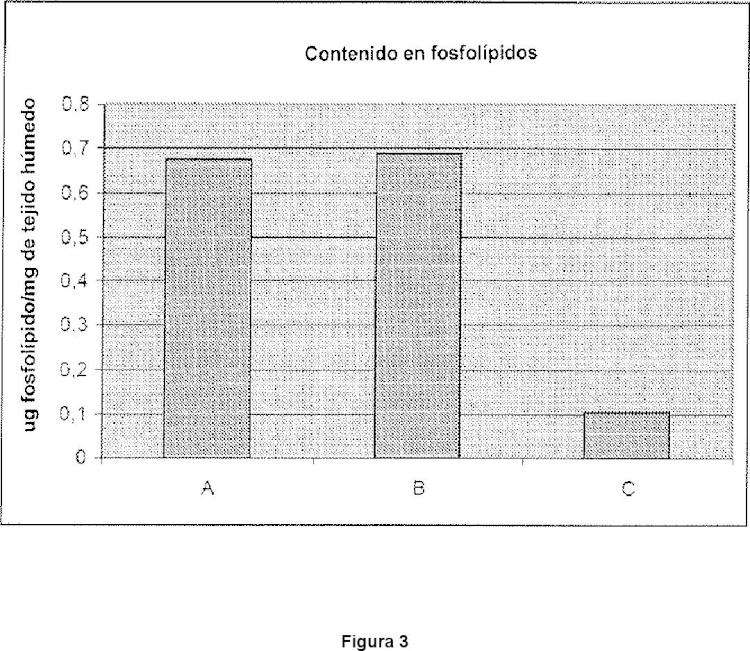
Los resultados mostrados más adelante demuestran que el procedimiento para el tratamiento de un tejido biológico tiene claramente ventajas si este comprende una etapa de eliminación de los fosfolípidos a través de tratamiento con una solución acuosa que contiene 1,2-octanodiol y etanol.
El mismo procedimiento de tratamiento de un tejido biológico tiene ventajas adicionales cuando la etapa de desin- toxicaciónse realiza a una temperatura por encima de la temperatura ambiente.
Los mejores resultados, es decir, la reducción la más eficaz del número de los grupos aldehido libres presentes sobre el tejido fijado, se obtienen cuando se contempla el procedimiento que conduce tanto a la etapa de eliminación de los fosfolípidos como la etapa de desintoxicación a una temperatura por encima de la temperatura ambiente.
Llevando a cabo el procedimiento descrito en la presente invención, es posible obtener un tejido biológico para prótesis biológicas que es mucho menos susceptible al proceso de calcificación, cuando se implanta en un organismo huésped,... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento de tratamiento de un tejido biológico para prótesis biológicas, comprendiendo dicho procedimiento las etapas:
-fijación del tejido biológico mediante un tratamiento con una solución de fijación que contiene glutaral- dehido;
-eliminación de los fosfolípidos procedentes del tejido biológico mediante un tratamiento con una solución de eliminación que contiene 1,2-octanodiol y etanol;
-desintoxicación mediante un tratamiento con una solución desintoxicante que contiene taurina o ácido homocistéico a una temperatura por encima de la temperatura ambiente, preferiblemente por encima de 30°C, en el que la etapa de eliminación de los fosfolípidos se lleva a cabo antes de dicha etapa de fijación.
2. Procedimiento de acuerdo con la reivindicación 1, en el que dicha solución de eliminación contiene 1,2-octanodiol en una concentración expresada en v/v comprendida dentro del intervalo de 1% a 25%, preferiblemente 2% a 10%, más preferiblemente 5%.
3. Procedimiento de acuerdo con una cualquiera de las reivindicaciones precedentes, en el que dicha solución de eliminación contiene etanol en una concentración expresada en v/v comprendida dentro del intervalo de 25% a 49%, preferiblemente 30% a 45%, más preferiblemente 40%.
4. Procedimiento de acuerdo con una cualquiera de las reivindicaciones precedentes, en el que dicha solución de eliminación tiene un pH comprendido dentro del intervalo de 4 a 9, preferiblemente 5 a 8, más preferiblemente de
7,4.
5. Procedimiento de acuerdo con una cualquiera de las reivindicaciones precedentes, en el que dicha etapa de eliminación de los fosfolípidos se lleva a cabo a una temperatura entre 15°C y 65°C, preferiblemente entre 30°C y 40°C, más preferiblemente a 37°C.
6. Procedimiento de acuerdo con una cualquiera de las reivindicaciones precedentes, en el que dicha etapa de eliminación de los fosfolípidos se lleva a cabo durante un período de tiempo comprendido dentro del intervalo de 2 a 7 días, preferiblemente 16 a 72 horas.
7. Procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que dicha etapa de eliminación de fosfolípidos se lleva a cabo antes de dicha etapa de desintoxicación.
8. Procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 6, en el que dicha etapa de eliminación de los fosfolípidos se lleva a cabo en dos fases; una primera fase llevada a cabo antes de dicha etapa de fijación y una segunda fase llevada a cabo simultáneamente a dicha etapa de desintoxicación, en el que dicha solución de desintoxicación contiene además 1,2-octanodiol y etanol.
9. Procedimiento de acuerdo con una cualquiera de las reivindicaciones precedentes, en el que dicha solución de desintoxicación contiene taurina a una concentración expresada en p/v dentro del intervalo de desde 0,10% hasta saturación, preferiblemente desde 0,20% hasta 1,00%, más preferiblemente 0,70%.
10. Procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 8, en el que dicha solución de desintoxicación contiene ácido homocistéico a una concentración expresada en p/v dentro del intervalo de desde 0,10% hasta saturación, preferiblemente desde 0,50% hasta 5,00%, más preferiblemente 1,00%.
11. Procedimiento de acuerdo con una cualquiera de las reivindicaciones precedentes, en el que dicha etapa de desintoxicación se lleva a cabo a una temperatura mayor de 30°C, preferiblemente entre 35°C y 45°C, más preferiblemente a 40°C.
12. Procedimiento de acuerdo con una cualquiera de las reivindicaciones precedentes, en el que dicha solución de desintoxicación tiene un pH comprendido dentro del intervalo de 4 a 9, preferiblemente 5 a 8, más preferiblemente de 7.
13. Procedimiento de acuerdo con una cualquiera de las reivindicaciones precedentes, en el que dicha etapa de desintoxicación se lleva a cabo durante un período comprendido dentro del intervalo de 2 a 36 horas, preferiblemente 12 a 48 horas, más preferiblemente 24 horas.
Patentes similares o relacionadas:
 Procedimiento y dispositivo para producir un objeto multicelular tridimensional, del 29 de Julio de 2020, de TECHNISCHE UNIVERSITAT BERLIN: Procedimiento para producir un objeto multicelular tridimensional, con los pasos siguientes:
a) introducción de un primer líquido fotopolimerizable […]
Procedimiento y dispositivo para producir un objeto multicelular tridimensional, del 29 de Julio de 2020, de TECHNISCHE UNIVERSITAT BERLIN: Procedimiento para producir un objeto multicelular tridimensional, con los pasos siguientes:
a) introducción de un primer líquido fotopolimerizable […]
Matriz de soporte de injerto para reparación de cartílago y procedimiento de obtención de la misma, del 1 de Julio de 2020, de ETH ZURICH: Un procedimiento de proporción de una matriz de soporte de injerto para reparación de cartílagos, particularmente en un paciente humano, que comprende las etapas de: […]
Procedimiento de preparación de un material de aloinjerto, producto obtenido, y usos del mismo, del 27 de Mayo de 2020, de TBF Genie Tissulaire (TBF): Procedimiento de preparación de un material de aloinjerto que forma una membrana viroinactivada, liofilizada y estéril procedente de placenta de mamífero y constituida […]
Preparación de supercóntigos de tejido regenerativo, del 20 de Mayo de 2020, de LIFECELL CORPORATION: Un supercóntigo de tejido seco, que comprende: una "acellular tissue matrix" (matriz de tejido acelular - ATM) en forma de partículas; y un polímero; en donde […]
COMPOSICIÓN A BASE DE BIOPOLÍMEROS RECOMBINANTES Y USOS DE LA MISMA COMO BIOTINTA, del 23 de Abril de 2020, de UNIVERSIDAD DE VALLADOLID: La presente invención se refiere a composiciones que comprenden biopoiímeros recombinantes formados por combinaciones de monómeros de tipo "Recombinámeros […]
Composiciones y métodos para el tratamiento de huecos óseos y fracturas abiertas, del 22 de Abril de 2020, de Polypid Ltd: Una composición farmacéutica que comprende partículas de relleno óseo recubiertas y no recubiertas en una proporción entre aproximadamente 1:3 […]
Procedimientos de preparación de un hidrogel esterilizado de modo terminal que proviene de matriz extracelular, del 22 de Abril de 2020, de UNIVERSITY OF PITTSBURGH OF THE COMMONWEALTH SYSTEM OF HIGHER EDUCATION: Un procedimiento de preparación de un material digerido de matriz extracelular esterilizado de modo terminal capaz de gelificar, que comprende: (i) solubilizar la matriz […]
COMPOSICIÓN A BASE DE BIOPOLÍMEROS RECOMBINANTES Y USOS DE LA MISMA COMO BIOTINTA, del 20 de Abril de 2020, de UNIVERSIDAD DE VALLADOLID: Composición a base de biopolímeros recombinantes y usos de la misma como biotinta. La presente invención se refiere a composiciones que comprenden […]