Purificación de polipéptidos pegilados.
El método para la purificación de una eritropoyetina monopegilada que comprende los pasos de proporcionar unasolución que comprende eritropoyetina monopegilada,
polipegilada y no pegilada, en el que se realizan dos pasos decromatografía de intercambio de cationes consecutivos, y la recuperación de la eritropoyetina monopegiladapurificada en el segundo paso de cromatografía de intercambio de cationes, que se caracteriza porque se utiliza elmismo tipo de material de intercambio de cationes en ambos pasos de cromatografía de intercambio de cationes yporque los dos pasos de cromatografía de intercambio de cationes consecutivos se realizan utilizando diferentesmétodos de elución, y en el que los dos pasos consecutivos de cromatografía de intercambio de cationescomprenden los siguientes pasos:
a) aplicar una solución acuosa tamponada que comprende una mezcla de eritropoyetina monopegilada, polipegiladay no pegilada, y formas de bajo peso molecular a una primera columna de cromatografía de intercambio de cationesbajo condiciones adecuadas para la unión de dicha eritropoyetina monopegilada al material de intercambio decationes contenido en dicha primera columna,
b) recuperar la eritropoyetina monopegilada de la primera columna de cromatografía de intercambio de cationesmediante un método de elución por pasos con un aumento progresivo de la fuerza iónica del tampón de elución, enel que la fracción de dicha eritropoyetina monopegilada en la solución recuperada aumenta comparado con lamezcla aplicada,
c) aplicar la eritropoyetina monopegilada recuperada del paso b) en una segunda columna de cromatografía de ntercambio de cationes bajo las condiciones adecuadas para la unión de dicha eritropoyetina monopegilada almaterial de intercambio de cationes contenido en dicha segunda columna, en la que el material de intercambio decationes contenido en dicha segunda columna es del mismo tipo que el material de intercambio de cationes en laprimera columna,
d) recuperar la eritropoyetina monopegilada purificada en una forma sustancialmente homogénea a partir de dichasegunda columna de cromatografía de intercambio de cationes mediante un método de elución continua con unaumento continuo de la fuerza iónica del tampón de elución.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2008/005767.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Nacionalidad solicitante: Suiza.
Dirección: GRENZACHERSTRASSE, 124 4070 BASEL SUIZA.
Inventor/es: BURG, JOSEF, REICHERT,Klaus, SCHROTH,Axel, SCHURIG,Hartmut, WESSNER,Axel.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/18 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de crecimiento; Reguladores de crecimiento.
- A61K47/48
- C07K1/18 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › Cromatografía de intercambio iónico.
PDF original: ES-2386323_T3.pdf
Fragmento de la descripción:
Purificación de polipéptidos pegilados
La presente invención pertenece al área de los métodos de separación cromatográficos útiles para la purificación de polipéptidos, especialmente de eritropoyetina PEGilada.
Antecedentes de la invención
Las proteínas juegan un importante papel en el portafolio de la medicina actual. Para su aplicación en humanos, cada proteína terapéutica debe cumplir distintos criterios. Para garantizar la seguridad de los agentes biofarmacéuticos en humanos, deben eliminarse especialmente los subproductos que se acumulan durante el proceso de producción. Para cumplir las especificaciones regulatorias, el proceso de fabricación debe continuarse con uno o más pasos de purificación. Entre otros, la pureza, la eficiencia y el rendimiento juegan un importante papel en la determinación de un proceso de purificación apropiado.
Se utilizan diferentes métodos bien establecidos y extendidos para la purificación de proteínas, como la cromatografía de afinidad con proteínas microbianas (por ejemplo, cromatografía de afinidad con proteína A o proteína G) , cromatografía de intercambio iónico (por ejemplo intercambio catiónico (resinas de sulfopropilo o carboximetilo) , intercambio aniónico (resinas de aminoetilo) e intercambio iónico de modo mixto) , cromatografía de adsorción tiofílica (por ejemplo con betamercaptoetanol y otros ligandos SH) , interacción hidrofóbica o adsorción aromática (por ejemplo con fenil-sefarosa, resinas aza-arenofílicas o ácido m-aminofenilborónico) , cromatografía de afinidad de quelatos metálicos (por ejemplo con material de afinidad al Ni (II) y Cu (II) ) , cromatografía de exclusión por tamaño y métodos electroforéticos (como la electroforesis en gel o electroforesis capilar) (Vijayalakshmi, M.A., Appl. Biochem. Biotech. 75 (1998) 93-102) .
Se han descrito conjugaciones, por ejemplo, de polietilenglicol (PEG) e interleuquina-6 (PE 0 442 724) , de PEG y eritropoyetina (WO 01/02017) , de moléculas quiméricas que comprenden endostatina e inmunoglobulinas (US 2005/008649) , de proteínas de fusión basadas en anticuerpos secretadas (US 2002/147311) , de polipéptidos de fusión que comprenden albúmina (US 2005/0100991; albúmina sérica humana US 5.876.969) , de polipéptidos pegilados (US 2005/0114037) , y de fusiones de interferón.
Necina, R., et al. (Biotechnol. Bioeng. 60 (1998) 689-698) describieron la captura de anticuerpos monoclonales humanos directamente de sobrenadantes de cultivo celular mediante un medio de intercambio iónico que muestra una elevada densidad de carga. En la WO 89/05157 se describe un método para la purificación de un producto de inmunoglobulinas sometiendo directamente el medio de cultivo celular a un tratamiento de intercambio catiónico. En Danielsson, A., et al., J. Immun. Meth. 115 (1988) , 79-88 se describe una purificación en un solo paso de anticuerpos IgG monoclonales a partir de ascites de ratón. En la WO 2004/024866 se describe un método para la purificación de un polipéptido mediante una cromatografía de intercambio iónico en la que se utiliza un lavado en gradiente para separar un polipéptido de interés de entre uno o más contaminantes. En la PE 0 530 447 se describe un proceso de purificación de anticuerpos IgG monoclonales mediante una combinación de tres pasos de cromatografía. Una purificación fácil de un antagonista del receptor de la interleuquina-1 monopegilado se describe en Yu, G., et al., en Process Biotechnol. 42 (2007) 971-977. Wang et al. (Wang, H., et al., Péptidos 26 (2005) 12131218) describe la purificación de hTFF3 expresado en E.coli mediante una cromatografía de intercambio de cationes en dos pasos. Yun et al. (Yun, Q., et al., J. Biotechnol. 118 (2005) 67-74) describe la purificación de rhG-CSF pegilado mediante dos pasos de cromatografía de intercambio de iones consecutivos. La WO 2007/039436 y WO 01/087329 describen la unión covalente de la eritropoyetina a grupos polietilenglicol y una composición farmacéutica líquida que comprende una proteína eritropoyetina.
En Current Protocols in Molecular Biology, Unidad 10.10 (aportado por Williams, A. y Frasca, V., John Wiley& Sons, Inc., Print ISSN: 1934-3639 (1998) ) y en Current Protocols in Protein Science, Unidad 8.2 (aportado por Williams, A. y Frasca, John Wiley&Sons, Inc., Print ISSN:1934-3655 (1999) ) se describe la planificación y la realización de una cromatografía de intercambio iónico para separar proteínas.
En la descripción técnica "Ion Exchange Chromatography: Principles and Methods" (1994) de Pharmacia Biotech se describe la elección del tipo de gradiente.
Goding, J.W., describe en "Monoclonal Antibodies: Principles and Practice" en la sección 4.2.4 (2ª edición, Adacemic Press, ISBN:21-2 (1986) ) que la cromatografía de intercambio iónico es una manera útil de purificar inmunoglobulinas, especialmente IgG.
Resumen de la invención
La presente invención comprende un método para la purificación de una eritropoyetina monopegilada que comprende los pasos para proporcionar una solución que comprende eritropoyetina monopegilada, polipegilada y no pegilada, en el que se realizan dos pasos consecutivos de cromatografía de intercambio de cationes, y una recuperación de eritropoyetina monopegilada purificada en el segundo paso de cromatografía de intercambio de cationes, en el que se utiliza el mismo tipo de material de intercambio de cationes en ambos pasos de cromatografía de intercambio de cationes.
En una realización del método los dos pasos consecutivos de cromatografía de intercambio de cationes se realizan utilizando diferentes métodos de elución. En otra realización, los dos pasos consecutivos de cromatografía de intercambio de cationes comprenden los siguientes pasos:
a) aplicar una solución acuosa tamponada que comprende una mezcla de eritropoyetina monopegilada, polipegilada y no pegilada en una primera columna de cromatografía de intercambio de cationes bajo condiciones adecuadas para la unión de dicha eritropoyetina monopegilada al material de intercambio de cationes que contiene dicha primera columna,
b) recuperar la eritropoyetina monopegilada de la primera columna de cromatografía de intercambio de cationes mediante un método de elución por pasos con un aumento en cada paso de la fuerza iónica del tampón de elución, de forma que la fracción de dicha eritropoyetina monopegilada aumenta comparado con la mezcla aplicada en el paso a) ,
c) aplicar la eritropoyetina monopegilada recuperada en una segunda columna de cromatografía de intercambio de cationes bajo condiciones adecuadas para la unión de dicha eritropoyetina monopegilada al material de intercambio de cationes contenido en dicha segunda columna, siendo el material de intercambio de cationes contenido en dicha segunda columna del mismo tipo que el material de intercambio de cationes en la primera columna,
d) recuperar la eritropoyetina monopegilada purificada en forma sustancialmente homogénea de dicha segunda columna de cromatografía de intercambio de cationes mediante un método de elución continuo con un aumento continuo de la fuerza iónica del tampón de elución.
En una realización del método, el material de intercambio de cationes es un material de intercambio de cationes fuerte. En una realización preferible, el material de intercambio de cationes fuerte es un material de intercambio de cationes de sulfopropilo. Es especialmente preferible el Toyopearl® SP 650 M. En otra realización, la eritropoyetina monopegilada se recupera en el paso d) en forma sustancialmente homogénea de una pureza de más de 95% en área. En otra realización del método el aumento por pasos de la fuerza iónica del paso b) del método es un aumento de la fuerza iónica en dos pasos. Preferiblemente, la eritropoyetina monopegilada se recupera en el segundo paso de método de elución en pasos, es decir tras el segundo aumento en la fuerza iónica.
Otro aspecto de la presente invención es un método para la producción de una eritropoyetina monopegilada que comprende los siguientes pasos:
a) PEGilar la eritropoyetina utilizando un reactivo de PEGilado,
b) purificar la eritropoyetina pegilada con dos pasos consecutivos de cromatografía de intercambio de cationes, en los que en la primera y segunda cromatografía de intercambio de cationes se emplea el mismo tipo de material de intercambio de cationes,
c) recuperar la eritropoyetina... [Seguir leyendo]
Reivindicaciones:
1. El método para la purificación de una eritropoyetina monopegilada que comprende los pasos de proporcionar una solución que comprende eritropoyetina monopegilada, polipegilada y no pegilada, en el que se realizan dos pasos de cromatografía de intercambio de cationes consecutivos, y la recuperación de la eritropoyetina monopegilada purificada en el segundo paso de cromatografía de intercambio de cationes, que se caracteriza porque se utiliza el mismo tipo de material de intercambio de cationes en ambos pasos de cromatografía de intercambio de cationes y porque los dos pasos de cromatografía de intercambio de cationes consecutivos se realizan utilizando diferentes métodos de elución, y en el que los dos pasos consecutivos de cromatografía de intercambio de cationes comprenden los siguientes pasos: a) aplicar una solución acuosa tamponada que comprende una mezcla de eritropoyetina monopegilada, polipegilada y no pegilada, y formas de bajo peso molecular a una primera columna de cromatografía de intercambio de cationes bajo condiciones adecuadas para la unión de dicha eritropoyetina monopegilada al material de intercambio de cationes contenido en dicha primera columna, b) recuperar la eritropoyetina monopegilada de la primera columna de cromatografía de intercambio de cationes mediante un método de elución por pasos con un aumento progresivo de la fuerza iónica del tampón de elución, en el que la fracción de dicha eritropoyetina monopegilada en la solución recuperada aumenta comparado con la mezcla aplicada, c) aplicar la eritropoyetina monopegilada recuperada del paso b) en una segunda columna de cromatografía de intercambio de cationes bajo las condiciones adecuadas para la unión de dicha eritropoyetina monopegilada al material de intercambio de cationes contenido en dicha segunda columna, en la que el material de intercambio de cationes contenido en dicha segunda columna es del mismo tipo que el material de intercambio de cationes en la primera columna, d) recuperar la eritropoyetina monopegilada purificada en una forma sustancialmente homogénea a partir de dicha segunda columna de cromatografía de intercambio de cationes mediante un método de elución continua con un aumento continuo de la fuerza iónica del tampón de elución.
2. El método de acuerdo con la reivindicación 1, que se caracteriza porque dicho material de intercambio de cationes es un material de intercambio de cationes de sulfopropilo.
3. El método de acuerdo con la reivindicación 1, que se caracteriza porque dicho aumento a pasos de la fuerza iónica del paso b) del método es un aumento de la fuerza iónica de tres pasos.
4. El método de acuerdo con la reivindicación 3, que se caracteriza porque la eritropoyetina monopegilada recuperada en el paso b) se recupera en el segundo paso del método de elución por pasos.
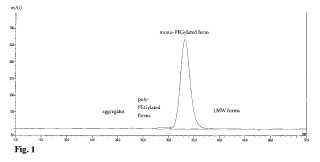
5. El método de acuerdo con la reivindicación 4, que se caracteriza porque en dicho paso b) se recupera eritropoyetina polipegilada tras el primer aumento de fuerza iónica en el tampón no retenido, se recupera eritropoyetina monopegilada tras el segundo aumento de fuerza iónica en el tampón no retenido, y se recupera eritropoyetina no pegilada tras el tercer aumento de fuerza iónica del tampón no retenido.
6. El método de acuerdo con cualquiera de las reivindicaciones de 1 a 5, que se caracteriza porque la diferencia de la concentración de sal que causa la elución en el método de elución por pasos del paso b) es del 120 % o más en cada uno de los pasos del método de elución por pasos.
7. El método de acuerdo con cualquiera de las reivindicaciones de 1 a 6, que se caracteriza porque dicha solución acuosa tamponada contiene ácido fosfórico o sales del mismo, ácido cítrico o sales del mismo, o histidina o sales de la misma como sustancia tampón.
8. El método de acuerdo con cualquiera de las reivindicaciones de 1 a 7, que se caracteriza porque en dicho paso d) la eritropoyetina monopegilada se recupera de la segunda columna de cromatografía de intercambio de cationes mediante la aplicación de un gradiente lineal que se inicia con un tampón de fosfato potásico de una concentración de alrededor de 100 mM con cloruro sódico a alrededor de 50 mM a un pH de aproximadamente 3, 0 y finalizando con un tampón fosfato potásico a una concentración de alrededor de 100 mM con cloruro sódico a alrededor de 500 mM a un pH de aproximadamente 3, 0, en el que el cambio en la concentración de cloruro sódico es lineal a lo largo de diez volúmenes de columna.
9. El método para la producción de una eritropoyetina monopegilada que comprende los siguientes pasos: a) PEGilar la eritropoyetina, b) purificar la eritropoyetina monopegilada con dos pasos consecutivos de cromatografía de intercambio de cationes, en la que el primer y segundo paso de cromatografía de intercambio de cationes emplean el mismo tipo de material de intercambio de cationes, c) recuperar la eritropoyetina monopegilada de la segunda columna de cromatografía de intercambio de cationes en forma sustancialmente homogénea, y realizando los dos pasos consecutivos de cromatografía de intercambio de cationes utilizando diferentes métodos de elución de acuerdo con la reivindicación 1.
10. El método de acuerdo con cualquiera de las reivindicaciones precedentes, que se caracteriza porque el segundo material de intercambio de cationes es el mismo tipo de material de intercambio de cationes pero no la misma fracción del material de intercambio de cationes que el primer material de intercambio de cationes.
11.
2. 35 kDa en forma de PEG linear y de 40 kDa como PEG ramificado.
12. El método de acuerdo con cualquiera de las reivindicaciones precedentes, que se caracteriza porque dicha eritropoyetina monopegilada se obtiene en una forma sustancialmente homogénea que contiene más del 95% en área de eritropoyetina monopegilada determinado mediante HPLC de exclusión por tamaño.
13. El método de acuerdo con cualquiera de las reivindicaciones precedentes, que se caracteriza porque dicha eritropoyetina monopegilada se recupera en el primer paso de cromatografía de intercambio de cationes con una pureza de más del 60% en área determinado mediante HPLC de exclusión por tamaño.
14. El método de acuerdo con cualquiera de las reivindicaciones de 3 a 13, que se caracteriza porque dicha solución acuosa tamponada que contiene tampón fosfato potásico a alrededor de 100 mM y posee un pH de aproximadamente 3, 0.
15. El método de acuerdo con cualquiera de las reivindicaciones precedentes, que se caracteriza porque en dichos pasos de cromatografía, el valor de pH de las soluciones es de alrededor de 3, 0.
16. El método de acuerdo con cualquiera de las reivindicaciones precedentes, que se caracteriza porque la sal que causa la elución de la eritropoyetina pegilada de las columnas de cromatografía de intercambio de cationes es citrato sódico, cloruro sódico o cloruro potásico.
17. El método de acuerdo con cualquiera de las reivindicaciones precedentes, que se caracteriza porque dicha eritropoyetina posee la secuencia de aminoácidos de Id. de Sec. Nº: 1 o 2.
Patentes similares o relacionadas:
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Dispositivo médico que tiene un revestimiento que comprende ACCS, del 15 de Julio de 2020, de Noveome Biotherapeutics, Inc: Un dispositivo médico implantable que tiene un revestimiento en su superficie, útil para la implantación quirúrgica en el cuerpo de un sujeto, […]
Composiciones que comprenden cócteles de fagos antibacterianos y usos de las mismas para el tratamiento de infecciones bacterianas, del 24 de Junio de 2020, de Tecnifar-Indústria Técnica Farmacêutica, S.A: Una composicion que comprende: una primera y una segunda cepa purificada de bacteriofago, cada una de dichas cepas que tiene un genoma que comprende […]
Trampas de GDF, del 3 de Junio de 2020, de ACCELERON PHARMA, INC: Un polipéptido aislado que comprende la secuencia de aminoácidos de SEQ ID NO: 28.
Combinacion de peptidos tolerogenos con TFG-â para inducir y mantener la tolerancia oral en mamiferos jovenes, del 3 de Junio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Una composición nutricional - que contiene al menos un péptido de cinco hasta doce aminoácidos de longitud e incluye una secuencia elegida entre […]
Formulaciones con oxidación reducida, del 3 de Junio de 2020, de F. HOFFMANN-LA ROCHE AG: Una formulación líquida que comprende un anticuerpo y un compuesto que previene la oxidación del anticuerpo en la formulación líquida, en la que el compuesto es […]
Composiciones para lograr niveles plasmáticos deseados del factor 2 de crecimiento glial, del 6 de Mayo de 2020, de ACORDA THERAPEUTICS, INC: Factor de crecimiento glial 2 (GGF2) para su uso en la promocion de la remielinizacion celular en un paciente, donde el GGF2 se administra al paciente en una cantidad de […]
Modulación de la actividad del factor de crecimiento epidérmico de unión a heparina para la curación de la membrana timpánica, del 6 de Mayo de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un agente que proporciona actividad de factor de crecimiento epidérmico de unión a heparina (HB-EGF) para su uso en el tratamiento de una perforación crónica de la membrana […]