Proceso para la producción de derivados de amina ópticamente activos.
Un proceso para producir (S)-2-(1,6,7,8-tetrahidro-2H-indeno[5,
4-b]furan-8-il)etilamina, o una de sus sales, que comprende:
etapa (i):
una etapa para reducir asimétricamente la (E)-2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8- iliden)etilamina, o una de sus sales, con un catalizador, y
etapa (ii):
una etapa para reducir catalíticamente los subproductos en los productos de la reacción obtenidos en la etapa (i) a una temperatura de reacción de 40 ºC a 100 ºC y un pH de 3 a 9, con un catalizador
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2005/016761.
Solicitante: TAKEDA PHARMACEUTICAL COMPANY LIMITED.
Nacionalidad solicitante: Japón.
Dirección: 1-1, Doshomachi 4 - chome 541-0045 Chuo-ku Osaka-shi, Japón JAPON.
Inventor/es: OKADA,Takashi, URAYAMA,SHINICHI, MUTOU,EIGO, INAGAKI,ATSUSHI, SUGISAKI,SHIGEHARU.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/343 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensados con un carbociclo, p. ej. cumarano, bufuralol, bufenolol, clobenfurol, amiodarona.
- A61P25/20 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › Hipnóticos; Sedantes.
- C07D307/77 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 307/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo. › orto- o peri- condensados con ciclos o sistemas cíclicos carbocíclicos.
PDF original: ES-2485890_T3.pdf
Fragmento de la descripción:
Proceso para la producción de derivados de amina ópticamente activos
La presente invención se refiere a un proceso para la producción de un derivado de amina ópticamente activo que tiene alta pureza, en el que se suprime la formación de subproductos.
Aunque los documentos JP-A 11-1473 y JP-A 22-21263 describen un método para producir clorhidrato de (S)- 2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-il)etilamina mediante una reducción asimétrica a partir del hidrocloruro de (E)-2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-iliden)etilamina como material de partida, ambos métodos no son suficientes como método de producción industrial, en el que se suprimiría la formación de subproductos y se producirían cristales de alta pureza de clorhidrato de (S)-2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-il)etilamina con alto rendimiento. En particular, los problemas son controlar los subproductos representados por las siguientes fórmulas (NI) y (IV):
Por otra parte, se describe la dimerización de un compuesto de benzofurano en presencia de un catalizador de Pd en Liebigs. Ann. Chem., 1, 945 (1989), y J. Chem. Soc. (A), 1324 (1968). Sin embargo, en estos casos la dimerización se produce por la unión de dos anillos aromáticos, y las estructuras de sus dímeros son diferentes de los dímeros formados por la reacción entre un anillo aromático y la posición bencilo, tal como el compuesto representado por la anterior fórmula (IV). Además, J. Chem. Soc. D, 736 (197) indica que la oxidación de la posición bencilo del compuesto de benzofurano se realiza en presencia de un catalizador de Pd, pero en esta referencia no se describe la formación de dímeros.
Descripción de la invención
El objeto de la presente invención es proporcionar un proceso industrial para la producción de un derivado de amina ópticamente activo con alto rendimiento y alta pureza, en el que se controla la formación de subproductos.
Como resultado de estudios profundos para resolver el anterior problema, los presentes inventores han descubierto que, en las etapas de producción del derivado de amina ópticamente activo, la formación de subproductos representados por las anteriores fórmulas (III) y (IV) puede controlarse controlando el pH y la temperatura de la disolución de reacción en el momento de la reducción catalítica con Pd-C y la disolución en el momento de su postratamiento, y así han completado la presente invención.
Es decir, la presente invención proporciona:
(1) Un proceso para producir (S)-2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-il)etilamina, o una de sus sales, que comprende la etapa (i): una etapa para reducir asimétricamente la (E)-2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8- iliden)etilamina, o una de sus sales, con un catalizador, y la etapa (ii): una etapa para reducir catalíticamente los subproductos en los productos de la reacción obtenidos en la etapa (i) a una temperatura de reacción de 4 °C a 1 °C y un pH de 3 a 9, con un catalizador.
(2) El proceso según (1) indicado anteriormente, en el que la temperatura de reacción en la etapa (ii) es de 5 °C a 7 °C.
(3) El proceso según (1) indicado anteriormente, en el que el pH en la etapa (ii) es de 5 a 7.
(4) El proceso según (1) indicado anteriormente, en el que el catalizador en la etapa (i) es un catalizador de Ru- BINAP.
(5) El proceso según (1) indicado anteriormente, en el que el catalizador en la etapa (ii) es un catalizador de Pd-C.
(6) Un proceso para producir cristales de (S)-N-[2-(1,6,7,8-tetrahldro-2H-lndeno[5,4-b]furan-8-il)etil]propionamida, que comprende:
etapa (I): una etapa para reducir asimétricamente la (E)-2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-
iliden)etilamina, o una de sus sales, con un catalizador,
etapa (¡i): una etapa para reducir catalíticamente los subproductos en los productos de la reacción obtenidos en la etapa (i) a una temperatura de reacción de 4 °C a 1 °C y un pH de 3 a 9, con un catalizador,
etapa (a): una etapa para propionilar el grupo amino de la (S)-2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8- il)etilamina, o una de sus sales, obtenida en la etapa (¡i), y
etapa (b): una etapa para cristalizar mediante la adición de un disolvente acuoso a la disolución de reacción obtenida en la etapa (a).
Breve descripción de los dibujos
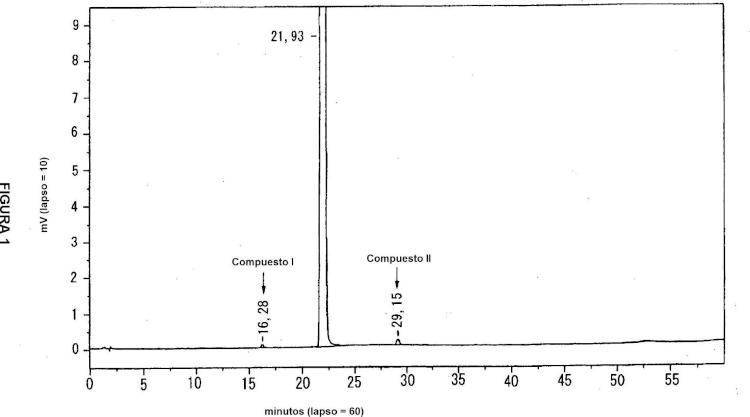
La figura 1 es un diagrama de HPLC que muestra el resultado del análisis del compuesto (I) al (IV) en los cristales de (S)-N-[2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-il)etil]propionamida.
Mejor modo de realizar la invención
Los ejemplos de la sal de la (S)-2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-il)etilamina en la presente invención incluyen sales con un ácido inorgánico, tal como ácido clorhídrico, ácido sulfúrico, y ácido nítrico, sales con un ácido orgánico, tal como ácido fórmico, ácido acético, y ácido trifluoroacético, y similares.
Además, la (E)-2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-iliden)etilamina, que es un compuesto bruto que se emplea para la producción de (S)-2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-il)etilamina, o una de sus sales, de la presente invención, puede producirse mediante un método descrito en el documento JP-A 22-21263, es decir, un método para reducir catalíticamente la 4,5-dibromo-1,2,6,7-tetrahidro-8H-indeno[5,4-b]furan-8-ona con un catalizador de la reducción catalítica, tal como Pd-C, y después hacer reaccionar la 1,2,6,7-tetrahidro-8H-indeno[5,4-b]furan-8- ona obtenida con cianometilfosfonato de dietilo, seguido de una hidrogenación con un catalizador de cobalto, o con métodos análogos a este.
En la etapa de reducción catalítica, la reducción catalítica de la 4,5-dibromo-1,2,6,7-tetrahidro-8H-indeno[5,4-b]furan- 8-ona puede realizarse mezclando 4,5-dibromo-1,2,6,7-tetrahidro-8H-indeno[5,4-b]furan-8-ona, un disolvente orgánico y, si se desea, una base, y más tarde, preferiblemente después de displazar el sistema con nitrógeno, añadir el catalizador de reducción catalítica, seguido de una presurización con hidrógeno y una agitación.
En este momento, desde el punto de vista del control de la formación de subproductos (específicamente, dímeros), se prefiere que la reacción se realice bajo condiciones de presión de hidrógeno y coeficiente volumétrico de transferencia de masa global gas-líquido que cumpla con la desigualdad:
presión de hidrógeno (MPa) > -,2 x coeficiente volumétrico de transferencia de masa global gas-líquido (1/hr) + ,43.
En la presente, el coeficiente volumétrico de transferencia de masa global gas-líquido puede determinarse con el método de Na2S3 según se describe en detalle en el siguiente ejemplo 1.
Además, la presión de hidróqeno en la presente reacción habitualmente es de ,1 a 1 MPa, preferiblemente de ,3 a ,5 MPa.
En el sistema de gas-líquido, la velocidad Na a la que el gas se disuelve en la disolución por unidad de área de contacto puede expresarse como en el caso de la velocidad de disolución en el sistema sólido-líquido, la velocidad de extracción en el sistema líquido-líquido y el fenómeno de transferencia en la transferencia de calor por convección, y se indica en forma de (coeficiente de transferencia de masa) x (diferencia de la concentración).
Na=Kl(Ci-C) (1)
En esta ecuación, Kl es el coeficiente de transferencia de masa para el líquido, Ci es una concentración que está en equilibrio con la presión parcial de gas en la burbuja de gas, C es una concentración saturada en un momento concreto, y (C-i-C) es una fuerza conductora para la absorción del gas.
Además, puesto que A es un área de contacto gas-líquido y Vl es un volumen de líquido, y puesto que el aumento de la tasa Vi_dC/dt de la concentración de gas en la disolución es igual a la velocidad de disolución del gas, puede obtenerse la siguiente ecuación:
Na = VLdC/dt (2)
Por tanto, la ecuación:
dC/dt = KlA(Ci-C)A/l (3)
puede derivarse de las fórmulas (1) y (2).
Además, puesto que A/Vl se representa por a, el área de la inferíase gas-líquido por unidad de área, se obtiene la ecuación:
dC/dt = KLa(Ci-C) (4)
Puesto que es difícil obtener el área de interfase gas-líquido, a, independientemente en una operación de agitación de gas-líquido, se emplea el coeficiente volumétrico de transferencia de masa para el líquido Ki_a, que es un producto de a y el coeficiente de transferencia de masa para el líquido, Kl, como índice para expresar la absorbabilidad del gas.
Además, como se desprende del hecho de que cuando aumenta la velocidad de agitación, el área de interfase gas- líquido, a, aumenta, en general puede decirse... [Seguir leyendo]
Reivindicaciones:
1- Un proceso para producir (S)-2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-il)etilamina, o una de sus sales, que comprende:
etapa (i): una etapa para reducir asimétricamente la (E)-2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-
iliden)etilamina, o una de sus sales, con un catalizador, y
etapa (ii): una etapa para reducir catalíticamente los subproductos en los productos de la reacción obtenidos en la etapa (i) a una temperatura de reacción de 4 °C a 1 °C y un pH de 3 a 9, con un catalizador.
2.- El proceso según la reivindicación 1, en el que la temperatura de reacción en la etapa (ii) es de 5 °C a 7 °C.
3.- El proceso según la reivindicación 1, en el que el pH en la etapa (ii) es de 5 a 7.
4.- El proceso según la reivindicación 1, en el que el catalizador en la etapa (i) es un catalizador de Ru-BINAP.
5.- El proceso según la reivindicación 1, en el que el catalizador en la etapa (ii) es un catalizador de Pd-C.
6.- Un proceso para producir cristales de (S)-N-[2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-il)etil]propionamida, que comprende:
etapa (i): una etapa para reducir asimétricamente la (E)-2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-
iliden)etilamina, o una de sus sales, con un catalizador,
etapa (ii): una etapa para reducir catalíticamente los subproductos en los productos de la reacción obtenidos en la etapa (i) a una temperatura de reacción de 4 °C a 1 °C y un pH de 3 a 9, con un catalizador,
etapa (a): una etapa para propionilar el grupo amino de la (S)-2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8- il)etilamina, o una de sus sales, obtenida en la etapa (ii), y
etapa (b): una etapa para cristalizar mediante la adición de un disolvente acuoso a la disolución de reacción obtenida en la etapa (a).
Patentes similares o relacionadas:
Método para fabricar un compuesto de difluorolactona, del 27 de Noviembre de 2019, de AGC Inc: Un método para producir un compuesto de difluorolactona representado por la siguiente fórmula , que comprende fluorar un compuesto de lactona […]
USO DE UN AGONISTA DE MELATONINA PARA INDUCIR ADIPOCITOS BEIGE EN EL TEJIDO ADIPOSO BLANCO, del 9 de Mayo de 2019, de UNIVERSIDAD DE GRANADA: La presente invención se refiere al uso de ramelteon para el tratamiento de enfermedades o condiciones patológicas mediante pardeado de grasa blanca. La inducción de adipocitos […]
USO DE UN AGONISTA DE MELATONINA PARA INDUCIR LA PARA INDUCIR ADIPOCITOS BEIGE EN EL TEJIDO ADIPOSO BLANCO, del 7 de Mayo de 2019, de UNIVERSIDAD DE GRANADA: Uso de un agonista de melatonina para inducir adipocitos beige en el tejido adiposo blanco. La presente invención se refiere al uso de ramelteon para el tratamiento […]
Síntesis de tetraciclinas y sus análogos, del 27 de Julio de 2016, de PRESIDENT AND FELLOWS OF HARVARD COLLEGE: Un compuesto de la fórmula: **Fórmula** o su sal o tautómero, en donde R3 es hidrógeno; halógeno; alifático cíclico o acíclico, sustituido o no sustituido, ramificado […]
 Agente profiláctico o terapéutico para trastorno de déficit de atención con hiperactividad, del 16 de Julio de 2014, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Un agente profiláctico o terapéutico para uso en el tratamiento o prevención del trastorno de déficit de atención con hiperactividad, que comprende (S)-N-[2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-il)etil]propionamida […]
Agente profiláctico o terapéutico para trastorno de déficit de atención con hiperactividad, del 16 de Julio de 2014, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Un agente profiláctico o terapéutico para uso en el tratamiento o prevención del trastorno de déficit de atención con hiperactividad, que comprende (S)-N-[2-(1,6,7,8-tetrahidro-2H-indeno[5,4-b]furan-8-il)etil]propionamida […]
 Boronoptalidas sustituidas con halógeno para el tratamiento de infecciones, del 18 de Julio de 2013, de ANACOR PHARMACEUTICALS, INC: Un producto para uso como medicamento, seleccionado de un compuesto que tiene la estructura:
y sus sales farmacéuticamente aceptables, en donde […]
Boronoptalidas sustituidas con halógeno para el tratamiento de infecciones, del 18 de Julio de 2013, de ANACOR PHARMACEUTICALS, INC: Un producto para uso como medicamento, seleccionado de un compuesto que tiene la estructura:
y sus sales farmacéuticamente aceptables, en donde […]
Derivados en el anillo de lactona de triptolida como inmunomoduladores y agentes anticáncer, del 25 de Abril de 2012, de PHARMAGENESIS, INC.: Un compuesto que tiene la estructura I: donde R1 es alquilo, alquenilo, alquinilo, arilalquilo, arilo, arilacilo o C(OH)R4R5, Donde arilacilo es -C(O)R y […]
USO DE DERIVADOS DE PARTENOLIDA COMO AGENTES ANTILEUCÉMICOS Y CITOTÓXICOS, del 25 de Noviembre de 2011, de UNIVERSITY OF KENTUCKY RESEARCH FOUNDATION: Compuesto de la fórmula: **Fórmula** donde: •R1 es hidrógeno, alquilo, alquilo sustituido, hidroxialquilo, alquenilo, alquenilo sustituido, alquinilo, […]