Procedimientos y medios para el salto eficiente del exón 45 en el pre-ARNm de la distrofia muscular de Duchenne.
Un oligonucleótido antisentido que comprende la secuencia nucleotídica SEC ID N.º: 3.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/NL2009/050006.
Solicitante: PROSENSA TECHNOLOGIES B.V.
Nacionalidad solicitante: Países Bajos.
Dirección: J.H. Oortweg 21 2333 CH Leiden PAISES BAJOS.
Inventor/es: VAN OMMEN,GARRIT-JAN BOUDEWIJN, VAN DEUTEKOM,JUDITH CHRISTINA THEODORA, DE KIMPE,Josephus Johannes, PLATENBURG,Gerardus Johannes, AARTSMA-RUS,ANNEMIEKE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/7105 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Acidos ribonucleicos naturales, es decir conteniendo unicamente ribosas unidas a la adenina, la guanina, la citosina, o el uracilo y teniendo enlaces 3'-5' fosfodiester.
- C12N15/11 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
PDF original: ES-2532634_T3.pdf
Fragmento de la descripción:
Procedimientos y medios para el salto eficiente del exón 45 en el pre-ARNm de la distrofia muscular de Duchenne Campo La invención se refiere al campo de la genética, más específicamente de la genética humana. La invención en particular se refiere a la modulación de ayustamiento en el pre-ARNm de la distrofia muscular de Duchenne humana.
Antecedentes de la invención Las miopatías son trastornos que dan como resultado dificultad funcional de músculos. Distrofia muscular (MD) hace referencia a enfermedades genéticas que se caracterizan por debilidad y degeneración progresiva de los músculos esqueléticos. La distrofia muscular de Duchenne (DMD) y la distrofia muscular de Becker (BMD) son las formas infantiles más comunes de distrofia muscular. Son trastornos recesivos y debido a que el gen responsable de DMD y BMD reside en el cromosoma X, las mutaciones afectan principalmente a varones con una incidencia de aproximadamente 1 de cada 3500 niños.
DMD y BMD están causadas por defectos genéticos en el gen DMD que codifica distrofina, una proteína muscular que se requiere para interacciones entre el citoesqueleto y la matriz extracelular para mantener estabilidad de las fibras musculares durante la contracción. DMD es un trastorno grave, neuromuscular letal que da como resultado una dependencia del apoyo de una silla de ruedas antes de la edad de 12 años y los pacientes de DMD mueren frecuentemente antes de la edad de treinta debido a fallo respiratorio o a fallo cardiaco. En contraste, los pacientes de BMD frecuentemente mantienen su capacidad de andar hasta más adelante en su vida, y tienen expectativas de vida cercanas a las normales. Las mutaciones de DMD en el gen DMD se caracterizan principalmente por inserciones de cambio de marco o por deleciones o por mutaciones puntuales sin sentido, que dan como resultado la ausencia de distrofina funcional. Las mutaciones de BMD en general mantienen el marco de lectura intacto, permitiendo síntesis de una distrofina parcialmente funcional.
Durante la última década, la modificación específica de ayustamiento con el fin de restaurar la fase de lectura alterada del tránscrito de DMD ha surgido como una terapia prometedora para distrofia muscular de Duchenne (DMD) (van Ommen, van Deutekom, Aartsma-Rus, Curr Opin Mol Ther. 2008; 10 (2) : 140-9, Yokota, Duddy, Partidge, Acta Myol. 2007; 26 (3) : 179-84, van Deutekom et al., N Engl J Med. 2007; 357 (26) : 2677-86) .
Usando oligonucleótidos antisentido (AON) que interfieren con señales de ayustamiento se puede inducir el salto de exones específicos en el pre-ARNm de DMD, restaurando así la fase de lectura abierta y convirtiendo la DMD grave en un fenotipo de BMD más leve (van Deutekom et al. Hum Mol Genet. 2001; 10: 1547-54; Aartsma-Rus et al., Hum Mol Genet 2003; 12 (8) : 907-14.) . In vivo la prueba de concepto se obtuvo primero en el modelo de ratón de mdx, que es deficiente en distrofina debido a una mutación sin sentido en el exón 23. Las inyecciones intramuscular e intravenosa de AON que tienen como objetivo el exón mutado 23 restauran la expresión de distrofina durante al menos tres meses (Lu et al. Nat Med. 2003; 8: 1009-14; Lu et al., Proc Natl Acad Sci EE.UU. 2005;102 (1) : 198-203) . Esto se acompañó de restauración de proteínas asociadas a distrofina en la membrana de fibras así como de mejora funcional del músculo tratado. El salto in vivo de exones humanos se ha logrado en el modelo de ratón de hDMD, que contiene una copia completa del gen DMD humano integrado en el cromosoma 5 del ratón (Bremmer-Bout et al. Molecular Therapy. 2004;
10: 232-40; 't Hoen et al. J Biol Chem. 2008; 283: 5899-907) .
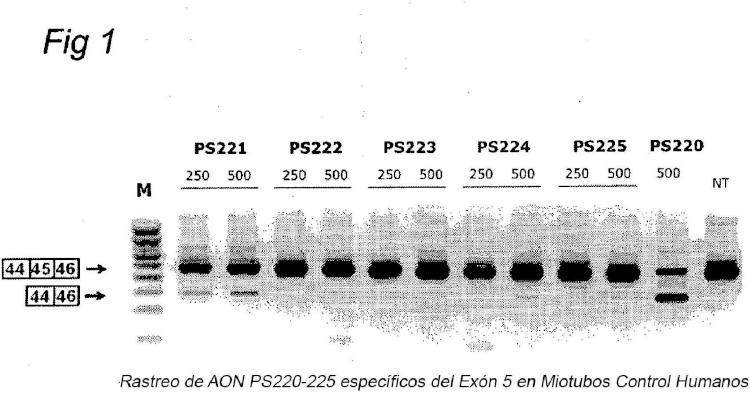
Como la mayoría de los pacientes de DMD tienen deleciones que se agrupan en zonas críticas, el salto de un número pequeño de exones es aplicable a números de pacientes relativamente grandes. La aplicabilidad real de el salto de exones puede determinarse por deleciones, duplicaciones y mutaciones puntuales comunicadas en bases de datos de mutaciones de DMD tales como la base de datos de mutación de DMD de Leiden disponible en www.dmd.nl. El salto terapéutico del exón 45 del pre-ARNm de DMD restauraría la fase de lectura abierta de pacientes de DMD que tienen deleciones incluyendo pero no limitadas a exones 12-44, 18-44, 44, 46, 46-47, 46-48, 46-49, 46-51, 46-53, 46-55, 46-59, 46-60 del pre-ARNm de DMD, que tienen lugar en un total del 16 % de todos los pacientes de DMD con una deleción (Aartsma-Rus y van Deutekom, 2007, Antisense Elements (Genetics) Research Focus, 2007 Nova Science Publishers, Inc.) . Además, para algunos pacientes de DMD se requiere el salto simultáneo de uno o más exones además del exón 45, tales como los exones 51 o 53 para restaurar la fase de lectura correcta. Ejemplos no limitantes incluyen pacientes con una deleción de exones 46-50 que requieren el co-salto de los exones 45 y 51, o con una deleción de exones 46-52 que requieren el co-salto de los exones 45 y 53.
Recientemente, se completó exitosamente un primer estudio en seres humanos donde un AON que induce el salto del exón 51 se inyectó en un área pequeña del músculo tibialis anterior de cuatro pacientes de DMD. Se observó expresión de distrofina novedosa en la mayoría de las fibras musculares en todos los cuatro pacientes tratados y el AON fue seguro y bien tolerado (van Deutekom et al. N Engl J Med. 2007; 357: 2677-86) .
La mayoría de los AON estudiados contienen hasta 20 nucleótidos y se ha argüído que este tamaño relativamente pequeño mejora la distribución tisular y/o la penetración celular de un AON. Sin embargo, tales AON cortos darán como resultado una especificidad limitada debida a un riesgo incrementado de la presencia de secuencias idénticas en otra parte en el genoma y una unión al objetivo limitada o una afinidad al objetivo limitada debida a una energía libre
baja del complejo objetivo de AON. Por lo tanto los autores de la invención decidieron diseñar oligonucleótidos antisentido nuevos y opcionalmente mejorados que no deberían presentar todos estos inconvenientes.
El documento WO2007/135105 divulga dos oligonucleótidos antisentido de menos de 21 nucleótidos que tienen como objetivo una subregión de SEC ID Nº : 2 del exón 45 del pre-ARNm de distrofina.
Descripción de la invención Procedimiento En un primer aspecto, la invención proporciona un procedimiento para inducir y/o promover el salto del exón 45 del pre-ARNm en un paciente, preferentemente en una célula aislada de dicho paciente, comprendiendo el procedimiento proporcionar a dicha célula y/o a dicho paciente un oligonucleótido antisentido que comprende la secuencia de nucleótidos SEC ID Nº : 3.
De acuerdo con ello, se suministra en este acto un procedimiento para inducir y/o promover salto del exón 45 de pre-ARNm de DMD, preferentemente en una célula aislada de un paciente, comprendiendo el procedimiento proveer a dicha célula y/o a dicho paciente con dichos oligonucleótidos antisentido.
Se entenderá que dicho procedimiento abarca un procedimiento in vitro, in vivo o ex vivo.
Según se define en el presente documento un pre-ARNm de DMD preferentemente quiere decir el pre-ARNm de un gen DMD o de un paciente de DMD o de BMD. El gen o la proteína de DMD corresponde al gen o la proteína de la distrofina.
Un paciente se desea preferentemente para querer decir un paciente que tiene DMD o BMD según se define más adelante en el presente documento o un paciente susceptible de desarrollar DMD o BMD debido a su origen genético.
En la divulgación, salto del exón se refiere a la inducción en una célula de un ARNm maduro que no contiene un exón particular que normalmente está presente en él. El salto del exón se logra proporcionando una célula que expresa el pre-ARNm de dicho ARNm con una molécula capaz de interferir con secuencias tales como, por ejemplo, la secuencia donante de ayustamiento o la secuencia aceptora de ayustamiento que se requieren ambas para mejorar el procedimiento enzimático de ayustamiento, o una molécula que es capaz de interferir con una señal de inclusión de exón requerida para el reconocimiento de un tramo de nucleótidos como un exón a incluirse en el ARNm. El término pre-ARNm se refiere a un ARNm precursor no procesado o procesado parcialmente que se sintetiza a partir de una plantilla de ADN en el núcleo celular por transcripción.
Dentro del contexto de la invención inducir y/o promover salto de un exón como se indica en el presente documento quiere decir que al menos el el 1 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 % o más del ARNm de DMD en una o más células (musculares) de un paciente tratado no contendrá dicho exón. Esto se valora preferentemente por PCR según se define... [Seguir leyendo]
Reivindicaciones:
1. Un oligonucleótido antisentido que comprende la secuencia nucleotídica SEC ID Nº : 3.
2. Un oligonucleótido antisentido de acuerdo con la reivindicación 1 que consiste en la secuencia nucleotídica antisentido SEC ID Nº : 3.
3. Un oligonucleótido antisentido de acuerdo con la reivindicación 1 o 2, en el que al menos uno de los nucleótidos es un análogo nucleotídico.
4. Un oligonucleótido antisentido de acuerdo con una cualquiera de las reivindicaciones 1-3, que comprende un residuo de ARN, y/o un residuo de ADN.
5. Un oligonucleótido antisentido de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en el que la secuencia del oligonucleótido antisentido comprende al menos un análogo nucleotídico, en el que un análogo nucleotídico se define como un residuo que tiene una base modificada, y/o un armazón modificado, y/o un enlace internucleosídico no natural, o una combinación de estas modificaciones.
6. Un oligonucleótido antisentido de acuerdo con la reivindicación 5, en el que el análogo nucleotídico tiene una base modificada.
7. Un oligonucleótido antisentido de acuerdo con la reivindicación 5, en el que el análogo nucleotídico tiene un armazón modificado.
8. Un oligonucleótido antisentido de acuerdo con una cualquiera de las reivindicaciones 1-6, en el que el análogo nucleotídico comprende uno o más restos de azúcar que están mono-o disustituidos en la posición 2', 3' y/o 5'.
9. Un oligonucleótido antisentido de acuerdo con cualquiera de las reivindicaciones 1 a 8, que comprende un oligonucleótido antisentido de fosforotioat.
2. O-alquil sustituido.
10. Un oligonucleótido antisentido de acuerdo con la reivindicación 9, que comprende una ribos.
2. O-metil-fosforotioato.
11. Un oligonucleótido antisentido de acuerdo con una cualquiera de las reivindicaciones 1-10, que comprende un oligonucleótido antisentido fosforotioato que comprende la secuencia de nucleótidos 5' uuugccgcug cccaaugcca uccug 3' (SEC ID Nº : 3) en la que los restos de azúcar están cada un.
2. O-metil sustituidos.
12. Un oligonucleótido antisentido que es un oligonucleótido antisentido fosforotioato que tiene la secuencia de nucleótidos 5' uuugccgcug cccaaugcca uccug 3' (SEC ID Nº : 3) en la que los restos de azúcar está.
2. O-metil sustituidos.
13. Un oligonucleótido antisentido de acuerdo con una cualquiera de las reivindicaciones 7-9, en el que el armazón modificado está seleccionado del grupo que consiste en un armazón morfolínico, un armazón de carbamato, un armazón de siloxano, un armazón de sulfuro, un armazón de sulfóxido, un armazón de sulfona, un armazón de formacetilo, un armazón de tioformacetilo, un armazón de metilenformacetilo, un armazón de riboacetilo, un armazón que contiene alquenos, un armazón de sulfamato, un armazón de sulfonato, un armazón de sulfonamida, un armazón de metilenimino, un armazón de metilenhidrazino y un armazón de amida.
14. Un oligonucleótido antisentido de acuerdo con una cualquiera de las reivindicaciones 1-10 o 13, que comprende oligómero de morfolino fosforodiamidato (PMO) , ácido nucleico peptídico y/o ácido nucleico bloqueado.
15. Un vector basado en virus, que comprende un casete de expresión que dirige la expresión del oligonucleótido antisentido según se define en la reivindicación 1 o 2.
16. Una composición farmacéutica que comprende un oligonucleótido antisentido según se define en una cualquiera de las reivindicaciones 1-14 y/o el vector de la reivindicación 15, un vehículo aceptable farmacéutico y opcionalmente combinado con un oligonucleótido antisentido que es capaz de inducir o promover el salto del exón 7, 44, 46, 51, 53, 59, 67 (como se representa en la tabla 2) del pre-ARNm de distrofina de un paciente.
17. El oligonucleótido antisentido según se define en una cualquiera de las reivindicaciones 1-14, el vector de la reivindicación 15, o la composición farmacéutica de la reivindicación 16, para inducir o promover el salto del exón 45, opcionalmente en combinación con el salto de uno de los exones 7, 44, 46, 51, 53, 59, 67, en el pre-ARNm de distrofina para usar en tratar a un paciente de DMD o a un paciente de BMD.
18. Un procedimiento in vitro para inducir o promover el salto del exón 45 de pre-ARNm de distrofina en un paciente, preferentemente en una célula aislada de dicho paciente, comprendiendo el procedimiento proveer a dicha célula con un oligonucleótido antisentido según se define en una cualquiera de las reivindicaciones 1-14, con el vector de la reivindicación 15, o con la composición farmacéutica de la reivindicación 16.
19. Un procedimiento in vitro de acuerdo con la reivindicación 18, en el que el paciente es provisto con una proteína distrofina funcional y/o en el que la producción de una proteína distrofina aberrante en dicho paciente está disminuida, en el que el nivel de dicha distrofina funcional es valorado por comparación con el nivel de dicha distrofina en dicho paciente en el comienzo del procedimiento.
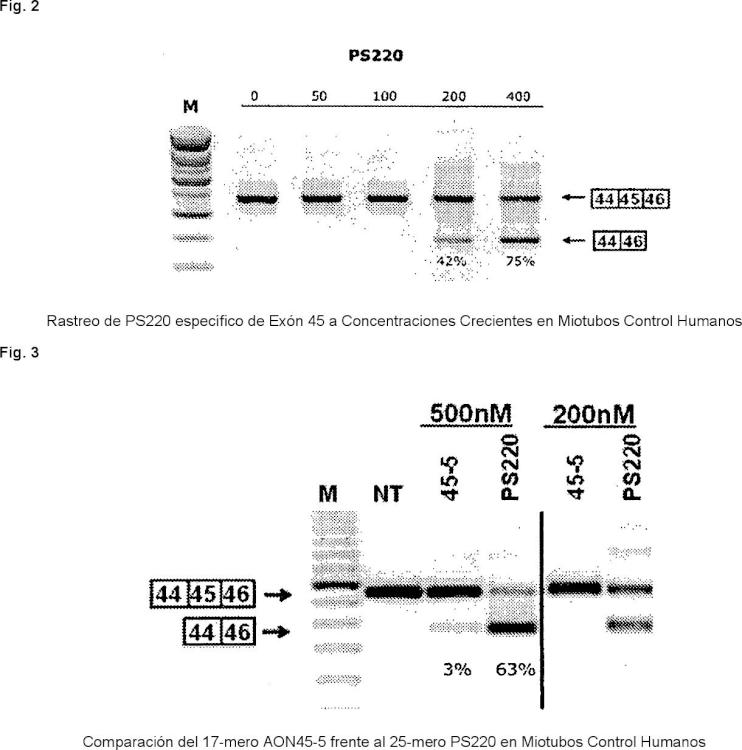
Fig. 2
Rastreo de PS220 específico de Exón 45 a Concentraciones Crecientes en Miotubos Control Humanos Fig. 3
Comparación del 17-mero AON45-5 frente a.
2. mero PS220 en Miotubos Control Humanos
Patentes similares o relacionadas:
Proteínas del factor VIII que tienen secuencias ancestrales, vectores de expresión, y usos relacionados con ellos, del 15 de Julio de 2020, de EMORY UNIVERSITY: Una proteína FVIII recombinante o quimérica que comprende una o más mutaciones ancestrales y una eliminación del dominio B, y en donde la secuencia […]
Vacuna subunitaria contra Mycoplasma spp., del 1 de Julio de 2020, de Agricultural Technology Research Institute: Una composición para prevenir una infección por Mycoplasma spp., que comprende: un principio activo, que comprende una proteína de PdhA; y un adyuvante […]
Método para romper un ácido nucleico y añadir un adaptador por medio de transposasa y reactivo, del 1 de Julio de 2020, de MGI Tech Co., Ltd: Un metodo para romper un acido nucleico y anadir un adaptador por medio de una transposasa, que comprende las siguientes etapas: interrumpir […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Oligonucleótidos para tratar una enfermedad ocular, del 13 de Mayo de 2020, de ProQR Therapeutics II B.V: Un oligonucleótido antisentido (OAS) que es capaz de inducir omisión del pseudoexón 40 (PE40) de pre-ARNm de USH2A humano, donde dicho OAS comprende una secuencia […]
Composiciones promotoras, del 6 de Mayo de 2020, de UNIVERSITY OF IOWA RESEARCH FOUNDATION: Una secuencia promotora aislada que comprende un ácido nucleico de entre 500 y 1700 nucleótidos de longitud que tiene por lo menos un 98% de identidad con la SEQ […]
Transfección mediada por células apoptóticas de células de mamífero con ARN de interferencia, del 22 de Abril de 2020, de LOMA LINDA UNIVERSITY: Una célula de mamífero apoptótica o preapoptótica para su uso en la prevención del rechazo de trasplantes, en la que la célula de mamífero […]
Ácidos ribonucleicos con nucleótidos modificados con 4-tio y procedimientos relacionados, del 15 de Abril de 2020, de Translate Bio, Inc: Una molécula de ARNm que tiene una región codificante y opcionalmente, una o más regiones no codificantes, en donde al menos el 25% de los residuos de nucleótidos del […]