Procedimientos de ensayo de la actividad enzimática alfa-L-iduronidasa.
Un procedimiento de ensayo de la actividad enzimática α-L-iduronidasa que comprende:
(a) incubar un sustrato de α-L-iduronidasa con α-L-iduronidasa durante un tiempo predeterminado, proporcionandouna disolución que comprende un producto de α-L-iduronidasa,
(b) inactivar la reacción enzimática, proporcionando una disolución de reacción inactivada,
(c) añadir un patrón interno de α-L-iduronidasa a la disolución de reacción inactivada, proporcionando unadisolución que comprende el producto de α-L-iduronidasa y patrón interno de α-L-iduronidasa; en el que el patróninterno tiene la fórmula (II):
en la que R es independientemente en cada aparición H o D y n es un entero de 2 a 12;
(d) extraer la disolución que comprende el producto de α-L-iduronidasa y patrón interno de α-L-iduronidasa con undisolvente orgánico, proporcionando una fase orgánica que incluye el producto de α-L-iduronidasa y patrón internode α-L-iduronidasa; y
(e) determinar la cantidad de producto de α-L-iduronidasa.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/073516.
Solicitante: UNIVERSITY OF WASHINGTON.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 4311 11th Avenue N.E., Suite 500 Seattle, WA 98105-4608 ESTADOS UNIDOS DE AMERICA.
Inventor/es: GELB,MICHAEL, BLANCHARD,SOPHIE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D311/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › Compuestos heterocíclicos que contienen ciclos de seis miembros que contienen un átomo de oxígeno como único heteroátomo, condensados con otros ciclos.
- C07D405/00 C07D […] › Compuestos heterocíclicos que contienen a la vez uno o más heterociclos que tienen átomos de oxígeno como únicos heteroátomos del ciclo y uno o más heterociclos que tienen átomos de nitrógeno como único heteroátomo del ciclo.
- C12Q1/34 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que interviene una hidrolasa.
- G01N33/49 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › de sangre.
- G01N33/50 G01N 33/00 […] › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
- G01N33/58 G01N 33/00 […] › en los que intervienen sustancias marcadas (G01N 33/53 tiene prioridad).
PDF original: ES-2396797_T3.pdf
Fragmento de la descripción:
Procedimientos de ensayo de la actividad enzimática a-L-iduronidasa [0001] Los programas de cribado neonatal se han establecido para cuantificar el nivel de metabolitos asociados con enfermedades tratables. La mucopolisacaridosis de tipo I (MPS-I) es un trastorno de almacenamiento lisosómico causado por la deficiencia de actividad enzimática de a-L-iduronidasa (IdA; EC 3.2.1.76) y puede manifestar tres fenotipos clínicos principales: síndromes de Hurler, Scheie y Hurler-Scheie.
La IdA es esencial para la degradación de los glucosaminoglucanos dermatano y sulfato de heparano en lisosomas. La incapacidad de descomponer estos polisacáridos causa cambios físicos tales como rigidez de articulaciones, anormalidades esqueléticas y opacidad corneal. El síndrome de Hurler se caracteriza por enfermedad cardiaca valvular, deterioro mental y muerte en la infancia. Como los síntomas pueden no reconocerse en la niñez, el diagnóstico de MPS-I supone un desafío. Se han desarrollado la terapia de sustitución enzimática y el transplante de médula ósea para esta enfermedad, y ambos son beneficiosos si se efectúan tempranamente. Debido a que es necesaria la detección temprana para una respuesta clínica óptima a la terapia, es de gran interés la necesidad de desarrollar cribados para el reconocimiento temprano de MPS-I.
La espectrometría de masas en tándem (EM en tándem o EMEM) es una plataforma para medir actividades enzimáticas asociadas a enfermedades usando gotas de sangre seca (GSS) rehidratadas para la medida cuantitativa de las actividades de las enzimas responsables de varios trastornos de almacenamiento lisosómico. Además de ensayos de ionización por electropulverización en espectrometría de masas en tándem (IEP-EMEM) , se han desarrollado ensayos fluorimétricos y radiométricos de a-L-iduronidasa.
Los tratamientos disponibles actualmente para MPS-I requieren una detección óptima para una respuesta clínica óptima a la terapia.
Wang y col. (2005) , Clin. Chem. 51 (5) , páginas 898 – 900, describen análisis espectrométricos de masas en tándem de gotas de sangre seca para cribado de mucopolisacaridosis I en neonatos.
Mandelli y col. (2002) , Arch. Med. Res. 33 (1) , páginas 20 – 24, describen la detección de heterocigotos de mucopolisacaridosis de tipo I basándose en las características bioquímicas de a-L-iduronidasa de leucocitos.
Hopwood y col., (1979) , Clin. Chim. Acta 92 (2) , páginas 257 – 265, describen un ensayo fluorimétrico que usa 4-metilumbeliferil-a-L-iduronida para la estimación de la actividad a-L-iduronidasa y la detección de los síndromes de Hurler y Scheie.
Por consiguiente, existe la necesidad de procedimientos para el cribado neonatal de la actividad de la enzima relevante a-L-iduronidasa. La presente invención satisface esta necesidad y proporciona ventajas relacionadas adicionales.
En un aspecto, la invención proporciona procedimientos de ensayo de la actividad enzimática a-Liduronidasa como se definen en las reivindicaciones.
El procedimiento incluye extraer una mezcla de reacción enzimática acuosa que comprende a-Liduronidasa, un producto de a-L-iduronidasa y un patrón interno de a-L-iduronidasa con un disolvente orgánico, proporcionando una fase orgánica que comprende el producto de a-L-iduronidasa y el patrón interno de a-Liduronidasa, y determinar la cantidad de producto de a-L-iduronidasa.
La invención proporciona un procedimiento de ensayo de la actividad enzimática a-L-iduronidasa que comprende
(a) incubar un sustrato de a-L-iduronidasa con una a-L-iduronidasa durante un tiempo predeterminado, proporcionando una disolución que comprende un producto de a-L-iduronidasa;
(b) añadir un tampón a la disolución que comprende el producto de a-L-iduronidasa, inactivando la reacción enzimática;
(c) añadir un patrón interno de a-L-iduronidasa (como se define en las reivindicaciones) a la disolución que comprende el producto de a-L-iduronidasa, proporcionando una disolución que comprende el producto de a-Liduronidasa y un patrón interno de a-L-iduronidasa;
(d) extraer la disolución que comprende el producto de a-L-iduronidasa y el patrón interno de a-L-iduronidasa con un disolvente orgánico, proporcionando una fase orgánica que incluye el producto de a-L-iduronidasa y un patrón interno de a-L-iduronidasa; y
(e) determinar la cantidad de producto de a-L-iduronidasa.
En una realización, la disolución que comprende a-L-iduronidasa se obtiene poniendo en contacto una muestra que contiene a-L-iduronidasa con una primera disolución tampón. En una realización, la muestra es una muestra de sangre. En una realización, la muestra es una gota de sangre seca de una tarjeta de cribado neonatal.
En una realización, el sustrato tiene la fórmula (I) :
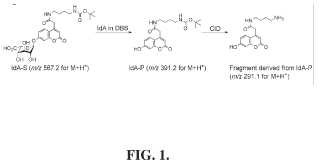
en la que m es un entero de 2 a 12. En una realización, el sustrato es (N-[4"- (terc-butoxicarbonilamino) -butil]) -7-O- (ácido a-L-idopiranosilurónico) cumarin-4-acetamida.
El patrón interno tiene la fórmula (II) :
en la que R es independientemente en cada aparición H o D y n es un entero de 2 a 12. En una realización, el patrón interno es (N-[3’- (terc-butoxicarbonilamino) propil]) -7-hidroxicumarin-4-acetamida.
En una realización, el disolvente orgánico es acetato de etilo.
En una realización, determinar la cantidad de producto de a-L-iduronidasa comprende determinar la relación de producto de a-L-iduronidasa a patrón interno de a-L-iduronidasa que comprende análisis espectrométrico de masas. En una realización, determinar la cantidad de producto de a-L-iduronidasa comprende análisis 30 espectrométrico de masas en tándem. En una realización, determinar la cantidad de producto de a-L-iduronidasa comprende análisis espectrométrico de masas en tándem en que los iones originales de producto y patrón interno se generan, aíslan y someten a disociación inducida por colisión, proporcionando iones fragmentarios del producto e iones fragmentarios del patrón interno. En una realización, determinar la cantidad de producto de a-L-iduronidasa comprende comparar las intensidades de pico de los iones fragmentarios del producto y los iones fragmentarios del
patrón interno para calcular la cantidad de producto de a-L-iduronidasa.
En una realización, el procedimiento incluye adicionalmente la etapa de usar la cantidad de producto de a-L-iduronidasa para determinar si la muestra de sangre seca es de un candidato al tratamiento por
mucopolisacaridosis de tipo I. [0018] Otras realizaciones del procedimiento de la invención incluyen: un procedimiento de ensayo de la actividad enzimática a-L-iduronidasa que comprende
(a) incubar un sustrato de a-L-iduronidasa con a-L-iduronidasa, proporcionando una mezcla de reacción enzimática que contiene un producto de a-L-iduronidasa,
(b) inactivar la reacción enzimática con una disolución tampón que comprende un patrón interno de a-L-iduronidasa como se define en las reivindicaciones,
(c) extraer la mezcla de reacción enzimática con un disolvente orgánico, proporcionando una fase orgánica que comprende el producto de a-L-iduronidasa y el patrón interno de a-L-iduronidasa, y
(d) determinar la cantidad de producto de a-L-iduronidasa; y un procedimiento de ensayo de la actividad enzimática a-L-iduronidasa que comprende
(a) incubar un sustrato de a-L-iduronidasa con a-L-iduronidasa en presencia de un patrón interno de a-L-iduronidasa (como se define en las reivindicaciones) , proporcionando una mezcla de reacción enzimática que contiene un producto de a-L-iduronidasa,
(b) inactivar la reacción enzimática,
(c) extraer la mezcla de reacción enzimática con un disolvente orgánico, proporcionando una fase orgánica que comprende el producto de a-L-iduronidasa y un patrón interno de a-L-iduronidasa, y
(d) determinar la cantidad de producto de a-L-iduronidasa.
En otro aspecto de la invención, se proporciona un procedimiento para el cribado neonatal de mucopolisacaridosis de tipo I. En una realización, el procedimiento incluye:
(a) poner en contacto una muestra de sangre seca de una tarjeta de cribado neonatal con una primera disolución tampón, proporcionando una disolución que comprende a-L-iduronidasa;
(b) añadir un sustrato de a-L-iduronidasa a la disolución que comprende a-L-iduronidasa e incubar el sustrato con la enzima durante un tiempo predeterminado, proporcionando una disolución que comprende un producto de a-Liduronidasa;
(c) añadir un segundo tampón a la disolución que comprende el producto de a-L-iduronidasa, inactivando... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento de ensayo de la actividad enzimática a-L-iduronidasa que comprende:
(a) incubar un sustrato de a-L-iduronidasa con a-L-iduronidasa durante un tiempo predeterminado, proporcionando una disolución que comprende un producto de a-L-iduronidasa,
(b) inactivar la reacción enzimática, proporcionando una disolución de reacción inactivada,
(c) añadir un patrón interno de a-L-iduronidasa a la disolución de reacción inactivada, proporcionando una disolución que comprende el producto de a-L-iduronidasa y patrón interno de a-L-iduronidasa; en el que el patrón interno tiene la fórmula (II) :
en la que R es independientemente en cada aparición H o D y n es un entero de 2 a 12;
(d) extraer la disolución que comprende el producto de a-L-iduronidasa y patrón interno de a-L-iduronidasa con un disolvente orgánico, proporcionando una fase orgánica que incluye el producto de a-L-iduronidasa y patrón interno 20 de a-L-iduronidasa; y
(e) determinar la cantidad de producto de a-L-iduronidasa.
2. El procedimiento de la reivindicación 1, en el que la disolución que comprende a-L-iduronidasa se 25 obtiene poniendo en contacto una muestra que contiene a-L-iduronidasa con una primera disolución tampón.
3. El procedimiento de la reivindicación 2, en el que la muestra es una muestra de sangre.
4. El procedimiento de la reivindicación 2, en el que la muestra es una gota de sangre seca de una
tarjeta de cribado neonatal, comprendiendo preferiblemente además usar la cantidad de producto de a-L-iduronidasa para determinar si la muestra de sangre seca es de un candidato al tratamiento por mucopolisacaridosis de tipo I.
5. El procedimiento de la reivindicación 1, en el que el sustrato tiene la fórmula (I) :
en la que m es un entero de 2 a 12; o en la que el sustrato es (N-[4"- (terc-butoxicarbonilamino) butil]) -7-O- (ácido a-L-idopiranosilurónico) cumarin-45 acetamida.
6. El procedimiento de la reivindicación 1, en el que el patrón interno es (N-[3’- (tercbutoxicarbonilamino) propil]) -7-hidroxicumarin-4-acetamida.
7. El procedimiento de la reivindicación 1, en el que el disolvente orgánico se selecciona del grupo consistente en acetato de etilo, dietiléter, cloroformo, cloruro de metileno y butanol.
8. El procedimiento de la reivindicación 1, en el que determinar la cantidad de producto de a-L
iduronidasa comprende: 15
(a) determinar la relación de producto de a-L-iduronidasa a patrón interno de a-L-iduronidasa que comprende análisis espectrométrico de masas; o (b) análisis espectrométrico de masas en tándem; o 20
(c) análisis espectrométrico de masas en tándem en que los iones originales de producto y patrón interno se generan, aíslan y someten a disociación inducida por colisión, proporcionando iones fragmentarios de producto e iones fragmentarios de patrón interno;
preferiblemente en el que determinar la cantidad de producto de a-L-iduronidasa comprende comparar las intensidades de pico de los iones fragmentarios de producto y los iones fragmentarios de patrón interno para calcular la cantidad de producto de a-L-iduronidasa.
9. Un procedimiento para el cribado neonatal de mucopolisacaridosis de tipo I que comprende: 30
(a) poner en contacto una muestra de sangre seca de una tarjeta de cribado neonatal con una primera disolución tampón, proporcionando una disolución que comprende a-L-iduronidasa;
(b) añadir un sustrato de a-L-iduronidasa a la disolución que comprende a-L-iduronidasa e incubar el sustrato con la
enzima durante un tiempo predeterminado, proporcionando una disolución que comprende un producto de a-Liduronidasa;
(c) inactivar la reacción enzimática, proporcionando una disolución de reacción inactivada;
(d) añadir un patrón interno de a-L-iduronidasa a la disolución de reacción inactivada, proporcionando una disolución que comprende el producto de a-L-iduronidasa y patrón interno de a-L-iduronidasa; en el que el patrón interno tiene la fórmula (II) :
en la que R es independientemente en cada aparición H o D y n es un entero de 2 a 12;
(e) extraer la disolución que comprende el producto de a-L-iduronidasa y patrón interno de a-L-iduronidasa con un disolvente orgánico, proporcionando una fase orgánica que incluye el producto de a-L-iduronidasa y patrón interno 50 de a-L-iduronidasa;
(f) determinar la cantidad de producto de a-L-iduronidasa mediante análisis espectrométrico de masas en tándem que comprende:
(i) generar, aislar y someter los iones originales de producto y patrón interno a disociación inducida por colisión, proporcionando iones fragmentarios de producto e iones fragmentarios de patrón interno, y
(ii) comparar las intensidades de pico iónico de los iones fragmentarios de producto y los iones fragmentarios de patrón interno para calcular la cantidad de producto de a-L-iduronidasa; y 10
(g) usar la cantidad de producto de a-L-iduronidasa para predecir si el neonato es candidato al tratamiento por mucopolisacaridosis de tipo I.
10. Un compuesto de fórmula (I) : 15
en la que m es un entero de 2 a 12; 20 preferiblemente (N-[4"- (terc-butoxicarbonilamino) butil]) -7-O- (ácido a-L-idopiranosilurónico) -cumarin-4-acetamida.
11. Un compuesto de fórmula (II) :
en la que R es independientemente en cada aparición H o D y n es un entero de 2 a 12; preferiblemente (N-[3’- (terc-butoxicarbonilamino) propil]) -7-hidroxicumarin-4-acetamida. 30 12. Un procedimiento para el ensayo de la actividad enzimática a-L-iduronidasa que comprende:
(a) poner en contacto una muestra de sangre seca con una primera disolución tampón, proporcionando una disolución que comprende a-L-iduronidasa;
(b) añadir un sustrato de a-L-iduronidasa a la disolución que comprende a-L-iduronidasa e incubar el sustrato con la enzima durante un tiempo predeterminado, proporcionando una disolución que comprende un producto de a-L
iduronidasa; en el que el sustrato de a-L-iduronidasa tiene la fórmula (I) :
en la que m es un entero de 2 a 12;
(c) añadir un segundo tampón a la disolución que comprende el producto de a-L-iduronidasa para inactivar la reacción enzimática;
(d) separar el producto de a-L-iduronidasa de la reacción enzimática; y
(e) medir la intensidad de fluorescencia de una disolución que contiene el producto de a-L-iduronidasa.
13. El procedimiento de la reivindicación 12, en el que separar el producto de a-L-iduronidasa de la 15 reacción enzimática comprende extraer el producto de a-L-iduronidasa de la mezcla de reacción enzimática:
(a) con un disolvente orgánico; o (b) usando extracción en fase sólida. 20
14. Un procedimiento para el ensayo de la actividad enzimática a-L-iduronidasa que comprende:
(a) incubar un sustrato de a-L-iduronidasa con a-L-iduronidasa durante un tiempo predeterminado, proporcionando una disolución que comprende un producto de a-L-iduronidasa; en el que la incubación del sustrato de a-L
iduronidasa con a-L-iduronidasa se efectúa en presencia de un patrón interno de a-L-iduronidasa; en el que el patrón interno tiene la fórmula (II) :
en la que R es independientemente en cada aparición H o D y n es un entero de 2 a 12;
(b) inactivar la reacción enzimática, proporcionando una disolución de reacción inactivada;
(c) extraer la disolución que comprende el producto de a-L-iduronidasa y patrón interno de a-L-iduronidasa con un
disolvente orgánico, proporcionando una fase orgánica que incluye el producto de a-L-iduronidasa y patrón interno de a-L-iduronidasa; y
(d) determinar la cantidad de producto de a-L-iduronidasa.
15. Un procedimiento para el ensayo de la actividad enzimática a-L-iduronidasa que comprende: 5
(a) incubar un sustrato de a-L-iduronidasa con a-L-iduronidasa durante un tiempo predeterminado, proporcionando una disolución que comprende un producto de a-L-iduronidasa;
(b) inactivar la reacción enzimática, proporcionando una disolución de reacción inactivada, en el que inactivar la
reacción enzimática comprende añadir un tampón a la disolución que comprende el producto de a-L iduronidasa, en el que el tampón comprende un patrón interno de a-L-iduronidasa; en el que el patrón interno tiene la fórmula (II) :
en la que R es independientemente en cada aparición H o D y n es un entero de 2 a 12;
(c) extraer la disolución que comprende el producto de a-L-iduronidasa y patrón interno de a-L-iduronidasa con un disolvente orgánico, proporcionando una fase orgánica que incluye el producto de a-L-iduronidasa y patrón interno de a-L-iduronidasa; y
(d) determinar la cantidad de producto de a-L-iduronidasa.
16. Un procedimiento para el cribado neonatal de mucopolisacaridosis de tipo I que comprende:
(a) poner en contacto una muestra de sangre seca de una tarjeta de cribado neonatal con una primera disolución tampón, proporcionando una disolución que comprende a-L-iduronidasa;
(b) añadir un sustrato de a-L-iduronidasa a la disolución que comprende a-L-iduronidasa e incubar el sustrato con la enzima durante un tiempo predeterminado, proporcionando una disolución que comprende un producto de a-L
iduronidasa; en el que la incubación del sustrato de a-L-iduronidasa con a-L-iduronidasa se efectúa en presencia de un patrón interno de a-L-iduronidasa; en el que el patrón interno tiene la fórmula (II) :
en la que R es independientemente en cada aparición H o D y n es un entero de 2 a 12;
(c) inactivar la reacción enzimática, proporcionando una disolución de reacción inactivada;
(d) extraer la disolución que comprende el producto de a-L-iduronidasa y patrón interno de a-L-iduronidasa con un disolvente orgánico, proporcionando una fase orgánica que incluye el producto de a-L-iduronidasa y patrón interno de a-L-iduronidasa;
(e) determinar la cantidad de producto de a-L-iduronidasa mediante análisis espectrométrico de masas en tándem que comprende:
(i) generar, aislar y someter los iones originales de producto y patrón interno a disociación inducida por colisión,
proporcionando iones fragmentarios de producto e iones fragmentarios de patrón interno, y 10
(ii) comparar las intensidades de pico iónico de los iones fragmentarios de producto y los iones fragmentarios de patrón interno para calcular la cantidad de producto de a-L-iduronidasa; y
(f) usar la cantidad de producto de a-L-iduronidasa para predecir si el neonato es candidato al tratamiento por 15 mucopolisacaridosis de tipo I.
17. Un procedimiento para el cribado neonatal de mucopolisacaridosis de tipo I que comprende:
(a) poner en contacto una muestra de sangre seca de una tarjeta de cribado neonatal con una primera disolución 20 tampón, proporcionando una disolución que comprende a-L-iduronidasa;
(b) añadir un sustrato de a-L-iduronidasa a la disolución que comprende a-L-iduronidasa e incubar el sustrato con la enzima durante un tiempo predeterminado, proporcionando una disolución que comprende un producto de a-Liduronidasa;
(c) inactivar la reacción enzimática, proporcionando una disolución de reacción inactivada; en el que inactivar la reacción enzimática comprende añadir un tampón a la disolución que comprende el producto de a-L iduronidasa, en el que el tampón comprende un patrón interno de a-L-iduronidasa; en el que el patrón interno tiene la fórmula (II) :
en la que R es independientemente en cada aparición H o D y n es un entero de 2 a 12;
(d) extraer la disolución que comprende el producto de a-L-iduronidasa y patrón interno de a-L-iduronidasa con un disolvente orgánico, proporcionando una fase orgánica que incluye el producto de a-L-iduronidasa y patrón interno de a-L-iduronidasa;
(e) determinar la cantidad de producto de a-L-iduronidasa mediante análisis espectrométrico de masas en tándem,
que comprende: 40
(i) generar, aislar y someter los iones originales de producto y patrón interno a disociación inducida por colisión para proporcionar iones fragmentarios de producto e iones fragmentarios de patrón interno, y
(ii) comparar las intensidades de pico iónico de los iones fragmentarios de producto y los iones fragmentarios de 45 patrón interno para calcular la cantidad de producto de a-L-iduronidasa; y
(f) usar la cantidad de producto de a-L-iduronidasa para predecir si un neonato es candidato al tratamiento por mucopolisacaridosis de tipo I.
Patentes similares o relacionadas:
Kit de reactivos utilizado para detectar gastrina-17 y método de preparación y aplicación para el kit de reactivos, del 15 de Julio de 2020, de Shenzhen New Industries Biomedical Engineering Co., Ltd: Un kit para detectar gastrina-17, caracterizado porque comprende un componente A y un componente B, en donde el componente A es un primer […]
Inmunoensayos de canalización de oxígeno luminiscentes heterogéneos, del 15 de Julio de 2020, de SIEMENS HEALTHCARE DIAGNOSTICS INC.: Un kit que contiene un sistema de deteccion quimioluminiscente, comprendiendo el kit: (a) una composicion que comprende un compuesto quimioluminiscente activable […]
Determinación de enriquecimientos de trazadores de glucosa mediante espectrometría de masas, del 13 de Mayo de 2020, de Medizinische Universität Graz: Procedimiento para determinar, en una muestra, los enriquecimientos de un primer y, por lo menos, un segundo trazador marcado de una forma […]
Compuestos de tienopirrol y usos de los mismos como inhibidores de luciferasas procedentes de Oplophorus, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un compuesto de fórmula (I), o una sal del mismo: **(Ver fórmula)** en la que: la línea discontinua representa la presencia o ausencia de un enlace; X es […]
Etiqueta de epítopo y método de detección, captura y/o purificación de polipéptidos etiquetados, del 15 de Abril de 2020, de ChromoTek GmbH: Péptido epítopo aislado que tiene de 12 a 25 aminoácidos, en donde la secuencia de aminoácidos comprende una secuencia según se define en SEQ ID NO: 32 (X1X2RX4X5AX7SX9WX11X12), […]
Nanomateriales multicomponentes de Au y métodos de síntesis, del 15 de Abril de 2020, de THE CURATORS OF THE UNIVERSITY OF MISSOURI: Una nanoconstrucción de AuNP(DTDTPA)(biomolécula) que comprende una nanopartícula (NP) de Au, DTDTPA y una biomolécula, en donde DTDTPA es ácido dietilentriaminopentaacético […]
Tira para monitorizar concentraciones de analito, del 8 de Abril de 2020, de Biostrip ApS: Un procedimiento para medir la concentración de al menos un analito C en una muestra líquida, consistiendo dicho procedimiento en: i) aplicar una muestra […]
Indicadores fosforescentes, del 25 de Marzo de 2020, de UNIVERSITY OF HOUSTON: Un indicador fosforescente que comprende: una partícula fosforescente inorgánica; una cubierta que encapsula la partícula fosforescente inorgánica; y al menos […]