Procedimiento para purificar eritropoyetina pegilada.
Un procedimiento para la obtención de una proteína que comprende eritropoyetina y un solo residuo de polietilenglicol,
que comprende las siguientes etapas:
a) aplicar una solución que comprende una mezcla de eritropoyetina y conjugados de eritropoyetina y polietilenglicol con uno o más residuos de polietilenglicol por molécula de eritropoyetina a una columna que comprende material de cromatografía SP Sephacryl S 500 HR, a la que se ha aplicado una solución con una conductividad de aproximadamente 21 mS/cm,
b) aplicar una solución con una conductividad de aproximadamente 21 mS/cm a la columna y recuperar así el polietilenglicol libre y las proteínas que comprenden dos o más residuos de polietilenglicol,
c) aplicar una solución de conductividad creciente de forma continua y lineal hasta un valor final de al menos 62,5 mS/cm a la columna y recuperar así separadamente la proteína que comprende eritropoyetina y un solo residuo de polietilenglicol y eritropoyetina, mediante lo cual se obtiene en primer lugar la proteína que comprende eritropoyetina y un solo residuo de etilenglicol,
en el que la solución con una conductividad de aproximadamente 21 mS/cm es una solución con un valor de pH de pH 2,5 a pH 3,5.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2011/065888.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Inventor/es: KUHNE, WOLFGANG, FALKENSTEIN,Roberto, SCHURIG,Hartmut, KOEHNLEIN,WOLFGANG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K47/48
- B01D15/36 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01D SEPARACION (separación de sólidos por vía húmeda B03B, B03D, mesas o cribas neumáticas B03B, por vía seca B07; separación magnética o electrostática de materiales sólidos a partir de materiales sólidos o de fluidos, separación mediante campos eléctricos de alta tensión B03C; aparatos centrifugadores B04B; aparato de vórtice B04C; prensas en sí para exprimir los líquidos de las sustancias que los contienen B30B 9/02). › B01D 15/00 Procedimientos de separación que implican el tratamientos de líquidos con absorbentes sólidos; Aparatos para ello. › implicando la interacción iónica, p.ej. intercambio de iones, supresión de iones o exclusión de iones.
PDF original: ES-2500048_T3.pdf



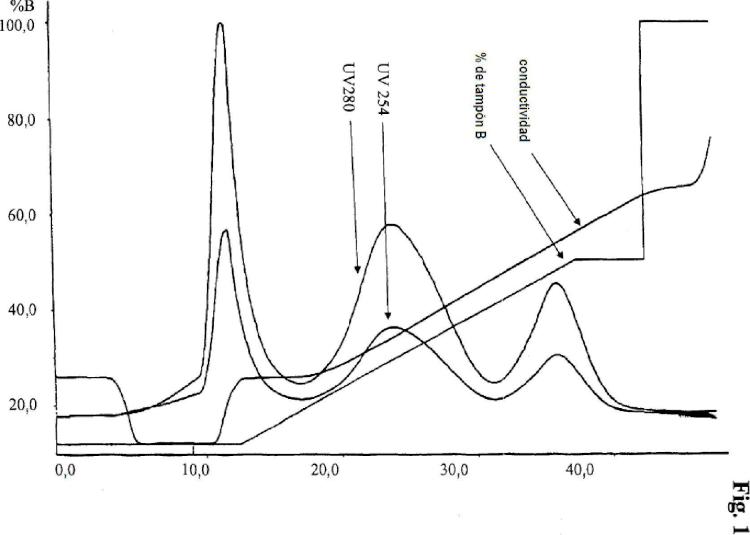
Fragmento de la descripción:
Procedimiento para purificar eritropoyetina pegilada Se reseña en la presente memoria un procedimiento para purificar eritropoyetina PEGilada con un procedimiento de elución en gradiente lineal en una columna SP Sephacr y l S 500 HR.
Antecedentes de la invención Las proteínas desempeñan un papel importante en la cartera médica actual. Para aplicación humana, cada proteína terapéutica tiene que satisfacer distintos criterios. Para asegurar la seguridad de los agentes biofarmacéuticos frente a seres humanos, los subproductos que se acumulan durante el proceso de producción tienen que retirarse especialmente. Para cumplir los reglamentos reguladores, tienen que seguir al proceso de fabricación una o más etapas de purificación. Entre otras cosas, pureza, productividad y rendimiento desempeñan un papel importante en la determinación de un proceso de purificación apropiado.
Se han reseñado conjugados de proteínas terapéuticas, por ejemplo, para polietilenglicol (PEG) e interleucina 6 (documento EP 0.442.724) , para PEG y eritropoyetina (documento WO 01/02017) , para moléculas quiméricas que comprenden endostatina e inmunoglobulinas (documento (US 2005/008649) , para proteínas de fusión basadas en anticuerpo secretadas (documento US 2002/147311) , para polipéptidos de fusión que comprenden albúmina (documento US 2005/0100991; seroalbúmina humana, documento US 5.876.969) , para polipéptidos PEGilados (documento US 2005/0114037) y para fusiones de eritropoyetina.
Necina, R., et al. (Biotechnol. Bioeng. 60 (1998) 689-698) ha reseñado la captura de anticuerpos monoclonales humanos directamente de sobrenadantes de cultivo celular por medios de intercambio iónico que exhiben una alta densidad de carga. En el documento WO 89/05157, se reseña un procedimiento para la purificación de inmunoglobulinas de producto sometiendo directamente el medio de cultivo celular a un tratamiento de intercambio catiónico. Se describe una purificación de una etapa de anticuerpos monoclonales de IgG de ascitis de ratón por Danielsson, A., et al., J. Immun. Meth. 115 (1988) 79-88. Se reseña un procedimiento para purificar un polipéptido por cromatografía de intercambio iónico en el documento WO 2004/024866, en que se usa un lavado en gradiente para resolver un polipéptido de interés de uno o más contaminantes. En el documento EP 0.530.447, se reseña un proceso para purificar anticuerpos monoclonales de IgG mediante una combinación de tres etapas cromatográficas. Se reseña una purificación sencilla de antagonista de receptor de interleucina 1 mono-PEGilado por Yu, G., et al., Process Biotechnol. 42 (2007) 971-977. Wang, H., et al., Peptides 26 (2005) 1213-1218 reseña la purificación de hTFF3 expresada en E. coli mediante una cromatografía de intercambio catiónico de dos etapas. Yun, Q., et al. (Yun, Q., et al., J. Biotechnol. 118 (2005) 67-74) reseña la purificación de rhG-CSF PEGilada mediante dos etapas de cromatografía de intercambio iónico consecutivas. Los documentos WO 2009/010271 y WO 2009/010270 dan a conocer un procedimiento de purificación de eritropoyetina PEGilada en dos etapas de cromatografía.
Sumario de la invención Se reseña en la presente memoria un procedimiento para la purificación de un conjugado de proteína que comprende eritropoyetina y un solo residuo de polietilenglicol de los subproductos de reacción o material de partida no reaccionado mediante un procedimiento de cromatografía de intercambio catiónico. Se ha encontrado que,
empleando el material de cromatografía de intercambio catiónico SP Sephacr y l S 500 HR y elución en gradiente lineal, mediante lo cual se ha aplicado a la columna una solución tamponada de una conductividad definida por adelantado, puede obtenerse la proteína conjugada que comprende eritropoyetina y un solo residuo de polietilenglicol en una sola etapa con alta pureza y rendimiento.
Por tanto, se reseña en la presente memoria como un aspecto un procedimiento para obtener una proteína de fusión que comprende eritropoyetina y un solo residuo de polietilenglicol que comprende las siguientes etapas:
a) aplicar una solución con una conductividad de aproximadamente 21 mS/cm a una columna de cromatografía que comprende el material de cromatografía SP Sephacr y l S 500 HR, 55
b) aplicar una solución que comprende una mezcla de eritropoyetina libre así como proteínas de fusión de eritropoyetina y polietilenglicol con uno o más residuos de polietilenglicol por molécula de eritropoyetina a la columna de a) ,
c) aplicar una solución con una conductividad de aproximadamente 21 mS/cm a la columna y recuperar así las proteínas de fusión que comprenden dos o más residuos de polietilenglicol,
d) aplicar una solución de conductividad creciente de forma continua y lineal hasta un valor final de al menos 60 mS/cm a la columna y recuperar así separadamente la proteína de fusión que comprende eritropoyetina 65 y un solo residuo de polietilenglicol y la eritropoyetina libre, mediante lo cual se obtiene en primer lugar la
proteína de fusión que comprende eritropoyetina y un solo residuo de polietilenglicol.
En una realización, la solución con una conductividad de aproximadamente 21 mS/cm es una solución con un valor de pH de pH 2, 5 a pH 3, 5. En una realización, la solución con una conductividad de aproximadamente 21 mS/cm es una solución tamponada con fosfato con un valor de pH de pH 2, 5 a pH 3, 5.
En una realización, la solución aplicada en la etapa d) tiene un valor de pH de pH 2, 5 a pH 3, 5. En una realización, la aplicación de una solución de conductividad creciente de forma continua y lineal es hasta un valor de conductividad final de aproximadamente 70, 0 mS/cm.
En una realización, la solución de conductividad creciente de forma continua y lineal es una solución de concentración de cloruro de sodio creciente de forma continua y lineal.
En una realización, la eritropoyetina es eritropoyetina humana. En una realización, la eritropoyetina humana tiene la secuencia aminoacídica de SEQ ID NO: 01 o SEQ ID NO: 02.
En una realización, el único residuo de polietilenglicol tiene un peso molecular de 20 a 40 kDa.
En una realización, la solución que comprende una mezcla de eritropoyetina libre y proteínas de fusión de eritropoyetina y polietilenglicol con uno o más residuos de polietilenglicol por molécula de eritropoyetina se aplica al material de cromatografía de modo que se aplique de 1 a 4 mg de proteína de fusión a 1 ml de material de cromatografía.
Descripción de la invención Se reseña en la presente memoria un procedimiento para purificar una proteína que comprende una molécula de eritropoyetina y un residuo de polietilenglicol, con un procedimiento de elución en gradiente en el que el gradiente es un gradiente lineal de conductividad en una columna SP Sephacr y l S 500 HR, mediante lo cual se aplica una solución de conductividad definida a la columna de cromatografía antes de la aplicación de la solución que comprende la proteína.
Los procedimientos cromatográficos generales y su uso son conocidos para un especialista en la materia. Véanse, por ejemplo, Heftmann, E., (ed.) , “Chromatography”, 5ª edición, “Part A: Fundamentals and Techniques”, Elsevier Science Publishing Company, Nueva York (1992) ; Deyl, Z., (ed.) , “Advanced Chromatographic and Electromigration Methods in Biosciences”, Elsevier Science BV, Amsterdam, Holanda (1998) ; Poole, C.F. y Poole, S.K., “Chromatography Today”, Elsevier Science Publishing Company, Nueva York (1991) ; Scopes, “Protein Purification: Principles and Practice”, Springer Verlag (1982) ; Sambrook, J., et al., (eds.) , ”Molecular Cloning: A Laborator y Manual”, 2ª edición, Cold Spring Harbor Laborator y Press, Cold Spring Harbor, N.Y., (1989) o Ausubel, F.M., et al., (eds.) , “Current Protocols in Molecular Biology”, John Wiley & Sons, Inc., Nueva York (1987-1994) .
El término “aplicar a” designa una etapa parcial de un procedimiento de purificación en que se pone en contacto una solución con un material de cromatografía. Esto designa que a) la solución se añade a un dispositivo cromatográfico en que está contenido el material de cromatografía o b) el material de cromatografía se añade a la solución. En el caso a) , la solución pasa a través del dispositivo, permitiendo una interacción entre el material de cromatografía y las sustancias contenidas en la solución. Dependiendo de las condiciones, tales como por ejemplo pH, conductividad, concentración salina, temperatura y/o caudal, algunas sustancias de la solución se unen al material de cromatografía y, por... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para la obtención de una proteína que comprende eritropoyetina y un solo residuo de polietilenglicol, que comprende las siguientes etapas: 5
a) aplicar una solución que comprende una mezcla de eritropoyetina y conjugados de eritropoyetina y polietilenglicol con uno o más residuos de polietilenglicol por molécula de eritropoyetina a una columna que comprende material de cromatografía SP Sephacr y l S 500 HR, a la que se ha aplicado una solución con una conductividad de aproximadamente 21 mS/cm,
b) aplicar una solución con una conductividad de aproximadamente 21 mS/cm a la columna y recuperar así el polietilenglicol libre y las proteínas que comprenden dos o más residuos de polietilenglicol, c) aplicar una solución de conductividad creciente de forma continua y lineal hasta un valor final de al menos 62, 5 mS/cm a la columna y recuperar así separadamente la proteína que comprende eritropoyetina y un solo residuo de polietilenglicol y eritropoyetina, mediante lo cual se obtiene en primer lugar la proteína que comprende eritropoyetina y un solo residuo de etilenglicol,
en el que la solución con una conductividad de aproximadamente 21 mS/cm es una solución con un valor de pH de pH 2, 5 a pH 3, 5.
2. El procedimiento según la reivindicación 1, caracterizado porque la solución con una conductividad de aproximadamente 21 mS/cm es una solución tamponada con fosfato con un valor de pH de pH 2, 5 a pH 3, 5.
3. El procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque la solución que comprende una mezcla de eritropoyetina y conjugados de eritropoyetina y polietilenglicol con uno más residuos de polietilenglicol por molécula de eritropoyetina no está ajustada a una conductividad de aproximadamente 21 mS/cm.
4. El procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque la solución con conductividad creciente de forma lineal es una solución de concentración de cloruro de sodio creciente 30 de forma lineal.
5. El procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque la solución con conductividad creciente de forma lineal tiene un valor de pH de pH 2, 3 a pH 3, 5.
6. El procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque la eritropoyetina es eritropoyetina humana.
7. El procedimiento según la reivindicación 6, caracterizado porque la eritropoyetina humana tiene la secuencia aminoacídica de SEQ ID NO: 01 o SEQ ID NO: 02. 40
8. El procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque el único residuo de polietilenglicol tiene un peso molecular de 20 a 40 kDa.
Patentes similares o relacionadas:
Derivativos del ácido siálico para la derivatización y conjugación de proteínas, del 20 de Diciembre de 2019, de LIPOXEN TECHNOLOGIES LIMITED: Un procedimiento de producción de un derivativo aldehído de un ácido siálico en el que un material de partida que tiene una unidad de ácido siálico en el […]
GELES DE QUITOSANO(A) CONTENIENDO NANOPARTICULAS METALICAS DE COBRE, PLATA Y ANTIBIOTICOS (CIPROFLOXACINO, CEFOTAXIME, GENTAMICINA Y CLOXACILINA), del 12 de Diciembre de 2019, de CARDENAS Y CIA LTDA: En la presente invención se describen geles de quitosano (poli-beta-glucosamina) con propiedades bactericidas y fungicidas en mezcla con nanopartículas […]
Compuestos de polímero de polialquileno y usos de los mismos, del 20 de Noviembre de 2019, de Biogen MA Inc: Una composición farmacéutica que comprende un conjugado y un vehículo, adyuvante, diluyente, conservante y/o solubilizante farmacéuticamente […]
Composiciones y métodos para la liberación dirigida de fármacos in vitro e in vivo a células de mamíferos mediante minicélulas intactas derivadas de bacterias, del 23 de Octubre de 2019, de ENGENEIC MOLECULAR DELIVERY PTY LTD: Una composición que comprende: (a) una pluralidad de minicélulas intactas derivadas de bacterias que tienen paredes celulares intactas, en donde la pluralidad […]
Moléculas con semividas prolongadas, composiciones y usos de las mismas, del 16 de Octubre de 2019, de MEDIMMUNE, LLC: Una molécula modificada que comprende una proteína o agente no de proteína y un dominio constante de IgG, en la que el dominio constante de IgG comprende un dominio CH3 humano […]
Método para la preparación de oligo etilenglicol monodisperso, del 19 de Junio de 2019, de NEKTAR THERAPEUTICS: Un método para preparar un oligo (etilenglicol) monodisperso, comprendiendo dicho método: (i) hacer reaccionar un oligo (etilenglicol) terminado […]
Construcciones de moléculas MHC y sus usos para el diagnóstico y terapia, del 29 de Mayo de 2019, de DAKO DENMARK A/S: Una construcción de moléculas MHC en forma soluble en un medio de solubilización o inmovilizada en un soporte sólido o semi-sólido, comprendiendo dicha construcción de moléculas […]
Usos terapéuticos de anticuerpos monoclonales frente al receptor de la angiotensina II tipo 1, del 17 de Mayo de 2019, de QUEEN MARY AND WESTFIELD COLLEGE: Un anticuerpo monoclonal o un fragmento del mismo que se une al péptido que consiste en la secuencia EDGIKRIQDD para su uso en el tratamiento de la proliferación […]