Procedimiento para la preparación de benzonorbornenos.
Un procedimiento para la preparación de 9-diclorometilen-1,2,3,4-tetrahidro-1,4-metano-naftalen-5-ilamina defórmula I:
**Fórmula**
procedimiento que comprende:
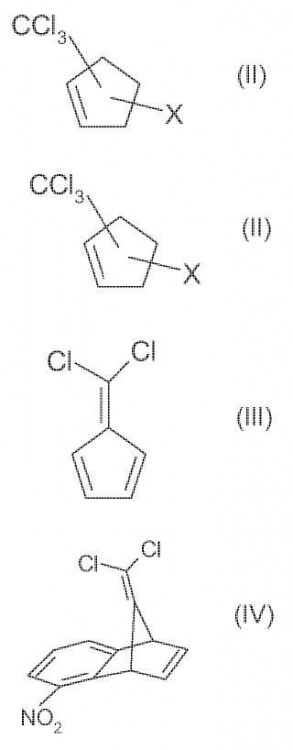
a ) hacer reaccionar ciclopentadieno con CXCl3, en la que X es cloro o bromo, en presencia de un iniciador deradicales a un compuesto de fórmula II:**Fórmula**
en la que X es cloro o bromo,o
aa) hacer reaccionar ciclopentadieno con CXCl3, en la que X es cloro, en presencia de un catalizador de metal aun compuesto de fórmula II**Fórmula**
en la que X es cloro,
b) hacer reaccionar el compuesto de fórmula II con una base en presencia de un disolvente apropiado al compuestode fórmula III:**Fórmula**
c) y convertir el compuesto de fórmula III en presencia de 1,2-deshidro-6-nitrobenceno al compuesto de fórmula IV:**Fórmula**
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2009/062525.
Solicitante: SYNGENTA PARTICIPATIONS AG.
Nacionalidad solicitante: Suiza.
Dirección: SCHWARZWALDALLEE 215 4058 BASEL SUIZA.
Inventor/es: DE MESMAEKER, ALAIN, WALTER, HARALD, GIORDANO,FANNY, GRIBKOV,DENIS, ANTELMANN,BJÖRN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07C17/25 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 17/00 Métodos de preparación de hidrocarburos halogenados. › por eliminación de haluros de hidrógeno de hidrocarburos halogenados.
- C07C205/12 C07C […] › C07C 205/00 Compuestos que contienen grupos nitro unidos a una estructura carbonada. › estando sustituido por átomos de halógeno el ciclo aromático de seis miembros o un sistema cíclico condensado que contenga este ciclo.
- C07C211/61 C07C […] › C07C 211/00 Compuestos que contienen grupos amino unidos a una estructura carbonada. › con al menos uno de los sistemas cíclicos condensados formado por tres ciclos o más.
- C07C22/02 C07C […] › C07C 22/00 Compuestos cíclicos que contienen átomos de halógeno unidos a un átomo de carbono acíclico. › que tienen una insaturación en los ciclos.
- C07C23/08 C07C […] › C07C 23/00 Compuestos que contienen al menos un halógeno unido a un ciclo distinto que un ciclo aromático de seis miembros. › con ciclo de cinco miembros.
PDF original: ES-2431818_T3.pdf
Fragmento de la descripción:
Procedimiento para la preparación de benzonorbornenos.
La presente invención se refiere a la preparación de 9-diclorometilen-1, 2, 3, 4-tetrahidro-1, 4-metano-naftalen-5ilamina.
El compuesto 9-diclorometilen-1, 2, 3, 4-tetrahidro-1, 4-metano-naftalen-5-ilamina es un intermedio valioso para la preparación de fungicidas de benzonorborneno, como se describe por ejemplo en la patente internacional WO 2007/048556.
Se sabe a partir de la patente internacional WO 2007/048556 preparar 9-diclorometilen-1, 2, 3, 4-tetrahidro-1, 4metano-naftalen-5-ilamina por:
a) hacer reaccionar el compuesto de fórmula A
(A) en presencia de un nitrito de alquilo con un compuesto de fórmula B
(B) en la que R' y R" son por ej., alquilo C1-C4, a un compuesto de fórmula C:
b) hidrogenar el compuesto de fórmula C en presencia de un catalizador de metal adecuado a un compuesto de fórmula D:
c) ozonizar el compuesto de fórmula D con tratamiento posterior con un agente reductor a un compuesto de fórmula E:
d) hacer reaccionar el compuesto de fórmula E trifenilfosfina/tetracloruro de carbono a 2, 9-diclorometiliden-5-nitrobenzonorborneno de fórmula F:
y
e) hidrogenar el compuesto de fórmula F en presencia de un catalizador de metal a 9-diclorometilen-1, 2, 3, 4tetrahidro-1, 4-metano-naftalen-5-ilamina.
Una desventaja de este procedimiento de la técnica anterior es el gran número de etapas de reacción que disminuye el rendimiento del producto. Además, la reacción de ozonolisis que es difícil de manipular y la etapa d) cara que requiere el uso de trifenilfosfina hace este procedimiento no rentable e inadecuado para una producción a gran escala.
El objeto de la presente invención es por lo tanto proporcionar un nuevo procedimiento para la producción de 9diclorometilen-1, 2, 3, 4-tetrahidro-1, 4-metano-naftalen-5-ilamina que evite las desventajas del procedimiento conocido y haga posible preparar 9-diclorometilen-1, 2, 3, 4-tetrahidro-1, 4-metano-naftalen-5-ilamina con altos rendimientos y buena calidad de una manera económicamente ventajosa con menos etapas de reacción.
Así, según la presente invención, se proporciona un procedimiento para la preparación de 9-diclorometilen-1, 2, 3, 4tetrahidro-1, 4-metano-naftalen-5-ilamina de fórmula I
procedimiento que comprende:
a) hacer reaccionar ciclopentadieno con CXCI3, en la que X es cloro o bromo; preferiblemente bromo, en presencia de un iniciador de radicales a un compuesto de fórmula II:
en la que X es cloro o bromo,
o aa) hacer reaccionar ciclopentadieno con CXCI3, en la que X es cloro, en presencia de un catalizador de metal a un compuesto de fórmula II:
en la que X es cloro, b) hacer reaccionar el compuesto de fórmula II con una base en un disolvente apropiado al compuesto de fórmula III:
c) y convertir el compuesto de fórmula III en presencia de 1, 2-deshidro-6-nitrobenceno en el compuesto de fórmula IV:
y d) hidrogenar el compuesto de fórmula IV con una fuente de hidrógeno en presencia de un catalizador de metal. Una realización de este procedimiento comprende: a) hacer reaccionar ciclopentadieno con CXCI3, en la que X es cloro o bromo, en presencia de un iniciador de
radicales a un compuesto de fórmula II
en la que X es cloro o bromo. Etapa a) y aa) de la reacción: El compuesto de fórmula II puede tener lugar en los siguientes isómeros o mezclas de los mismos:
en las que X es cloro o bromo.
El producto de la etapa a) y aa) de la reacción se puede usar tal cual para la siguiente etapa b) de la reacción. No es necesario el aislamiento o la purificación de un isómero específico o una mezcla de isómeros de fórmula II. El compuesto de fórmula IV es nuevo y es desarrollado especialmente por el procedimiento según la invención y constituye por lo tanto un objeto más de la invención.
En principio se puede aplicar un gran número de iniciadores de radicales de las siguientes clases para la etapa a) de la reacción: peróxidos orgánicos (por ejemplo peróxido de metil etil cetona, peróxido de benzoílo) , azocompuestos orgánicos, sales y complejos de metal (Cu, Ru) . Se seleccionan iniciadores de radicales preferidos de: azobisisobutironitrilo, peróxido de dibenzoílo y bis (terc-butilciclohexil) peroxidicarbonato. Especialmente preferido es azobisisobutironitrilo.
La etapa a) de la reacción se realiza ventajosamente a temperaturas elevadas, preferiblemente a temperaturas de desde 20 a 100°C, preferiblemente de desde 60 a 100°C, lo más preferiblemente de desde 80 a 90°C. Se prefiere el uso de bromotriclorometano, especialmente en iniciación con peróxido o azocompuestos.
En la etapa aa) de la reacción especialmente preferida, se hace reaccionar ciclopentadieno con CCI4 en presencia de un catalizador de metal a un compuesto de fórmula II:
en la que X es cloro. Para la etapa aa) , la presencia de un iniciador de radicales no es necesaria, pero puede ser ventajoso para reducir carga de catalizador (uso de menos catalizador) .
Se seleccionan metales adecuados para los catalizadores por ejemplo de: rutenio, cobre, hierro, paladio y rodio. Catalizadores preferidos contienen complejos de rutenio (II) o cobre (I) . Catalizadores especialmente preferidos se seleccionan del grupo que consiste en: Ru (PPh3) 3Cl2, Ru (cumeno) PPh3CI2, Ru (Cp) PPh3CI2, Grubbs I (bencilidenbis (triciclohexilfosfino) -diclororutenio) y CuCI junto con un ligando amino, especialmente un ligando de diamina o triamina. Grubbs I, CuCI/tetrametiletilendiamina (TMEDA) o pentametildietilentriamina son los catalizadores más preferidos.
La etapa aa) de la reacción se puede realizar en presencia de un disolvente inerte, preferiblemente sin un disolvente cuando se usa un catalizador de Ru. La etapa aa) de la reacción se realiza ventajosamente a temperaturas elevadas, en particular a temperaturas de desde 20 a 100°C, preferiblemente de desde 60 a 100°C, lo más preferiblemente de desde 60° a 80°C. El producto de la etapa aa) de la reacción es una mezcla de los 3 posibles
isómeros. No es necesario el aislamiento o la purificación de un isómero específico o una mezcla de isómeros.
Una realización preferida de la etapa aa) de la reacción se puede realizar de manera eficaz por calentamiento de una mezcla de ciclopentadieno con 1, 5 a 3, en particular 2 equivalentes de tetracloruro de carbono en acetonitrilo en presencia de 0, 5 a 2% en moles, en particular 1% en moles de catalizador de cobre I, preferiblemente CuCI y 1 a 4% en moles, en particular 2% en moles de tetrametiletano-1, 2-diamina (TMEDA) para proporcionar rendimientos de 7080% aislado de producto después de destilación.
Añadir una cantidad catalítica (normalmente 1% en moles) de un iniciador de radicales como se mencionó anteriormente, especialmente N, N-azobisisobutironitrilo a la mezcla de reacción puede reducir la carga de catalizador (uso de menos catalizador) .
La etapa aa) de la reacción presenta más ventajas. El uso de CCI4 es menos caro, el producto de adición con tetracloruro de carbono (CTCM-ciclopenteno) es mucho más estable que el derivado de bromo (BTCMciclopenteno) , la reacción es mucho menos exotérmica y por lo tanto más adecuada para producción a gran escala y no se genera anión bromuro en la siguiente etapa.
En la etapa a) y aa) de la reacción, se usa CCl3Br o CCI4 en exceso a ciclopentadieno, preferiblemente 1, 5-5 equivalentes, en particular 2-3 equivalentes de CCl3Br o CCI4 para un ciclopentadieno equivalente.
Etapa b) de reacción:
Son bases preferidas para la etapa b) de reacción alcoholatos de metales alcalinos, por ejemplo terc-butóxido de sodio y terc-butóxido de potasio o amidas de metal como NaNH2 o diisopropilamida de litio. Excepto para cetonas y ésteres, se pueden usar todos los disolventes inertes. Los disolventes apropiados para la etapa b) de la reacción se seleccionan de metil terc-butil éter (MTBE) , metilciclohexano (MCH) o una mezcla de los mismos, tetrahidrofurano (THF) , diglime y tolueno.
Un disolvente apropiado más para la etapa b) de la reacción es clorobenceno.
La etapa b) de la reacción se realiza ventajosamente a un intervalo de temperatura de -20 a +20°C, preferiblemente a temperaturas de desde -10°C a 10°C, lo más preferiblemente de desde -5°C a 5°C.
En una realización preferida de la presente invención se usa el compuesto de fórmula III (su disolución) sin aislamiento directamente para la siguiente etapa de reacción. El compuesto de fórmula III es un intermedio valioso para la preparación del compuesto de fórmula I. El compuesto de fórmula III es conocido a partir de... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para la preparación de 9-diclorometilen-1, 2, 3, 4-tetrahidro-1, 4-metano-naftalen-5-ilamina de fórmula I:
procedimiento que comprende:
a ) hacer reaccionar ciclopentadieno con CXCl3, en la que X es cloro o bromo, en presencia de un iniciador de radicales a un compuesto de fórmula II:
en la que X es cloro o bromo,
o aa) hacer reaccionar ciclopentadieno con CXCl3, en la que X es cloro, en presencia de un catalizador de metal a un compuesto de fórmula II
en la que X es cloro,
b) hacer reaccionar el compuesto de fórmula II con una base en presencia de un disolvente apropiado al compuesto 15 de fórmula III:
c) y convertir el compuesto de fórmula III en presencia de 1, 2-deshidro-6-nitrobenceno al compuesto de fórmula IV:
y 20 d) hidrogenar el compuesto de fórmula IV con una fuente de hidrógeno en presencia de un catalizador de metal.
2. Un procedimiento según la reivindicación 1, procedimiento que comprende:
a) hacer reaccionar ciclopentadieno con CXCI3, en la que X es cloro o bromo, en presencia de un iniciador de radicales a un compuesto de fórmula II
en la que X es cloro o bromo.
3. El compuesto de fórmula IV
4. Un procedimiento para la preparación del compuesto de fórmula III
procedimiento que comprende:
a ) hacer reaccionar ciclopentadieno con CXCI3, en la que X es cloro o bromo, en presencia de un iniciador de radicales a un compuesto de fórmula II
en la que X es cloro o bromo, y b) hacer reaccionar el compuesto de fórmula II con una base en presencia de un disolvente apropiado.
5. Un procedimiento según la reivindicación 4, en el que X es bromo.
6. Un procedimiento según la reivindicación 1, en el que aa) se hace reaccionar ciclopentadieno con CCI4 en 15 presencia de un catalizador de metal a un compuesto de fórmula II
en la que X es cloro.
7. Un procedimiento según la reivindicación 1, procedimiento que comprende:
aa) hacer reaccionar ciclopentadieno con CXCI3, en la que X es cloro, en presencia de un catalizador de metal en el 20 que el componente de metal del catalizador es seleccionado de rutenio, cobre, hierro, paladio y rodio, a un compuesto de fórmula II
en la que X es cloro,
b) hacer reaccionar el compuesto de fórmula II con una base seleccionada de alcoholatos de metales alcalinos en presencia de un disolvente apropiado al compuesto de fórmula III
c ) y convertir el compuesto de fórmula III en presencia de 1, 2-deshidro-6-nitrobenceno en el compuesto de fórmula IV
y d) hidrogenar el compuesto de fórmula IV con una fuente de hidrógeno en presencia de un catalizador de metal.
Patentes similares o relacionadas:
2-Fluoro-3-nitrotolueno cristalino y procedimiento para la preparación del mismo, del 1 de Julio de 2020, de F.I.S. FABBRICA ITALIANA SINTETICI S.P.A: 2-Fluoro-3-nitrotolueno cristalino de Fórmula (I): **(Ver fórmula)** que tiene un pico de inicio de DSC a un valor entre 25,0 y 26,0 °C o que tiene un pico máximo de […]
Procedimiento de preparación de un compuesto mediante una novedosa reacción similar a Sandmeyer usando un compuesto de radical nitróxido como catalizador de reacción, del 23 de Agosto de 2017, de DAIICHI SANKYO COMPANY, LIMITED: Un procedimiento de preparación de un compuesto representado por la fórmula (11b) siguiente:**Fórmula** en el que el procedimiento comprende: añadir y disolver un […]
Compuestos de 1,3-diona bicíclica herbicidamente activos, del 14 de Junio de 2017, de SYNGENTA LIMITED: Compuestos de fórmula I**Fórmula** donde R1 es metilo, etilo, n-propilo, iso-propilo, ciclopropilo, halometilo, haloetilo, halógeno, vinilo, etinilo, metoxi, […]
Proceso para la síntesis de compuestos orgánicos, del 8 de Febrero de 2016, de NOVARTIS AG: Un proceso para preparar 1-bromo-3-nitro-5-trifluoro-metil-benceno que comprende tratar 1-nitro-3-trifluoro-metilbenceno con el agente bromante 1,3-dibromo-5,5-dimetilhidantoína, […]
Procedimiento de tetraarilborato para la preparación de bifenilos sustituidos, del 14 de Enero de 2015, de Bayer Intellectual Property GmbH: Procedimiento para la preparación de bifenilos sustituidos de fórmula (I)**Fórmula** en la que X1 se selecciona de átomos de halógeno y grupos alquilo […]
Compuesto de benzamida sustituida con isoxazolina y agente de control de organismos nocivos, del 1 de Octubre de 2014, de NISSAN CHEMICAL INDUSTRIES, LTD.: Un compuesto de benzamida sustituida con isoxazolina de fórmula o una sal del mismo:**Fórmula** en la que A1, A2 y A3 independientemente […]
Compuestos arilindólicos sustituidos y sus metabolitos de tipo kinurenina/kinuramina como agentes terapéuticos, del 27 de Agosto de 2014, de NEURIM PHARMACEUTICALS (1991) LIMITED: Un compuesto seleccionado entre: (a) N-(2-carboxi-4-nitrofenil)triptamina, (b) N-(2-bromo-4-nitrofenil)-5-metoxitriptamina, (c) N-(4-bromo-2-nitrofenil)-5-metoxitriptamina, (d)…
DERIVADOS DE AMIDAS HETEROCÍCLICAS ÚTILES COMO MICROBIOCIDAS, del 14 de Marzo de 2011, de SYNGENTA PARTICIPATIONS AG: Un compuesto de fórmula (I): en donde Het es un anillo heterocíclico de 6 ó 5 miembros que contiene 1 a 3 heteroátomos, seleccionado cada […]