PROCEDIMIENTO Y APARATO PARA ASISTENCIA EN ABLACIÓN DE ARRÍTMIAS.
La presente invención se refiere a un procedimiento que comprende los siguientes pasos:
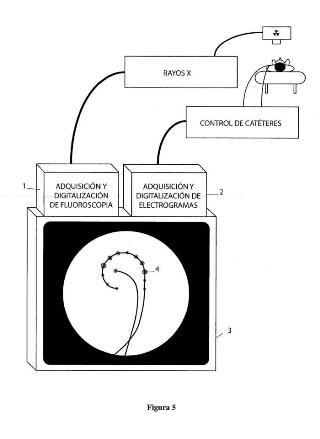
adquisición y digitalización de imágenes fluoroscópicas del corazón, detección continua de un catéter multielectrodo y un catéter de ablación en dichas imágenes mediante visión artificial, detección continua de los electrodos de dichos catéteres en dichas imágenes mediante visión artificial, adquisición continua de los electrogramas de dichos electrodos, y generación de una imagen fluoroscópica mejorada con la superposición sobre los electrodos de un punto brillante translúcido simulando una luz, cuyo brillo varía en función del correspondiente electrograma. El método puede ser implementado en firmware o software como parte de un aparato basado en microcontrolador o microprocesador. Dicho aparato comprende medios para la adquisición de la fluoroscopia y de la señal de los electrodos, medios para implementar el método descrito, y medios para mostrar la imagen generada.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200901936.
Solicitante: UNIVERSIDADE DE VIGO.
Nacionalidad solicitante: España.
Inventor/es: MARTÍN HERRERO, JULIO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61B5/0408
Fragmento de la descripción:
PROCEDIMIENTO Y APARATO PARA ASISTENCIA EN ABLACIÓN DE ARRITMIAS
La presente invención se encuadra en el sector de la técnica de la realidad aumentada, y los procedimientos y aparatos para asistir a los cirujanos en la ablación de arritmias. Específicamente, se refiere a un procedimiento de realidad aumentada y un aparato que lo implementa, para mejorar la percepción del cirujano de las mediciones por cateterismo cardíaco de la propagación de la actividad eléctrica del corazón, facilitando la ablación de arritmias.
ANTECEDENTES DE LA INVENCIÓN
La ablación con catéter permite tratar desórdenes del ritmo cardíaco. El área en que se origina la señal eléctrica cardíaca anormal es cauterizada mediante un catéter de ablación. El procedimiento estándar para guiar la ablación de arritmias se basa en
~ fluoroscopía y el análisis de los electrogramas de un catéter multielectrodo. La imagen fluoroscópica muestra en tiempo real en el interior de la cavidad cardíaca un catéter multielectrodo de sondeo y un catéter de ablación, y una serie de electrogramas en un polígrafo muestran la variación en el tiempo de la intensidad de las señales eléctricas medidas por un número variable de electrodos situados a lo largo del catéter de sondeo y también en la punta del catéter de ablación.
El cirujano guía el catéter multielectrodo hasta el interior del corazón, intentando disponer los electrodos a lo largo de la pared de la cavidad correspondiente, con la ayuda de la imagen fluoroscópica. Cuando el catéter está situado adecuadamente, el polígrafo muestra la variación en el tiempo de la actividad eléctrica en cada electrodo a lo largo del catéter. Típicamente hay de 10 a 12 electrodos en un catéter de sondeo. Los electrodos en contacto con el tejido cardíaco muestran clara actividad eléctrica al ritmo de los latidos del corazón. El cirujano deduce el patrón de propagación de la actividad eléctrica en la cavidad a partir del desplazamiento relativo de los latidos en los diferentes electrodos, junto con su estimación de la localización de cada electrodo en la cavidad. Así el cirujano es capaz de determinar el sentido de propagación de la señal (horario o antihorario) y también la existencia o no de "atajos" o "cortocircuitos" que producen anormalidades del ritmo cardíaco y el patrón de propagación.
Éste es un proceso delicado y que consume mucho tiempo de cirujano, quirófano y rayos. El polígrafo con los electrogramas muestra tantas gráficas como electrodos hay en el catéter. La señal eléctrica medida por los electrodos es compleja, ruidosa, y, a veces, dependiendo de la mejor o peor situación del electrodo, de baja intensidad. Los 5 electrodos se numeran según su posición a lo largo del catéter. Sin embargo, el catéter, cuando está en posición, suele estar curvado a lo largo de la pared de la cavidad a intervenir, y la correspondencia entre cada una de las gráficas en el polígrafo y cada electrodo en la fluoroscopia (donde aparecen como una pequeña bolita, o par de bolitas, en el catéter) , y, por tanto, la localización en el corazón de la señal representada, no es 1 O evidente. Adicionalmente, el desplazamiento relativo de los latidos en cada electrograma es muy pequeño, y viene acompañado de variaciones de la intensidad y el nivel de ruido en cada electrograma, y por tanto de la forma de onda en cada electrograma. Así, el cirujano ha de reordenar, magnificar, volver a reordenar y rescalar varias veces los electrogramas para conseguir una idea clara del patrón de propagación 15 de la señal de activación a lo largo de la cavidad. Entre tanto, catéteres y paciente suelen moverse, y se hace necesaria una frecuente reloealización, con la consiguiente · inspección fluoroscópica de los catéteres durante todo el proceso, incrementando notablemente la exposición a rayos del paciente y el personal de quirófano. Además, el patrón de activación que interesa es el de la condición arrítmica, y, por tanto, es 20 necesario que la arritmia persista durante la mayor parte del proceso, lo que requiere la inducción de la arritmia, que no es bien tolerada por algunos pacientes y puede derivar en complicaciones como desfibrilación o paradas, con mayor probabilidad cuanto mayor sea su duración. Cuando el cirujano al fin está satisfecho con su estimación del origen y 25 localización del patrón de propagación anómalo, situará el catéter de ablación en el área de interés y activará el electrodo en la punta de ablación para destruir el endocardio causante de la conducción anómala. Las alternativas al uso del catéter multielectrodo para el mapeado de los patrones anormales de propagación incluyen un método anterior que usa un único catéter para el 30 sondeo y la ablación. La punta de ablación mide la actividad eléctrica en un punto de la pared cardíaca, de forma que se mapea el patrón de activación de forma secuencial, accediendo sucesivamente a una serie de puntos de muestreo, y basándose en la memoria del cirujano o bien en el método propuesto en [2], explicado más adelante. Otra alternativa es un catéter sin contacto, capaz de medir la actividad eléctrica en el endocardio mientras flota en el interior de una cavidad. El patrón de propagación se calcula mediante retroproyección de los potenciales medidos en un modelo computerizado de la cavidad. Sistemas de elevado coste usan modelos tridimensionales 5 de alta resolución del corazón, obtenidos previamente por resonancia magnética nuclear, tomografía computerizada, ecografía intraesofágica, o una combinación de éstas. El método propuesto en [2] se basa en técnicas de análisis de imagen (umbralización, detección de bordes, y análisis de conectividad) para localizar la punta del catéter de ablación en la fluoroscopia, junto con un ajuste manual. Asumiendo una 1O relación conocida entre el área de la punta de ablación detectada y su posición en el eje Z, se estima la posición tridimensional de la punta de ablación. Con esta estimación, junto con una estimación de los tiempos de activación (la diferencia entre el instante de máxima caída del electrograma y el inicio del segmento QRS) , se va construyendo un mapa de activación estimado, mientras se lleva la punta de ablación a diferentes puntos 15 de muestreo en la pared cardíaca. Entonces se superpone un mapa translúcido sobre la fluoroscopia, que representa el mapa de activación estimado, como un conjunto de líneas coloreadas. El enfoque es similar al de costosos métodos de navegación como el descrito en [1], que localizan la punta del catéter mediante campos magnéticos de baja intensidad. Sin embargo, el error cuadrático medio reportado en [2] de la estimación de 20 la posición de la punta de ablación in vivo en perros es mayor de un centímetro, y con pacientes humanos, la estimación simplemente se califica como fallida ("unsuccesful") . Los autores en [2] sugieren fluoroscopía biplano, en lugar de la normal, que permitiría localizar la punta del catéter por procesado de imagen en dos planos diferentes, en lugar de tener que recurrir a la estimación basada en la relación área-profundidad. Sin 25 embargo, la fluoroscopía biplano está poco extendida y es más costosa que la normal, y además incrementa la dosis de radiación, ya alta de por sí en un método que requiere del acceso secuencial de la punta del catéter a una serie de puntos de medida a lo largo de la pared cardíaca. 30 Referencias: [1] K. Nademanee and E.M. Kosar. A nonftuoroscopic catheter-based mapping technique to ablate ventricular tachycardia. Pacing Clin. Electrophysiol., 21:1442-1447, 1998.[2] G. Sierra, A.R. LeBlanc, M. Leonard, R. Nadeau, and P. Savard. Prototype of a fluoroscopic navigation system to guide the catheter ablation of cardiac arrhythmias. Proceedings of the 251h Annual International Conference of the IEEE EMES, 1:138-141, 2003.
DESCRIPCIÓN DE LA INVENCIÓN
La presente invención se encuadra en las técnicas de realidad aumentada, y en los procedimientos y aparatos para asistir la ablación de arritmias. Específicamente, se refiere a un procedimiento de realidad aumentada y un aparato que lo implementa, para...
Reivindicaciones:
l. Un procedimiento para asistencia en ablación de arritmias que comprende los siguientes pasos: a) Adquisición y digitalización de fluoroscopia del corazón b) Detección continua de un catéter multielectrodo y un catéter de ablación (si está presente) en la fluoroscopia digitalizada por medio de métodos de visión por computador e) Detección continua de los electrodos a lo largo de dicho catéter multielectrodo y en la punta del catéter de ablación (si está presente) en la fluoroscopia digitalizada por medio de métodos de visión por computador d) Adquisición continua de la señal eléctrica de dichos electrodos e) Generación de una imagen fluoroscópica mejorada por la superposición de luces virtuales traslúcidas sobre dichos electrodos, cuyo brillo varía en función de la señal eléctrica en dichos electrodos.
2. Un procedimiento para asistencia en ablación de arritmias según reivindicación 1 en el que dicho método de visión por computador para detectar los catéteres es sustancialmente equivalente al método de contornos activos.
3. Un procedimiento para asistencia en ablación de arritmias según reivindicación 1 en el que dicho método de visión por computador para detectar los electrodos en los catéteres está basado en reconocimiento de patrones.
4. Un procedimiento para asistencia en ablación de arritmias según reivindicación 1 en el que dichas luces virtuales translúcidas son de colores.
5. Un procedimiento para asistencia en ablación de arritmias según reivindicación 4 en el que dichas luces translúcidas presentan distinto color dependiendo de si representan una señal eléctrica medida en el endocardio o una señal eléctrica aplicada al endocardio.
6. Un procedimiento para asistencia en ablación de arritmias según reivindicación 1 en el que la variación del brillo de dichas luces puede provenir de una transformación no lineal de la señal eléctrica de los electrodos correspondientes.
7. Un procedimiento para asistencia en ablación de arritmias según reivindicación 1 en el que la señal eléctrica de dichos electrodos se puede filtrar mediante técnicas de procesado digital de la señal.
8. Un procedimiento para asistencia en ablación de arritmias según reivindicación 7 en el que dichos filtros pueden ser activados o desactivados por el cirujano en cualquier momento durante la intervención.
9. Un procedimiento para asistencia en ablación de arritmias según reivindicación 1 en el que la variación de brillo de dichas luces puede ser ralentizada con respecto a la señal eléctrica de los electrodos correspondientes.
10. Un procedimiento para asistencia en ablación de arritmias según reivindicación 9 en el que dicha ralentización puede ser ajustada por el cirujano en cualquier momento durante la intervención.
11. Un aparato para asistencia en ablación de arritmias basado en el procedimiento según reivindicación 1 que comprende: a) Medios para adquirir y digitalizar dicha imagen fluoroscópica b) Medios para adquirir y digitalizar la actividad eléctrica de dichos electrodos e) Medios para procesar dicha imagen fluoroscópica usando dicho procedimiento implementado en firmware o software para detectar de forma continua los catéteres, localizar los electrodos, · y determinar la posición e intensidad de dichas luces virtuales . d) Medios para generar y mostrar la imagen fluoroscópica mejorada incluyendo dichas luces virtuales de brillo variable.
12. Un aparato para asistencia en ablación de arritmias según reivindicaciones 11 y 10 en el que dicha ralentización puede ser ajustada por el cirujano mediante un dispositivo substancialmente equivalente a un mando rotatorio.
13. Un aparato para asistencia en ablación de arritmias según reivindicaciones 11 y 10 en el que dicha ralentización puede ser ajustada por el cirujano mediante un dispositivo substancialmente equivalente a un mando deslizante.
14. Un aparato para asistencia en ablación de arritmias según reivindicación 11 en el que dichos medios para generar y mostrar dicha imagen fluoroscópica mejorada son substancialmente equivalentes a una pantalla táctil, incluyendo cualquier control relevante para la operación de la presente invención.
15. Un aparato para asistencia en ablación de arritmias según reivindicación 11 en el que dichos medios para generar y mostrar dicha imagen fluoroscópica mejorada son substancialmente equivalentes a una pantalla multitáctil, incluyendo cualquier control relevante para la operación de la presente invención.
Patentes similares o relacionadas:
Dispositivo para la colocación de agrupaciones de electrodos, del 13 de Mayo de 2020, de GUGER, CHRISTOPH: Dispositivo con una serie de agrupaciones de electrodos que se pueden colocar en la superficie de la piel de un ser vivo animal o humano y con los que se pueden medir […]
Configuración bipolar doble para anotación de fibrilación auricular, del 8 de Abril de 2020, de Biosense Webster (Israel), Ltd: Un aparato que comprende: una sonda intracorporal que tiene una pluralidad de electrodos unipolares, la sonda estando configurada para contactar con el tejido en un […]
Bioelectrodo y prenda de vestir, del 1 de Abril de 2020, de NIPPON TELEGRAPH AND TELEPHONE CORPORATION: Un bioelectrodo incluyendo: un elemento de encaje formado por un elemento aislante eléctrico; una parte de electrodo (1101a, 1101b) formada por un elemento […]
Métodos para cuantificación de ruido adaptativa en análisis de señal biológica dinámica, del 11 de Diciembre de 2019, de Smart Solutions Technologies, S.L: Un método para cuantificación de ruido adaptativa en análisis de señal biológica dinámica de un usuario, comprendiendo el método las etapas de: transmitir […]
Tejido para la adquisición de señales fisiológicas, del 4 de Diciembre de 2019, de Smart Solutions Technologies, S.L: Un tejido para adquirir señales fisiológicas, que comprende al menos una pista elástica y eléctricamente conductora, que tiene un grosor de 120 μm a […]
Aparato de estimulación nerviosa y sistema de medición de campo biomagnético, del 30 de Octubre de 2019, de RICOH COMPANY, LTD.: Un aparato de estimulación nerviosa para detectar actividades nerviosas de una superficie corporal y aplicar estimulación, comprendiendo el aparato […]
Sensor para la medición de parámetros vitales en el conducto auditivo, del 28 de Octubre de 2019, de Cosinuss GmbH: Sensor para la medición de un parámetro vital en el conducto auditivo de un ser humano o de un animal, que comprende: una pieza de fijación de elemento […]
Método para producir un bioelectrodo, del 5 de Junio de 2019, de Leonh. Lang: Método para producir un bioelectrodo, con una capa adhesiva conductora de la electricidad, situada en el lado de la piel, y con un cable eléctrico flexible […]