Precursor de esteroides sexuales en combinación con un modulador selectivo del receptor de estrógenos para la prevención y tratamiento de atrofia vaginal en mujeres postmenopáusicas.
Dehidroepiandrosterona en combinación con una cantidad terapéuticamente eficaz de acolbifeno como parte de una terapia de combinación,
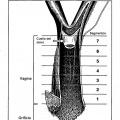
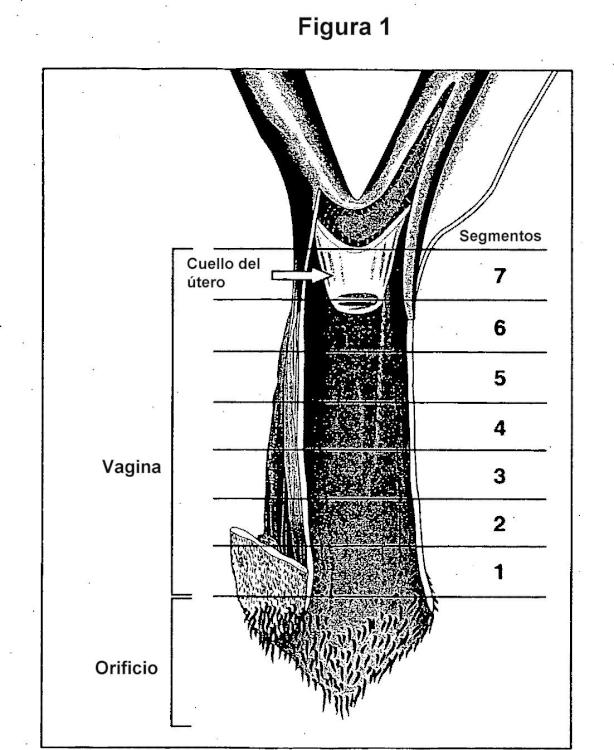
para su uso en el tratamiento o en la reducción de la probabilidad de adquirir una enfermedad vaginal que afecta a la capa de la lámina propia, en la que la enfermedad vaginal es la atrofia de la capa de la lámina propia en mujeres postmenopáusicas.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CA2005/001612.
Solicitante: ENDORECHERCHE INC..
Nacionalidad solicitante: Canadá.
Dirección: 2989 DE LA PROMENADE SAINTE-FOY QUEBEC G1W 2J5 CANADA.
Inventor/es: LABRIE, FERNAND, EL-ALFY,MOHAMED, BERGER,LOUISE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/453 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › conteniendo un ciclo de seis eslabones con el oxígeno como heteroátomo del ciclo.
- A61K31/519 A61K 31/00 […] › condensadas en orto o en peri con heterociclos.
- A61K31/566 A61K 31/00 […] › teniendo un grupo oxo en posición 17, p. ej. estrona.
- A61K31/5685 A61K 31/00 […] › teniendo un grupo oxo en posición 17, p. ej. androsterona.
- A61P15/02 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 15/00 Medicamentos para el tratamiento de trastornos genitales o sexuales (para trastornos de las hormonas sexuales A61P 5/24 ); Anticonceptivos. › para patologías de la vagina.
PDF original: ES-2553101_T3.pdf



Patentes similares o relacionadas:
1,5-Dihidro-4H-pirazolo[3,4-d]pirimidin-4-onas y 1,5-dihidro-4H-pirazolo[4,3-c]piridin-4-onas como inhibidores de la PDE1, del 29 de Julio de 2020, de H. LUNDBECK A/S: Un compuesto de fórmula (I) **(Ver fórmula)** en donde Y es N o CH; R1 se selecciona del grupo que consiste en alquilo C2-C8 lineal o ramificado, cicloalquilo […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Terapias de combinación para el cáncer, del 22 de Julio de 2020, de MERCK SHARP & DOHME CORP: Una combinación que comprende un anticuerpo anti-PD-1 humano y un Compuesto A y un Compuesto B, en donde: el anticuerpo anti-PD-1 humano comprende […]
Derivado heteroarilo o sal farmacéuticamente aceptable del mismo, método de preparación del mismo y composición farmacéutica para prevenir o tratar enfermedades asociadas con PI3 quinasas, que contiene el mismo como principio activo, del 22 de Julio de 2020, de KOREA RESEARCH INSTITUTE OF CHEMICAL TECHNOLOGY: Un compuesto representado por la fórmula 1, un isómero óptico del mismo o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la fórmula […]
Composición farmacéutica que comprende un agente antipsicótico atípico y método para su preparación, del 15 de Julio de 2020, de PHARMATHEN S.A.: Comprimido de liberación controlada de Paliperidona en forma de comprimido de varias capas que comprende: a) un núcleo de matriz que comprende […]
Combinación de anticuerpo anti-CD20 e inhibidor selectivo de PI3 quinasa, del 15 de Julio de 2020, de TG Therapeutics Inc: Un metodo in vitro para inhibir la proliferacion de una poblacion celular que comprende poner en contacto la poblacion con una combinacion que comprende […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Polimorfo de inhibidores de SYK, del 8 de Julio de 2020, de Kronos Bio, Inc: Un polimorfo de una sal bis-mesilato, monohidrato de un compuesto de fórmula I: **(Ver fórmula)** caracterizado por un patrón de difracción […]