Polipéptidos de larga duración de acción y procedimientos para producirlos y administrarlos.
Un polipéptido que se compone de un péptido de interés, en donde una gonadotropina coriónica de péptido con carbonilo terminal (PCT) está unida a un termino amino de dicho péptido de interés,
y una segunda y tercera terminal carboxilo de gonadotropina coriónica está unida
al termino carboxilo de dicho péptido de interés, en donde dicho péptido de interés es un péptido de eritropoyetina (EPO),
en donde el PCT es de una subunidad beta de la gonadotropina coriónica, en donde el PCT se compone de la secuencia de aminoácido SSSSKAPPPS, y en donde el péptido EPO estimula la eritropoyetina.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/003014.
Solicitante: OPKO Biologics Ltd.
Nacionalidad solicitante: Israel.
Dirección: 7 Golda Meir Street, 2nd floor 74140 Nes Ziona ISRAEL.
Inventor/es: FARES,FUAD, FIMA,UDI EYAL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/19 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Citoquinas; Linfoquinas; Interferones.
- A61K38/24 A61K 38/00 […] › Hormona folículo-estimulante [FSH]; Gonadotropinas coriónicas, p. ej.: HCG; Hormona luteinizante [LH]; Hormona estimulante de la tiroides [TSH].
- C07K14/505 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Eritropoyetina (EPO).
- C07K14/59 C07K 14/00 […] › Hormona estimulante del folículo (FSH); Gonadotropinas coriónicas, p. ej. HCG; Hormona luteinizante (LH); Hormona estimulante del tiroides (TSH).
- C12N15/12 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas animales.
- C12N15/16 C12N 15/00 […] › Hormonas.
- C12N15/62 C12N 15/00 […] › Secuencias de ADN que codifican proteínas de fusión.
PDF original: ES-2477390_T3.pdf
Fragmento de la descripción:
Polipéptidos de larga duración de acción y procedimientos para producirlos y administrarlos
CAMPO DE LA INVENCIÓN
Se divulgan un polipéptido y polinucleótidos que codifican los mismos péptidos con carboxilo terminal (PCT) de gonadotropina coriónica unido a un péptido de interés. También se divulgan las composiciones farmacéuticas que comprenden al polipéptido y los polinucleótidos de la invención y los métodos para usarlos.
ANTECEDENTES DE LA INVENCIÓN
Los polipéptidos son susceptibles a la desnaturalización o degradación enzimática en la sangre, hígado o riñón. En consecuencia, los polipéptidos, generalmente, tienen semividas de circulación cortas de varias horas. Debido a su baja estabilidad, los medicamentos con péptidos, generalmente, se suministran con una frecuencia prolongada a fin de mantener una concentración plasmática eficaz del péptido activo. Además, debido a que los medicamentos con péptidos, generalmente, se suministran por infusión, la inyección frecuente de medicamentos con péptidos ocasionan un malestar considerable al sujeto. Por lo tanto, existe la necesidad de tecnologías que prolonguen las semividas de polipéptidos terapéuticos al mismo tiempo que mantengan una alta eficacia farmacológica de estos. Tales medicamentos con péptidos deseados también deberían cumplir con los requisitos de contar con una estabilidad mejorada del suero, alta actividad y baja probabilidad de inducir una respuesta inmunológica indeseada al inyectarlos en un sujeto. Farmacocinéticas no favorables, como una semivida corta en suero, pueden prevenir el desarrollo farmacéutico de muchos medicamentos candidatos prometedores. La semivida en suero es una característica empírica de una molécula y debe determinarse experimentalmente para cada nuevo medicamento potencial. Por ejemplo, los medicamentos de polipéptido con peso molecular inferior, mecanismos fisiológicos de depuración como la filtración renal pueden hacer que el mantenimiento de niveles terapéuticos de un medicamento no sea factible debido al costo o la frecuencia del régimen de dosis requerido. En cambio, la semivida larga en suero no es deseable cuando un medicamento o sus metabolitos tienen efectos secundarios tóxicos. EE.UU. 5.759.818 divulga péptidos y proteínas modificados que cuentan con actividad biológica, los que contienen extensiones que representan el péptido con carboxilo terminal de gonadotropina coriónica humana o fragmentos de estos. Dichos péptidos y proteínas modificados cuentan con propiedades de depuración más deseables en comparación con los péptidos o proteínas sin modificar correspondientes.
RESUMEN DE LA INVENCIÓN
En una realización, la presente invención proporciona un polipéptido que consiste de una primera secuencia PCT AA (aminoácido) de gonadotropina coriónica unida al extremo amino-terminal de una secuencia de interés del péptido, y una segunda y tercera secuencia PCT AA unida al extremo carboxiterminal de la secuencia de interés del péptido, donde la secuencia de interés del péptido es un péptido de eritropoyetina (EPO) , en donde el PCT es de una subunidad beta de la gonadotropina coriónica, en donde el PCT consiste de la secuencia de aminoácidos SSSSKAPPPS, y en donde el péptido EPO estimula la eritropoyetina.
El péptido EPO de interés puede ser glicosilado o no glicosilado. El péptido EPO puede componerse de la secuencia de aminoácidos N. º ID SEC: 3 o Nº ID SEC: 6. Al menos uno de los péptidos con carboxilo terminal de gonadotropina coriónica puede componerse de la
secuencia de aminoácidos de N. º ID SEC: 17 o N. º ID SEC: 18. Al menos uno de los péptidos con carboxilo terminal de gonadotropina coriónica puede estar truncado y
componerse de al menos un sitio de glicosilación. Al menos uno de los péptidos con carboxilo terminal de gonadotropina coriónica puede estar glicosilado. El polipéptido puede además componerse de un péptido de señal, y el péptido de señal puede
componerse de la secuencia de aminoácidos N. º ID SEC: 19.
En otra realización, la presente invención proporciona un polinucleótido que codifica un polipéptido de la invención.El polinucleótido puede componerse de la secuencia de aminoácido N. º ID SEC: 21. En una realización adicional, la presente invención proporciona un vector de expresión que se compone del polinucleótido de la invención. En una realización adicional, la presente invención proporciona una célula que se compone del vector de expresión de la invención. En otra realización, la presente invención proporciona una composición farmacéutica que se compone de un polipéptido, polinucleótido, vector de expresión o célula de la invención. En otra realización, la presente invención proporciona un método para mejorar la semivida biológica y retener una actividad biológica de una secuencia de interés del péptido; el método se compone del paso de unir una primera secuencia PCT AA de gonadotropina coriónica al extremo amino-terminal de una secuencia de interés del péptido y unir una segunda y tercera secuencia PCT AA al extremo carboxiterminal de la secuencia de interés del péptido, lo que mejora, por lo tanto, la semivida biológica del péptido de interés, en donde el péptido de interés es eritropoyetina (EPO) , en donde el PCT es de la subunidad beta de la gonadotropina coriónica humana, en donde el PCT consiste de la secuencia de aminoácidos SSSSKAPPPS y en donde el péptido EPO estimula la eritropoyesis. En otra realización, la presente invención proporciona un polipéptido o un polinucleótido de la invención y lo usa en el tratamiento o la reducción de la incidencia asociada con anemia en un sujeto.
BREVE DESCRIPCIÓN DE LOS DIAGRAMAS
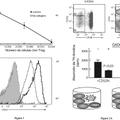
Las Figuras 1A-1 F son diagramas que ilustran seis conceptos EPO-PCT. La Figura 1A -es un diagrama del polipéptido del N.o ID SEC: 1 La Figura 1B es un diagrama del polipéptido del N.o ID SEC: 2 La Figura 1C es un diagrama de un polipéptido del N.o ID SEC: 3 La Figura 1D es un diagrama de un polipéptido de N.o ID SEC: 4. La Figura 1E es un diagrama de un polipéptido de N.o ID SEC: 5. La Figura 1F es un diagrama de un polipéptido del N.o ID SEC: 6. La Figura 2 es una fotografía que ilustra la expresión de las variantes EPO-PCT de las células DG44 transfectadas. Las muestras del ensayo final de las células transfectadas se prepararon como se describe en "preparación de muestra" y se ejecutaron en SDS/PAGE. Las proteínas se detectaron por Western Blot. La Figura 3 es una gráfica que ilustra la bioactividad in vivo de los derivados hEPO recombinantes y EPO-3 (N.o ID SEC: 3) . Los ratones ICR (n=7/grupo) recibieron una sola inyección IV/semana (15 mg/kg) durante tres semanas de EPO-3, rhEPO-WT (N.oID SEC: 16) , Recormon (EPO comercial) o Recormon (5 mg/kg) 3 veces a la semana. Los animales de control se inyectaron IV con PBS. Se recolectaron muestras de sangre tres veces a la semana, y se detectaron niveles de hematocrito. Cada punto representa el grupo promedio de hematocrito (%) ± SE. La Figura 4 es una gráfica que ilustra la bioactividad in vivo de los derivados hEPO recombinantes y EPO-1 (N.o ID SEC: 1) . Los ratones ICR (n=7/grupo) recibieron una sola inyección IV/semana (15 mg/kg) durante tres semanas de EPO-1, rhEPO-WT (N.o ID SEC: 16) , Recormon o Recormon (5 mg/kg) 3 veces a la semana. Los animales de control se inyectaron IV con PBS. Se recolectaron muestras de sangre tres veces a la semana, y se detectaron niveles de hematocrito. Cada punto representa el grupo promedio de hematocrito (%) ± SE. La Figura 5 es una gráfica que ilustra la bioactividad in vivo de los derivados hEPO recombinantes y EPO-2 (N.o ID SEC: 2) . Los ratones ICR (n=7/grupo) recibieron una sola inyección IV/semana (15 mg/kg) durante tres semanas de EPO-2 (N.o ID SEC: 2) , rhEPO-WT (N.o ID SEC: 16) , Recormon o Recormon (5 mg/kg) 3 veces a la semana. Los animales de control se inyectaron IV con PBS. Se recolectaron muestras de sangre tres veces a la semana, y se detectaron niveles de hematocrito. Cada punto representa el grupo promedio de hematocrito (%) ± SE. La Figura 6 es una gráfica de tiempo que ilustra el cambio en el nivel de reticulocitos después de una sola dosis bolo de EPO-0 (N.o ID SEC: 16) , EPO-3 (N.o ID SEC: 3) y Aranesp. La Figura 7 es una gráfica de tiempo que ilustra el cambio en el nivel de hemoglobina (presentado como un cambio desde la línea base) después de una sola dosis bolo de EPO-0 (N.o ID SEC: 16) , EPO-3 (N.o ID SEC: 3) y Aranesp. La Figura 8 es una gráfica de tiempo que ilustra el cambio en el nivel de hematocrito después de una sola dosis bolo de EPO-0 (N.o ID SEC: 16) , EPO-3 (N.o ID SEC: 3) y Aranesp.
La Figura 9 es una gráfica que ilustra el cambio en concentración... [Seguir leyendo]
Reivindicaciones:
1. Un polipéptido que se compone de un péptido de interés, en donde una gonadotropina coriónica de péptido con carbonilo terminal (PCT) está unida a un termino amino de dicho péptido de interés, y una segunda y tercera terminal carboxilo de gonadotropina coriónica está unida al termino carboxilo de dicho péptido de interés, en donde dicho péptido de interés es un péptido de eritropoyetina (EPO) , en donde el PCT es de una subunidad beta de la gonadotropina coriónica, en donde el PCT se compone de la secuencia de aminoácido SSSSKAPPPS, y en donde el péptido EPO estimula la eritropoyetina.
2. El polipéptido de la reivindicación 1, donde dicho péptido de interés es glicosilado.
3. El polipéptido de la reivindicación 1, en donde dicho péptido de interés es no glicosilado.
4. El polipéptido de la reivindicación 1, en donde la secuencia de dicho péptido EPO se compone de una secuencia de aminoácido seleccionado desde las secuencias previstas en Nº ID SEC: 3 y el Nº ID SEC:6.
5. El polipéptido de cualquiera de las reivindicaciones 1 a 4, en donde la secuencia de al menos una terminal carboxilo de gonadotropina coriónica se compone de una secuencia de aminoácido seleccionada desde las secuencias previstas en Nº ID SEC: 17 y
Nº ID SEC: 18.
6. El polipéptido de cualquiera de las reivindicaciones 1 a 4, en donde la secuencia de al menos una gonadotropina coriónica con péptido con carbonilo terminal se truncó, y en donde dicho péptido con carboxilo terminal se compone de al menos un sitio de glicosilación.
7. El polipéptido de cualquiera de las reivindicaciones 1 a 6, en donde al menos una gonadotropina coriónica de péptido con carbonilo terminal es glicosilada.
8. El polipéptido de cualquiera de las reivindicaciones 1 a 7, en donde se componen además de un péptido de señal.
9. El polipéptido de la reivindicación 8, en donde el péptido de señal se compone de una secuencia de aminoácido previstas en Nº ID SEC: 19.
10. Una composición farmacéutica que se compone del polipéptido de cualquiera de las reivindicaciones 1 a 9.
11. Un polinucleótidos que codifican el polipéptido de cualquiera de las reivindicaciones 1 a 9.
12. El polinucleótido de la reivindicación 11, en donde la secuencia del ácido nucleico se compone de la secuencia
prevista en Nº ID SEC: 21.
13. El polinucleótido de cualquiera de las reivindicaciones 11 a 12, en donde dicho polipéptido se compone además de un péptido de señal.
14. Un vector de expresión que se compone del polinucleótido de cualquiera de las reivindicaciones 11 a 13.
15. Una célula que comprende el vector de expresión de la reivindicación 14.
16. Una composición farmacéutica que se compone del polinucleótido de cualquiera de las reivindicaciones 11 a 13, el vector de expresión de la reivindicación 14, la célula de la reivindicación 15 o su combinación.
17. Un método para mejorar la media vida biológica y retención de una actividad biológica de un péptido de interés, que se compone del paso de unir una primera gonadotropina coriónica de péptido con terminal carboxi (PCT) a la terminal amino de dicho péptido de interés y una gonadotropina coriónica con péptido de terminal carboxi a la terminal carboxi de dicho péptido de interés, mejorando por lo tanto la semivida biológica de dicho péptido de interés, en donde dicho péptido de interés es eritropoyetina (EPO) , en donde el PCT es de una subunidad beta de la gonadotropina coriónica, en donde el PCT se compone de la secuencia de aminoácido SSSSKAPPPS, y en donde el péptido EPO estimula la eritropoyetina.
18. El método de la reivindicación 17, donde la secuencia de al menos una terminal carboxilo de gonadotropina coriónica se compone de una secuencia de aminoácido seleccionada desde las secuencias previstas en Nº ID SEC: 17-18.
19. El polipéptido de cualquiera de las reivindicaciones 1 a 9 o el polinucleótidos de cualquiera de
las reivindicaciones 11 a 13 para usar el tratamiento o la reducción de la incidencia de anemia.
20. El polipéptido o el polinucleótidos para el uso de acuerdo a la reivindicación 19, en donde la secuencia de al menos una terminal carboxilo de gonadotropina coriónica se compone de una secuencia de aminoácido seleccionada desde las secuencias previstas en Nº ID SEC: 17-18.
FIGURAS 1 A-F
FIGURA 2
FIGURA 3
FIGURA 4
FIGURA 5
FIGURA 6
FIGURA 7
FIGURA 8
FIGURA 9
FIGURA 10
FIGURA 11
Patentes similares o relacionadas:
 CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
 Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
PÉPTIDO DE MITICINA Y SU USO EN REGENERACIÓN CELULAR, del 4 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente en la regeneración celular y/o […]
Péptido de miticina y su uso en regeneración celular, del 28 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Péptido de miticina y su uso en regeneración celular. La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente […]
Moléculas de unión de alta avidez que reconocen MAGE-A1, del 8 de Abril de 2020, de Max Delbrück Centrum für Molekulare Medizin (MDC) Berlin-Buch: Una construcción de reconocimiento de antígenos que es un receptor de células T (TCR), que comprende (i) una región variable de la cadena alfa […]
Moléculas de unión a ligando y usos de las mismas, del 25 de Diciembre de 2019, de Vegenics Pty Limited: Una molécula de unión a ligando que comprende un polipéptido de unión a ligando fusionado a un fragmento de dominio constante de inmunoglobulina, comprendiendo […]
Tratamiento de las enfermedades relacionadas con la apolipoproteína a1 por inhibición del transcrito antisentido natural a la apolipoproteína a1, del 17 de Octubre de 2019, de CuRNA, Inc: Un oligonucleótido que se dirige a un transcrito antisentido natural de apolipoproteína A1 para su uso como un compuesto terapéutico, donde el oligonucleótido […]