NUEVOS DERIVADOS DE INSULINA, SU EMPLEO Y UN PREPARADO FARMACÉUTICO QUE LOS CONTIENE.
EL INVENTO SE REFIERE A UN NUEVO DERIVADO DE FORMULA (II) QUE TIENE UN PUNTO ISOELECTRICO ENTRE 5 Y 8,
5, UNA GRAN ESTABILIDAD EN MEDIO ACIDO DILUIDO Y UNA ACTIVIDAD ESPECIFICA ESPECIAL Y TRATA DE LAS SALES TOLERABLES FISIOLOGICAS PARA EL TRATAMIENTO DE LA DIABETES MELLITUS. SIENDO: R1 HIDROGENO O H-PHE; R2 UN L-AMINOACIDO CODIFICABLE GENETICAMENTE CONTENIENDO PEQUEÑOS GRUPOS AMIDOS; R30 UN L-AMINOACIDO CODIFICABLE GENETICAMENTE; R31 UN GRUPO ORGANICO TOLERABLE FISIOLOGICAMENTE CON CARACTERES BASICOS Y DE C 50 FORMADO A PARTIR DE 1 A 3 -AMINOACIDOS CON REDUCCION DE FUNCIONES CARBOXILOS TERMINALES COMO FUNCION ESTER, AMIDA O LACTONA A CH2OH Y X UN L-AMINOACIDO CODIFICABLE GENETICAMENTE.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E89120462.
Solicitante: SANOFI-AVENTIS DEUTSCHLAND GMBH.
Nacionalidad solicitante: Alemania.
Dirección: BRUNINGSTRASSE 50 FRANKFURT AM MAIN, 65929 ALEMANIA.
Inventor/es: DORSCHUG, MICHAEL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K38/28 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Insulinas.
- A61P3/08 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 3/00 Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00). › para la homeostasia de la glucosa (hormonas pancreáticas A61P 5/48).
- A61P3/10 A61P 3/00 […] › para la hiperglucemia, p.ej. antidiabéticos.
- C07K14/575 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Hormonas.
- C07K14/62 C07K 14/00 […] › Insulinas.
- C12N15/09 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12P21/02 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › que tienen una secuencia conocida de varios aminoácidos, p. ej. glutation.
- C12R1/19 C12 […] › C12R SISTEMA DE INDEXACION ASOCIADO A LAS SUBCLASES C12C - C12Q, RELATIVO A LOS MICROORGANISMOS. › C12R 1/00 Microorganismos. › Escherichia coli.
PDF original: ES-2059676_T3.pdf
Fragmento de la descripción:
Nuevos derivados de insulina, su empleo y un preparado farmacéutico que los contiene.
La insulina y sus derivados se necesitan, como es bien sabido, en considerables cantidades para el tratamiento de la enfermedad Diabetes mellitus y, en parte, se produce también a gran escala técnica. A pesar del considerable número de los preparados y de las modificaciones de insulina que ya existen, con diversos perfiles de efecto, a causa de la diversidad de los organismos con sus fluctuaciones inter- e intra-individuales, sigue existiendo todavía una necesidad de otros productos de insulina con nuevamente otras propiedades y características de efecto diferentes.
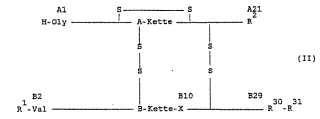
Se han descrito derivados de insulina con un efecto retardado, por ejemplo, en los documentos de patente europea EP-B-132.7 69 y EP-B-132.770. Se trata de derivados especialmente modificados con radicales básicos en la posición B31 de la cadena B de insulina, que tienen la siguiente fórmula I:
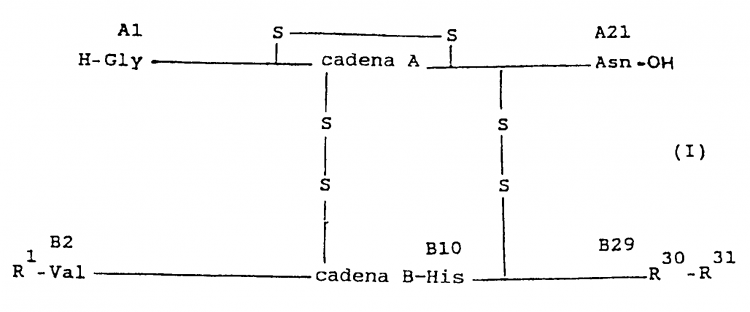
en la cual
Es característico de estos derivados de insulina un punto isoeléctrico comprendido entre 5,8 y 8,5 (medido en el enfoque isoeléctrico). El punto isoeléctrico - que se ha desplazado a la región neutra con respecto al punto isoeléctrico de la insulina o proinsulina natural no modificada (a pH = 5,4) - está condicionado por la(s) carga(s) positiva(s) adicional(es) que se encuentra(n) en la superficie de la molécula, como consecuencia de la modificación de carácter básico. Con ello, estos derivados de insulina modificados con radicales básicos son menos. solubles en la región neutra que, por ejemplo, la insulina o proinsulina natural, que en el margen neutro se presentan normalmente disueltas.
El efecto de retardo o de depósito de los derivados de insulina modificados con radicales básicos de fórmula I se debe a su difícil solubilidad en el punto isoeléctrico. Según los dos documentos mencionados anteriormente, la renovada disolución de los derivados de insulina bajo condiciones fisiológicas se debe conseguir mediante separación de los grupos básicos adicionales, lo cual, dependiendo del derivado, se produce mediante una actividad tríptica o semejante a la de tripsina y/o de carboxipeptidasa B o semejante a la de carboxipeptidasa B y/o de esterasa. Los grupos separados en cada caso son o bien metabolitos puramente fisiológicos o por el contrario sustancias fácilmente metabolizables, fisiológicamente inocuas.
El principio de depósito mencionado anteriormente, como consecuencia de una modificación básica de la insulina se aprovechó todavía más mediante la puesta a punto y la correspondiente utilización de otros derivados de insulina modificados con radicales básicos -principalmente dentro de las cadenas A y B-; véanse, por ejemplo, los documentos EP-A-0.194.864 y EP-A-0.254.516.
En los derivados de insulina de acuerdo con el documento EP-A-0.194.516 un aminoácido básico está incorporado en la posición B27 y/o un aminoácido neutro está situado en las posiciones A4, A17, B13 y/o B21; además, el grupo carboxilo C-terminal de la cadena B está bloqueado por un radical de amida o éster.
Los derivados de insulina de acuerdo con el documento EP-A-0.254.516 son muy parecidos a los del documento EP-A mencionado anteriormente; sin embargo, para aumentar la estabilidad a los valores de pH débilmente ácidos de los correspondientes preparados farmacéuticos, el aminoácido Asn puede estar reemplazado o reemplazarse posteriormente, en este caso, en la posición A21 además por otros aminoácidos más estables en un medio ácido, tales como, por ejemplo, Asp. La Asn (=asparagina) se diferencia del Asp (=ácido aspártico), tal como es sabido, por el bloqueo de uno de los dos grupos carboxilo por un grupo amido:
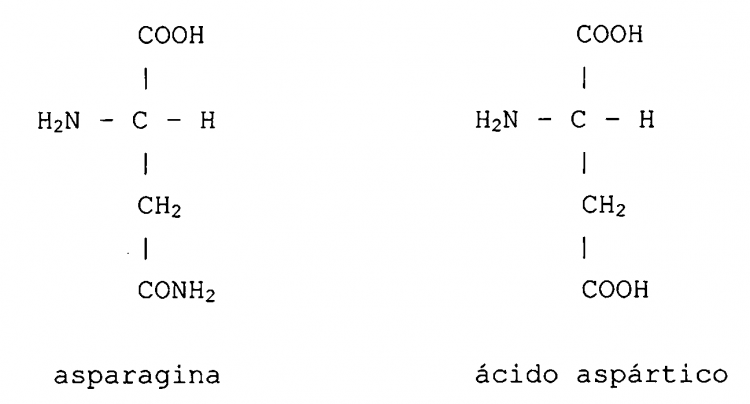
Mediante todavía otra modificación de la molécula de insulina en las cadenas A y B, especialmente mediante el intercambio del aminoácido His en la posición B10, que es responsable de la formación de un complejo con zinc - y, por tanto, de un cierto efecto de retardo - por otros aminoácidos correspondientes, deberán resultar unos derivados de insulina que actúen rápidamente; véase el documento EP-A-0.214.826.
Todos los derivados de insulina de acuerdo con los 3 documentos que se han mencionado en último término están modificados principalmente dentro de las cadenas A y B; su preparación se realiza por vía de tecnología genética.
En el empeño de aumentar la estabilidad en el medio ácido de los derivados de insulina modificados con radicales básicos en el extremo C-terminal de la cadena B, de acuerdo con los documentos de patente europea EP-B-0.132.769 y EP-B-0.132.770 mencionados al principio, y eventualmente de modificar además su perfil de efecto, se ha encontrado, por fin, que este objetivo se alcanza de manera ventajosa mediante reemplazo de AsnA21 por otros aminoácidos codificables genéticamente, que no contienen ningún grupo de amida, y eventualmente mediante reemplazo de HisB10 por otros amino-ácidos codificables genéticamente.
Por tanto, son objeto del invento derivados de insulina de fórmula II
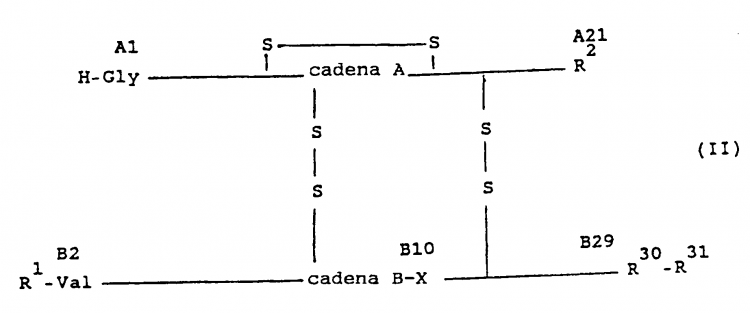
en la cual
Los nuevos derivados de insulina y sus sales fisiológicamente son estables también durante períodos de tiempo prolongados a los valores de pH débilmente ácidos de los correspondientes preparados farmacéuticos y especialmente cuando también se ha intercambiado el HisB10 además por otros aminoácidos - poseen un perfil de efecto modificado (más corto) frente al de los conocidos derivados de insulina modificados con radicales básicos - inalterados - de la fórmula I indicada al principio.
En la fórmula II R1 es preferiblemente H-Phe.
Los L-aminoácidos -para R2- codificables genéticamente, que no contienen ningún grupo amido, son
se prefieren Gly, Ala, Ser, Thr, Asp y Glu, especialmente Asp.
Los L-aminoácidos neutros -para R30- codificables genéticamente, son Gly, Ala, Ser, Thr, Val, Leu, Ile, Asn, Gln, Cys, Met, Tyr, Phe y Pro; se prefieren Ala, Thr y Ser.
R31 es un grupo orgánico fisiológicamente inocuo, de carácter básico, con hasta 50 átomos de C, en cuya constitución participan 0-3 α-aminoácidos. Cuando en la constitución de R31 no participa ningún α-aminoácido,... [Seguir leyendo]
Reivindicaciones:
1. Derivados de insulina de la fórmula II,
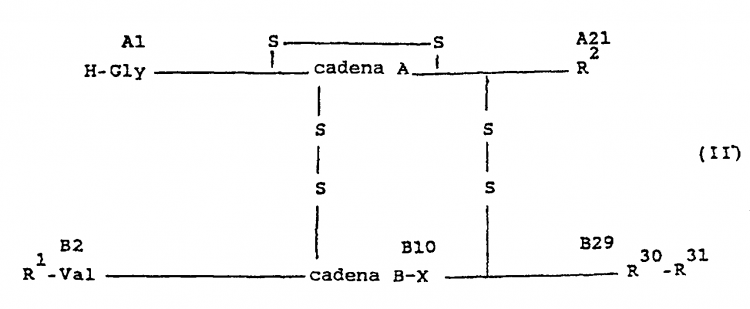
en la cual
2. Derivados de insulina y sus sales fisiológicamente tolerables según la reivindicación 1, caracterizados porque en la fórmula II R1 representa H-Phe.
3. Derivados de insulina y sus sales fisiológicamente tolerables según la reivindicación 1 o 2, caracterizados porque en la fórmula II R2 representa Gly, Ala, Ser, Thr, Asp o Glu, en especial Asp.
4. Derivados de insulina y sus sales fisiológicamente tolerables según una o varias de las reivindicaciones 1 a 3, caracterizados porque en la fórmula II R30 representa Ala, Thr o Ser.
5. Derivados de insulina y sus sales fisiológicamente tolerables según una o varias de las reivindicaciones 1 a 4, caracterizados porque en la fórmula II R31 representa Arg-OH o Arg-Arg-OH.
6. Derivados de insulina y sus sales fisiológicamente tolerables según una o varias de las reivindicaciones 1 a 5, caracterizados porque en la fórmula II X significa Asn o Gln.
7. Derivados de insulina y sus sales fisiológicamente tolerables según una o varias de las reivindicaciones 1 a 6, caracterizados porque en la fórmula II las secuencias (A1 a A20) y (B1 a B9 y B11 a B29) son las secuencias de la insulina humana, de la insulina del cerdo o de la insulina bovina, en especial las secuencias de la insulina humana.
8. Utilización de los derivados de insulina y de sus sales fisiológicamente tolerables conformes a una o varias de las reivindicaciones 1 a 7 como principios activos para preparados farmacéuticos para el tratamiento de diabetes mélitus.
9. Preparado farmacéutico, caracterizado por una cantidad eficaz de al menos un derivado de insulina de la fórmula II y/o al menos de una de sus sales fisiológicamente tolerables conforme a una o varias de las reivindicaciones 1 a 7 en forma disuelta, amorfa y/o cristalina, preferentemente en forma disuelta.
10. Preparado farmacéutico según la reivindicación 9, caracterizado por un contenido adicional de 1 μg a 2 mg, preferentemente 5 μg a 200 μg de cinc/ml.
11. Preparado farmacéutico según la reivindicación 9 o 10, caracterizado por un contenido adicional en insulina no modificada, preferentemente insulina humana no modificada.
Patentes similares o relacionadas:
Terapia génica para la diabetes, del 8 de Julio de 2020, de UCL Business Ltd: Una molécula de ácido nucleico que comprende una secuencia de nucleótidos que codifica una proteína preproinsulina funcional en donde la secuencia de nucleótidos tiene al menos […]
Proteínas de fusión, del 12 de Febrero de 2020, de ELI LILLY AND COMPANY: Una proteína de fusión que comprende: a) un agonista del receptor de insulina que tiene la fórmula general Z1-Z2-Z3, en la que: i) Z1 es un análogo de la cadena B […]
Derivados de insulina biológicamente activos, del 22 de Enero de 2020, de Chemical & Biopharmaceutical Laboratories of Patras S.A: Un análogo de insulina de cadena sencilla que comprende: (A) la cadena A de la insulina humana o animal, o un análogo de esta, que es una variante […]
Insulinas con extensiones recombinantes polares, del 15 de Enero de 2020, de NOVO NORDISK A/S: Una insulina extendida con oligómero o análogo de insulina, cuya insulina o análogo de insulina es una molécula de insulina de dos cadenas que comprende […]
Terapia génica con insulina basada en hepatocitos para la diabetes, del 8 de Enero de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector para su uso en un método para controlar los niveles de glucosa en sangre en un mamífero, donde el método comprende tratar a un mamífero con el vector, donde el […]
Análogo de la insulina y uso del mismo, del 13 de Noviembre de 2019, de HANMI PHARM. CO., LTD.: Un análogo de la insulina que tiene un título de insulina reducido en comparación con la forma nativa, en el que el análogo de la insulina tiene una cadena A […]
Polipéptidos escindibles por enteroquinasa, del 7 de Agosto de 2019, de NOVO NORDISK A/S: Método para producir un polipéptido diana, dicho método que comprende las etapas: a) expresar el polipéptido de fusión escindible por Enteroquinasa que comprende el […]
Procedimiento de preparación mejorado para producción de alto rendimiento de un conjugado de polipéptido fisiológicamente activo, del 5 de Junio de 2019, de HANMI PHARM. CO., LTD.: Un procedimiento para preparar un conjugado de polipéptido fisiológicamente activo - polímero no peptidilo - región constante de inmunoglobulina, […]