Moléculas de ARN de interferencia pequeñas modificadas y métodos de uso.
Un ARN de doble cadena modificado (ARNdc) o ARN corto de interferencia (ARNsi) que interactúa con una secuencia diana de ribonucleótido de virus de hepatitis C (VHC),
virus de hepatitis A, virus de hepatitis B, virus de hepatitis D o virus de hepatitis E, donde dicho ARNdc o ARNsi se une al colesterol, en conjunto con un fármaco reductor de colesterol que es una estatina, resina, gemfibrozilo o clofibrato, para su uso en un método terapéutico para inactivar el virus.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/035493.
Solicitante: NOVARTIS VACCINES AND DIAGNOSTICS, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: INTELLECTUAL PROPERTY - R440 P.O. BOX 8097 EMERYVILLE, CA 94662-8097 ESTADOS UNIDOS DE AMERICA.
Inventor/es: HOUGHTON, MICHAEL, HAN, JANG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N15/113 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Acidos nucleicos no codificantes que modulan la expresión de genes, p.ej. oligonucleótidos antisentido.
PDF original: ES-2441791_T3.pdf
Fragmento de la descripción:
Moléculas de ARN de interferencia pequeñas modificadas y métodos de uso
Antecedentes de la invención La presente invención se refiere al campo de detección de ácido nucleico y al fenómeno de ARN silenciador
o ARN de interferencia (ARNi) . ARN silenciador constituye un fenómeno en el que las moléculas de ARN no codificadoras median supresión de gen específico en un organismo. Por naturaleza, el fenómeno protege al genoma de un organismo de ácidos nucleicos invasores externos tales como transposones, transgenes y genes virales.
La introducción de ARN de doble cadena (ARNdc) en una célula desencadena al ARN silenciador, que después degrada en mARN endógeno correspondiente al ARNdc. Las secuencias de ARN silenciador implican una conversión de ARNdc en ARNs de interferencia cortos (ARNsis) que dirigen ribonucleasas a las dianas de mARN (Baulcombe et al., 2001) . Una enzima llamada Dicer procesa el ARNdc a ARNsis, que tienen una longitud de 20-25 nucleótidos. Los ARNsis se montan en complejos que contienen endorribonucleasa conocidos como complejos silenciadores inducidos por ARN (RISCs) . Posteriormente, los ARNsis guían a los RISCs a moléculas complementarias de ARN, donde los RISCs se parten y destruyen mARN diana. Cantidades pequeñas de ARNdc pueden silenciar una gran cantidad de mARN diana debido a un componente de amplificación de ARN silenciador (Fire et al., Nature, 391:806-811) (1998) ) .
La primera evidencia de que ARNdc produce un gen silenciador eficiente a través de ARNi vino de estudios sobre el nematodo Caenorhabditis elegans (Fire et al., Nature, 391:806-811 (1998) y Patente de Estados Unidos Nº 6.506.559) . Estudios posteriores sobre la mosca de la fruta Drosophila melanogaster demostraron que ARNi es un mecanismo multi-etapa (Elbashir et al., Genes Dev., 15 (2) : 188-200 (2001) ) .
Aunque ARNdc puede medir interferencia mediada por gen en células mamíferas (Wianny, F. y Zernicka-Goetz, M., Nature Cell Bio. 2:70-75 (2000) Svoboda, P. et al., Development 17:4147-4156 (2000) ) , el uso de ARNi en células somáticas mamíferas a menudo está limitado por una activación de proteína quinasa dependiente de ARN (PKR) , que inactiva el factor de traslación eIF2a, causa una supresión generalizada de síntesis de proteína y a menudo causa apoptosis (Gil, J. y Esteban, M., Apoptosis 5:107-114 (2000) ) .
Recientemente, ARNsi de aproximadamente 21 o 22 pares base de longitud, correspondiente a secuencias dirigidas de ARN o ADN, mostró afectar a la expresión de las secuencias dirigidas de células mamíferas (Elbashir, S.M., et al., Nature 411:494-498 (2001) ) . Sin embargo, no está claro que todas las secuencias de ARN o ADN de un genoma de célula de mamífero sean susceptibles a ARNsi. Tampoco es seguro que todos los tipos de célula mamífera posean la maquinaria necesaria para efectuar supresión específica de gen usando ARNsi. Además, ARNsi es de uso limitado por al menos dos razones: (a) la naturaleza temporal del efecto de supresión visto en céulas donde se ha administrado ARNsi, y (b) la necesidad de síntesis química de ARNsis antes de su uso (Tuschl, T., Nature Biotech, 20: 446-448 (2002) ) . También, ya que ARNsis son inestables in vivo, su efectividad a largo plazo es limitada.
Una invención que se dirige a estos retos mejorará la utilidad de ARNi para tratar enfermedad humana en el nivel de actividad de ácido nucleico. En particular, tal invención hará que ARNi sea una terapia más práctica para infecciones virales, tales como infecciones con VHC. Las terapias actuales para tales infecciones virales son muy limitadas, y tienden a tener bajos índices de respuesta.
WO2004/011647 desvela moléculas de ARNsi dirigidas a VHC
US2004/192626 desvela moléculas de ARNsi dirigidas a VHB.
US2003/206887 desvela moléculas de ARNsi dirigidas a VHB y VHC.
Resumen de la invención
La invención proporciona un método para la entrega de ARNsi a hepatocitos en un animal para fines terapéuticos, incluyendo la inactivación de un virus en un animal. El método comprende la administración de un fármaco que reduce el colesterol a un animal en conjunto con la administración de un ARNdc o ARNsi que se modifica para comprender además un colesterol como un ligando de enlace con el receptor (colesterol-ARNsi) . El fármaco que reduce el colesterol puede administrarse antes de, en el mismo momento, o después de la administración del ARNsi etiquetado con colesterol. En una realización preferente, el fármaco que reduce el colesterol es una estatina.
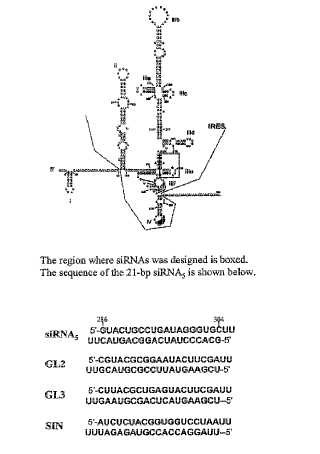
Breve descripción de los dibujos La Fig. 1 representa la secuencia y estructura secundaria de 5’ UTR del genoma de VHC. También proporciona secuencias específicas de ARNsi para inducir ARNi hacia VHC en células hepáticas.
La Fig. 2 proporciona secuencias para varios ARNsis específicos de VHC que son útiles para inducir ARNi hacia VHC en células hepáticas. Cada ARNsi específico de VHC se identifica mediante la designación proporcionada en la primera columna.
La Fig. 3 muestra la secuencia nucleótida del coronavirus SARS.
La Fig. 4 es una representación esquemática de los marcos abiertos de lectura del coronavirus SARS.
La Fig. 5 representa un replicón de VHC subgenómico contenido en la línea celular de hepatoma Huh 7, que se usó para comprobar la eficacia de ARNsi en células humanas de hígado.
La Fig. 6 representa la respuesta de dosis de actividad del luciferasa normalizada en células Huh-7 que contienen el replicón de VHC subgenómico (línea 5-2) , a las que se les administró diferentes concentraciones de ARNsi5. La actividad de luciferasa, que se midió el día 1, 2 y 3 después de la transfección, cayó con dosis crecientes de ARNsi. El ensayo de luciferasa se realizó usando un sistema de ensayo de Luciferasa disponible en Promega Corp. (Madison, WI) , de acuerdo con las instrucciones del fabricante.
La Fig. 7 representa la especificidad de secuencia de ARNsi5 para inducir ARNi dirigido por VHC en células de hígado Huh-7.
La Fig. 8 demuestra que ARNsi5 es no tóxico para células Huh-7. Los niveles de ATPasa se analizaron usando un kit de ensayo de ATPasa disponible en Promega Corp. (Madison, WI) , de acuerdo con las instrucciones del fabricante.
La Fig. 9 representa los efectos de ARNsi5 en la réplica de VHC en células 21-5 (células Huh-7 que contienen VHC de longitud completa) , como lo mide el ensayo de ARN. Los niveles de ARN se analizaron usando el kit de ARN TaqMan™ (F. Hoffman La-Roche, Suiza) , de acuerdo con las instrucciones del fabricante. Los valores se normalizan.
La Fig. 10 demuestra que ARNsi5 no afecta a la viabilidad de células Huh 5-2. Específicamente, ARNm que codifica GAPDH, una enzima esencial para glicolisis se midió en células Huh 5-2 transfectadas con ARNsi5 o ARNsi específico de GAPDH. El gráfico demuestra que ARNsi5 no afectó a los niveles de ARN de GAPDH. GAPDH se midió usando un kit de ARN TaqMan™ (F. Hoffman La-Roche, Suiza) , de acuerdo con las instrucciones del fabricante. Los valores se normalizan.
La Fig. 11 representa una respuesta de dosis de actividad de luciferasa normalizada en células Huh 7 que contienen un replicón de VHC subgenómico (línea 5-2) a las que se administraron diferentes concentraciones de 2’fluoro-ARNsi (2’-F-GL2) , que dirige el gen de luciferasa de la mosca de la fruta. La actividad de luciferasa, que se midió 2 días después de la transfección, cayó con dosis crecientes de ARNsi. El ensayo de luciferasa se realizó usando un kit de Luciferasa Firefly (Promega Corp., Madison, WI) , de acuerdo con las instrucciones del fabricante.
La Fig. 12 demuestra una inhibición de actividad de luciferasa en células 5-2 usando el ARNsi Col-GL2 en ausencia de liposomas.
La Fig. 13 demuestra una autoradiografía de duplicaciones de ARNsi etiquetado con 5’ separadas por PAGE, y muestra la estabilidad de ARN 2’-fluoro-modificado (2’-F-GL2) incubado en suero humano hasta 10 días. Las duplicaciones de ARNsi se sometieron a incubación con suero humano y se analizaron por 20% PAGE. La composición de las calles es la siguiente: Calle 1, 11 y 21: ARNsi etiquetado con 32P-extremo solo; Calles, 2-10, 1220 y 22-25: ARNsi incubado con suero humano. Calles 2 y 12, 1 min.; Calles 3 y 13, 5 min.; Calles 4 y 14, 15 min.; Calles 5 y 15, 30 min.; Calles 6 y 16, 1 hora; Calles 7 y 17, 2 horas; Calles 8 y 18, 4 horas; Calles 9 y 19, 8 horas; Calles 10 y 20, 24 horas; Calles 22, 24 horas; Calles 23, 48 horas; Calles 24, 120 horas; Calles 25, 240 horas de incubación, respectivamente.
La Fig. 14 demuestra el uso de Dicer humano recombinante para convertir ARNdc fluorizado en 2’F-ARNsi.... [Seguir leyendo]
Reivindicaciones:
1. Un ARN de doble cadena modificado (ARNdc) o ARN corto de interferencia (ARNsi) que interactúa con una secuencia diana de ribonucleótido de virus de hepatitis C (VHC) , virus de hepatitis A, virus de hepatitis B, virus de hepatitis D o virus de hepatitis E, donde dicho ARNdc o ARNsi se une al colesterol, en conjunto con un fármaco reductor de colesterol que es una estatina, resina, gemfibrozilo o clofibrato, para su uso en un método terapéutico para inactivar el virus.
2. El ARN modificado y fármaco reductor de colesterol de la reivindicación 1, donde dicho ARNdc modificado o
ARNsi modificado e 2’ modificado.
3. El ARN modificado y fármaco reductor de colesterol de la reivindicación 1, donde dicha modificación se selecciona del grupo consistente en modificación fluoro-, metil-, metoxietil- y propil-.
4. El ARN modificado y fármaco reductor de colesterol de la reivindicación 1, donde dicha modificación fluoro-es una modificación 2’-fluoro- o una modificación 2’, 2’-fluoro.
5. El ARN modificado y fármaco reductor de colesterol de la reivindicación 1, donde al menos una pirimidina de dicho ARNdc o ARNsi se modifica, y dicha pirimidina es citosina, un derivado de citosina, uracil o un derivado de uracil.
6. El ARN modificado y fármaco reductor de colesterol de la reivindicación 1, donde dicho ARNdc o ARNsi
comprende una secuencia “TT” de deoxinucleótido de dos bases en su extremo 3’.
7. El ARN modificado y fármaco reductor de colesterol de la reivindicación 1, donde dicho ARNsi se prepara:
(a) identificando una secuencia diana de nucleótido en un genoma de virus para diseñar un ARN corto de interferencia (ARNsi) , y
(b) producir un ARNsi que se ha modificado para contener al menso un nucleótido modificado.
8. El ARN modificado y fármaco reductor de colesterol de la reivindicación 7, donde dicha secuencia diana de nucleótido se selecciona del grupo consistente en región no trasladada 5’ (5’-UTR) , región no trasladada 3’ (3’-UTR) , núcleo y helicasa NS3 de VHC.
9. El ARN modificado y fármaco reductor de colesterol de la reivindicación 8, donde dicho ARNsi es ARNsi5, como se representa en la figura 1, o ARNsiC1, ARNsiC2, ARNsi5B1, ARNsi5B2 o ARNsi5B4, como se representa en la figura 2.
10. El ARN modificado y fármaco reductor de colesterol de la reivindicación 1, donde dicho ARNsi consiste en aproximadamente de 10 a aproximadamente 30 ribonucleótidos.
11. El ARN modificado y fármaco reductor de colesterol de la reivindicación 10, donde dicho ARNsi modificado es un ARNsi modificado 2’.
12. El ARN modificado y fármaco reductor de colesterol de la reivindicación 11, donde dicha modificación se selecciona del grupo consistente en modificación fluoro-, metil-, metoxietil- y propil-.
13. El ARN modificado y fármaco reductor de colesterol de la reivindicación 12, donde dicha modificación fluoro- es una modificación 2’-fluoro- o una modificación 2’, 2’-fluoro.
14. El ARN modificado y fármaco reductor de colesterol de la reivindicación 13, donde al menos una pirimidina de dicho ARNsi se modifica, y dicha pirimidina es citosina, un derivado de citosina, uracil o un derivado de uracil.
15. El ARN modificado y fármaco reductor de colesterol de la reivindicación 10, donde dicho ARNsi comprende una
secuencia “TT” de deoxinucleótido de dos bases en su extremo 3’.
16. El ARN modificado y fármaco reductor de colesterol de la reivindicación 10, donde ambas cadenas de dicho ARNsi contienen al menos un nucleótido modificado.
Patentes similares o relacionadas:
 Compuestos que modulan la actividad de señalización de las interleucinas 17 y 23, del 29 de Julio de 2020, de Sarepta Therapeutics, Inc: Un método ex vivo de modulación de la actividad de señalización de IL-17 en una célula, que comprende poner en contacto la célula con un oligómero antisentido de morfolino […]
Compuestos que modulan la actividad de señalización de las interleucinas 17 y 23, del 29 de Julio de 2020, de Sarepta Therapeutics, Inc: Un método ex vivo de modulación de la actividad de señalización de IL-17 en una célula, que comprende poner en contacto la célula con un oligómero antisentido de morfolino […]
MicroARN que modulan el efecto de la señalización de glucocorticoides, del 15 de Julio de 2020, de DEUTSCHES KREBSFORSCHUNGSZENTRUM STIFTUNG DES OFFENTLICHEN RECHTS: Un inhibidor de un micro ARN (miR), o de un sitio diana de un miR, en donde miR es miR-379, para su uso en el tratamiento o prevencion de una enfermedad seleccionada […]
Composiciones y métodos para modular la expresión del receptor de la hormona del crecimiento, del 15 de Julio de 2020, de Ionis Pharmaceuticals, Inc: Un compuesto que tiene la siguiente estructura química: **(Ver fórmula)**
Modulación de la expresión de UBE3A-ATS, del 1 de Julio de 2020, de Ionis Pharmaceuticals, Inc: Un oligonucleótido modificado que consiste de 15 a 20 nucleósidos enlazados, en donde la secuencia de nucleobases del oligonucleótido modificado es un 100% […]
Métodos y composiciones para modular la expresión de la apolipoproteína (a), del 1 de Julio de 2020, de Ionis Pharmaceuticals, Inc: Un compuesto para disminuir la expresion de apo(a) que comprende un oligonucleotido modificado constituido por de 15 a 30 nucleosidos ligados y que tiene una secuencia de […]
PROMOTOR INDUCIBLE DEL GEN CRGPDH3 DE CHLAMYDOMONAS REINHARDTII Y SU USO PARA LA EXPRESIÓN DE PROTEÍNAS RECOMBINANTES, del 25 de Junio de 2020, de CENTRO DE INVESTIGACIÓN CIENTÍFICA DE YUCATÁN, A. C: La presente invención se relaciona con un promotor nuclear inducible aislado de la microalga verde de agua dulce Chlamydomonas reinhardtii (promotor […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Ácido nucleico antisentido, del 24 de Junio de 2020, de NIPPON SHINYAKU CO., LTD.: Un oligómero antisentido de 14 a 32 bases de longitud, que comprende dos unidades de oligómeros conectadas seleccionadas del grupo que consiste […]