MICROESFERAS DE LIBERACION PROLONGADA.
Microesfera que comprende:
(1) una proteína o molécula portadora seleccionada de entre el grupo consistente en IgG;
IgM; insulina; hGH; lisozima; alfa-lactoglobulina; factor de crecimiento de fibroblastos básicos; VEGF; quimiotripsina; tripsina, anhidrasa carbónica; ovoalbúmina; fosforilasa b; fosfatasa alcalina; beta-galactosidasa; fibrinógeno; poli-L-lisina; ADN; inmunoglobulinas (por ejemplo, anticuerpos); caseína; colágeno; proteína de soja; y gelatina.;
(2) un polímero soluble en agua;
(3) un primer agente complejante que es un polisacárido polianiónico y
(4) un segundo agente complejante que es un catión metálico divalente seleccionado de entre el grupo consistente en calcio y magnesio
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E07011199.
Solicitante: BAXTER INTERNATIONAL INC.
BAXTER HEALTHCARE SA.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE BAXTER PARKWAY,DEERFIELD, ILLINOIS 60015.
Inventor/es: BROWN, LARRY R., RISKE, FRANK J., BLIZZARD, CHARLES D., RASHBA-STEP, JULIA, SCOTT,TERRENCE,L.
Fecha de Publicación: .
Fecha Solicitud PCT: 12 de Octubre de 2000.
Fecha Concesión Europea: 24 de Febrero de 2010.
Clasificación Internacional de Patentes:
- A61K9/16H6B
- A61K9/16H6F
- A61K9/16H6H
Clasificación PCT:
- A61K9/16 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Aglomerados; Granulados; Microbolitas.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia, Chipre.
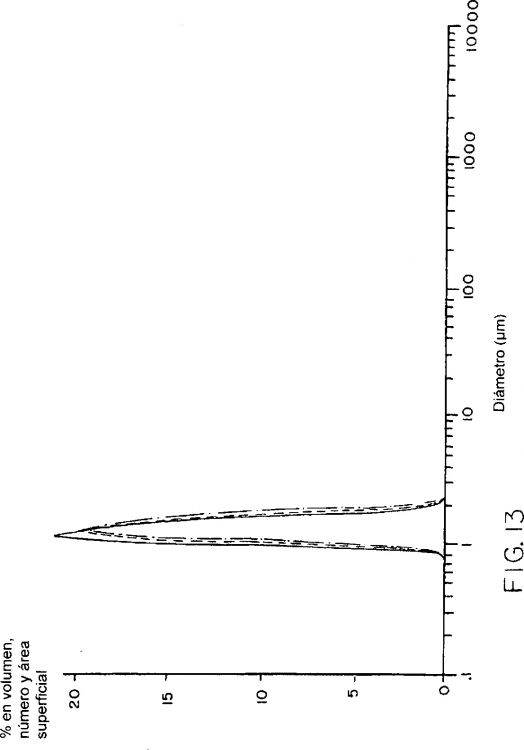
Fragmento de la descripción:
Microesferas de liberación prolongada.
Campo de la invención
La invención se refiere a métodos y composiciones para formar y utilizar microesferas de liberación prolongada. Las microesferas son porosas e incluyen múltiples orificios acanalados con un diámetro inferior a 1.000 angstroms.
Antecedentes de la invención
Las micropartículas, microesferas y microcápsulas, en conjunto denominadas aquí "micropartículas", son partículas sólidas o semisólidas que tienen un diámetro inferior a un milímetro, preferentemente inferior a 100 micras, las cuales pueden estar formadas por diversos materiales, incluyendo polímeros sintéticos, proteínas y polisacáridos. Las micropartículas han sido utilizadas en numerosas aplicaciones diferentes, principalmente separaciones, diagnósticos y suministro de medicamentos.
Los ejemplos más conocidos de micropartículas empleadas en técnicas de separación son aquellas que están formadas por polímeros de origen tanto sintético como proteico, tales como poliacrilamida, hidroxiapatita o agarosa. Estas micropartículas poliméricas normalmente se utilizan para separar moléculas, tales como proteínas, según el peso molecular y/o la carga iónica o por la interacción con moléculas químicamente acopladas a las micropartí- culas.
En el campo del diagnóstico, las micropartículas se utilizan frecuentemente para inmovilizar una enzima, el sustrato para una enzima o un anticuerpo marcado, el cual luego se somete a la interacción con una molécula para ser detectado directa o indirectamente.
En el área del suministro controlado de medicamentos, las moléculas están encapsuladas dentro de las micropartículas o se incorporan en una matriz monolítica para su liberación posterior. Habitualmente se emplean diversas distintas técnicas para elaborar estas micropartículas a partir de polímeros sintéticos, de polímeros naturales, de proteínas y polisacáridos, incluyendo una separación de fases, la evaporación del disolvente, una emulsificación y un secado por pulverización. Generalmente los polímeros forman la estructura soporte de estas microesferas y el medicamento de interés es incorporado en la estructura polimérica. Ejemplos de polímeros empleados para la formación de microesferas incluyen homopolímeros y copolímeros de ácido láctico y de ácido glicólico (PLGA), tal como se describe en la Patente de Estados Unidos Nº 5.213.812 de Ruiz, en la Patente de Estados Unidos Nº 5.417.986 de Reid y col., en la Patente de Estados Unidos Nº 4.530.840 de Tice y col., la Patente de Estados Unidos Nº 4.897.268 de Tice y col., la Patente de Estados Unidos Nº 5.075.109 de Tice y col., la Patente de Estados Unidos Nº 5.102.872 de Singh y col., la Patente de Estados Unidos Nº 5.384.133 de Boyes y col., la Patente de Estados Unidos Nº 5.360.610 de Tice y col., y en la Publicación de Solicitud de Patente Europea Número 248.531 de Southern Research Institute; copolímeros en bloque como tetronic 908 y poloxamer 407, tal como se describe en la Patente de Estados Unidos Nº 4.904.479 de Illum; y polifosfacenos, tal como se describe en la Patente de Estados Unidos Nº 5.149.543 de Cohen y col. Las microesferas elaboradas mediante la utilización de polímeros tales como éstos presentan poca eficacia ante la carga y, a menudo, sólo son capaces de incorporar un pequeño porcentaje del medicamento de interés en la estructura polimérica. Por ello, a menudo se deben administrar cantidades sustanciales de microesferas para conseguir un efecto terapéutico.
Las perlas o partículas esféricas han estado disponibles comercialmente durante muchos años como una herramienta para los bioquímicos. Por ejemplo, anticuerpos conjugados con perlas originan partículas relativamente grandes específicas de ligandos particulares. Normalmente se emplean grandes partículas recubiertas de anticuerpos para reticular los receptores en la superficie de una célula para la activación celular, están unidas a una fase sólida para la purificación por inmunoafinidad y pueden utilizarse para suministrar un agente terapéutico que se libera lentamente en el tiempo, utilizando anticuerpos específicos tisulares o tumorales conjugados con las partículas para dirigir el agente hacia el sitio deseado.
El método más común de unión covalente de un anticuerpo a una matriz de fase sólida consiste en derivatizar una perla con un agente químico de conjugación y entonces unir el anticuerpo a la perla activada. La utilización de una perla sintética polimérica y no de una molécula proteica permite utilizar condiciones de derivatización mucho más severas que las que puedan soportar muchas proteínas, es relativamente barato y a menudo genera un enlace que es estable en un amplio espectro de condiciones desnaturalizantes. Se dispone comercialmente de diversas perlas derivatizadas, todas con diferentes constituyentes y tamaños. Las perlas formadas a partir de polímeros sintéticos, tales como poliacrilamida, poliacrilato, poliestireno o látex, están disponibles comercialmente de numerosas fuentes, como Bio-Rad Laboratories (Richmond, Calif.) y LKB Produkter (Stockholm, Suecia). Las perlas formadas a partir de macromoléculas y partículas naturales tales como agarosa, agarosa reticulada, globulina, ácido desoxirribonucleico y liposomas están disponibles comercialmente de fuentes como Bio-Rad Laboratories, Pharmacia (Piscataway, N.J.) e IBF (Francia). Las perlas formadas a partir de copolímeros de poliacrilamida y agarosa están disponibles comercialmente de fuentes como IBF y Pharmacia. Las perlas magnéticas están disponibles comercialmente de fuentes como Dynal Inc. (Great Neck, N.Y.).
Una desventaja de las micropartículas o perlas actualmente disponibles estriba en que son difíciles y caras de producir. Las micropartículas producidas por medio de estos métodos conocidos tienen una amplia distribución de tamaños de partícula, a menudo carecen de uniformidad y no consiguen presentar una cinética de liberación a largo plazo cuando la concentración de los ingredientes activos es alta. Además, los polímeros utilizados en estos métodos conocidos se disuelven en disolventes orgánicos con el fin de formar las microesferas. Por tanto, las microesferas deben elaborarse en instalaciones especiales diseñadas para manejar disolventes orgánicos. Estos disolventes orgánicos podrían desnaturalizar las proteínas o los péptidos contenidos en las micropartículas. Los disolventes orgánicos residuales podrían ser tóxicos cuando se administran a seres humanos o animales.
Además, las micropartículas disponibles rara vez vez tienen un tamaño lo suficientemente pequeño como para justo atravesar los orificios del tamaño de una aguja comúnmente utilizados para administrar la terapéutica o como para ser útiles en la administración vía inhalación. Por ejemplo, las micropartículas preparadas empleando ácido glicólico poliláctico (PLGA) son grandes y tienden a agregarse. Es necesaria una etapa de selección de tamaño, lo que resulta en una pérdida de producto, para eliminar aquellas partículas demasiado grandes como para su inyección. Aquellas partículas de PLGA con un tamaño adecuado para su inyección deben ser administradas mediante una aguja de gran calibre para corresponderse al gran tamaño de partícula, con frecuencia causando molestias al paciente.
Generalmente, todas las microesferas actualmente disponibles están activadas para liberar su contenido en medios acuosos y, por tanto, deben ser liofilizadas para impedir su liberación prematura. Además, las partículas como aquellas preparadas mediante el sistema de PLGA presentan una cinética de liberación basada tanto en la erosión como en la difusión. En este tipo de sistema, se observa una explosión inicial o una liberación rápida del medicamento. Este efecto de explosión puede resultar en efectos secundarios no deseados en aquellos pacientes a quienes se han administrado las partículas.
Actualmente se dispone de micropartículas preparadas utilizando lípidos para encapsular medicamentos diana. Por ejemplo, para encapsular medicamentos solubles en agua con el fin de su suministro posterior, tal como se describe en la Patente de Estados Unidos Nº 5.422.120 de Sinil Kim. En general estas partículas tienen un tamaño superior a 10 µm y están diseñadas para la administración articular, intratecal, subcutánea o epidural. Como alternativa, para el suministro intravenoso de pequeñas moléculas se han utilizado liposomas. Los liposomas son partículas esféricas compuestas por bicapas múltiples o simples de fosfolípidos y colesterol. Los liposomas tienen un tamaño de 30 µm o superior...
Reivindicaciones:
1. Microesfera que comprende:
2. Microesfera según la reivindicación 1, caracterizada porque la proteína o molécula portadora es inmunoglobulina.
3. Microesfera según la reivindicación 1 ó 2, caracterizada porque la microesfera contiene del 40 a menos del 100% de proteína.
4. Microesfera según la reivindicación 1, caracterizada porque el polímero soluble en agua es un polímero basado en un hidrocarburo.
5. Microesfera según la reivindicación 1, caracterizada porque el polímero soluble en agua es un hidroxietilalmidón.
6. Microesfera según cualquiera de las reivindicaciones anteriores, caracterizada porque el polímero soluble en agua se selecciona de entre el grupo consistente en los polímeros solubles en agua de la Tabla 2, preferentemente un polímero basado en un hidrocarburo y en especial hetalmidón.
7. Microesfera según la reivindicación 1, caracterizada porque el polisacárido polianiónico se selecciona de entre el grupo consistente en sulfato de dextrano, ácidos galacturónicos, alginatos, ácido manurónico, ácido gulurónico, ácido hialurónico, sulfatos de condroitina, heparina, quitina, quitosano, glicosaminoglicanos, proteoglicanos y agentes complejantes catiónicos (es decir agentes complejantes que tienen una carga positiva).
8. Microesfera según la reivindicación 1, caracterizada porque el polisacárido polianiónico es sulfato de dextrano.
9. Microesfera según la reivindicación 1, caracterizada porque el catión metálico divalente es calcio.
10. Microesfera según la reivindicación 1, caracterizada porque el catión metálico divalente es magnesio.
11. Microesfera según la reivindicación 1, caracterizada porque la microesfera tiene una superficie lisa que incluye múltiples orificios acanalados, teniendo cada uno de dichos orificios acanalados un diámetro que es inferior a 1.000 angstroms.
12. Microesfera según la reivindicación 1, caracterizada porque la microesfera no contiene aceites o disolventes orgánicos detectables.
13. Microesfera según la reivindicación 1, que comprende además un agente terapéutico.
14. Microesfera según cualquiera de las reivindicaciones anteriores, caracterizada porque el agente activo se selecciona de entre el grupo consistente en los agentes activos de la Tabla 4, preferentemente una hormona liberadora de la hormona luteinizante (LH-RH) o un análogo de la misma, preferentemente leuprolida.
15. Microesfera según cualquiera de las reivindicaciones anteriores, que comprende además un agente complejante, preferentemente sulfato de dextrano, y un agente activo, preferentemente acetato de leuprolida.
16. Jeringuilla que contiene un única dosis de las microesferas según cualquiera de las reivindicaciones anteriores, caracterizada porque la jeringuilla preferentemente incluye además una aguja que tiene un tamaño de diámetro interior de calibre 14 a 30.
17. Método para formar una microesfera según se define en cualquiera de las reivindicaciones 1 a 15, que comprende:
18. Método según la reivindicación 17, caracterizado porque la formación de la mezcla acuosa se lleva a cabo mediante la combinación en esencia simultánea de la proteína de la molécula portadora o, el polímero soluble en agua, el primer agente complejante y el segundo agente complejante.
19. Método según la reivindicación 17, que comprende además el paso de:
20. Método según la reivindicación 19, caracterizado porque el paso de poner en contacto la microesfera con la solución del agente activo resulta en un rendimiento de incorporación de al menos el 60%, preferentemente de al menos el 70%, al menos el 80%, al menos el 90% y en particular de al menos el 95% o al menos el 98% del agente activo.
21. Método según la reivindicación 17, 18 ó 19, que comprende además el paso de:
22. Microesfera que comprende:
23. Microesfera según la reivindicación 22, caracterizada porque la proteína portadora es una albúmina o una inmunoglobulina.
24. Microesfera según la reivindicación 22 ó 23, caracterizada porque la proteína se selecciona de entre el grupo consistente en las proteínas portadoras de la Tabla 1.
25. Microesfera según cualquiera de las reivindicaciones 22 a 24, caracterizada porque la microesfera contiene del 40 a menos del 100% de proteína.
26. Microesfera según la reivindicación 22, caracterizada porque el polímero soluble en agua es un polímero basado en hidrocarburos.
27. Microesfera según la reivindicación 22, caracterizada porque el polisacárido polianiónico se selecciona de entre el grupo consistente en sulfato de dextrano, ácidos galacturónicos, alginatos, ácido manurónico, ácido gulurónico, ácido hialurónico, sulfatos de condroitina, heparina, quitina, quitosano, glicosaminoglicanos, proteoglicanos y agentes complejantes catiónicos (es decir agentes complejantes que tienen una carga positiva).
28. Microesfera según la reivindicación 22, caracterizada porque el polisacárido polianiónico es sulfato de dextrano.
29. Microesfera según la reivindicación 22, caracterizada porque el catión metálico divalente es calcio.
30. Microesfera según la reivindicación 22, caracterizada porque el catión metálico divalente es magnesio.
31. Microesfera según la reivindicación 22, caracterizada porque la microesfera tiene una superficie lisa que incluye múltiples orificios acanalados, teniendo cada uno de dichos orificios acanalados un diámetro que es inferior a 1.000 angstroms.
32. Microesfera según la reivindicación 22, caracterizada porque la microesfera no contiene aceites o disolventes orgánicos detectables.
33. Microesfera según la reivindicación 22, que comprende además un agente terapéutico.
34. Microesfera según cualquiera de las reivindicaciones 22 a 33, caracterizada porque el agente activo se selecciona de entre el grupo consistente en los agentes activos de la Tabla 4, preferentemente la hormona liberadora de la hormona luteinizante (LH-RH) o un análogo de la misma, preferentemente leuprolida.
35. Microesfera según cualquiera de las reivindicaciones 22 a 34, caracterizada porque la macromolécula es albúmina, preferentemente seroalbúmina humana, y el polímero soluble en agua es un polímero basado en hidrocarburos.
36. Microesfera según cualquiera de las reivindicaciones 22 a 35, que comprende además un agente complejante, preferentemente sulfato de dextrano, y un agente activo, preferentemente acetato de leuprolida.
37. Jeringuilla que contiene un única dosis de las microesferas según cualquiera de las reivindicaciones 22 a 36, caracterizada porque la jeringuilla preferentemente incluye además una aguja que tiene un tamaño de diámetro interior de calibre 14 a 30.
38. Método para formar una microesfera según se define en cualquiera de las reivindicaciones 22 a 36, que comprende:
39. Método según la reivindicación 38, caracterizado porque la formación de la mezcla acuosa se lleva a cabo mediante la combinación en esencia simultánea de la proteína portadora, el polímero soluble en agua, el primer agente complejante y el segundo agente complejante.
40. Método según la reivindicación 38, que comprende además el paso de:
41. Método según la reivindicación 40, caracterizado porque el paso de poner en contacto la microesfera con la solución del agente activo resulta en un rendimiento de incorporación de al menos el 60%, preferentemente de al menos el 70%, al menos el 80%, al menos el 90% y en particular de al menos el 95% o al menos el 98% del agente activo.
42. Método según la reivindicación 38, 39 ó 40, que comprende además el paso de:
43. Microesfera que comprende:
44. Microesfera según la reivindicación 43, caracterizada porque la proteína portadora es una albúmina o una inmunoglobulina.
45. Microesfera según la reivindicación 43 ó 44, caracterizada porque la proteína se selecciona de entre el grupo consistente en las proteínas portadoras de la Tabla 1.
46. Microesfera según cualquiera de las reivindicaciones 43 a 45, caracterizada porque la microesfera contiene del 40 a menos del 100% de proteína.
47. Microesfera según la reivindicación 43, caracterizada porque el polímero soluble en agua es un polímero basado en hidrocarburos.
48. Microesfera según la reivindicación 43, caracterizada porque el polímero soluble en agua es un hidroxietilalmidón.
49. Microesfera según cualquiera de las reivindicaciones 43 a 48, caracterizada porque el polímero soluble en agua se selecciona de entre el grupo consistente en los polímeros solubles en agua de la Tabla 2, preferentemente un polímero basado en hidrocarburos, y en particular, hetalmidón.
50. Microesfera según la reivindicación 43, caracterizada porque el polisacárido polianiónico se selecciona de entre el grupo consistente en ácidos galacturónicos, alginatos, ácido manurónico, ácido gulurónico, ácido hialurónico, sulfatos de condroitina, quitina, quitosano, glicosaminoglicanos, proteoglicanos y agentes complejantes catiónicos (es decir agentes complejantes que tienen una carga positiva).
51. Microesfera según la reivindicación 43, caracterizada porque el catión metálico divalente es calcio.
52. Microesfera según la reivindicación 43, caracterizada porque el catión metálico divalente es magnesio.
53. Microesfera según la reivindicación 43, caracterizada porque la microesfera tiene una superficie lisa que incluye múltiples orificios acanalados, teniendo cada uno de dichos orificios acanalados un diámetro que es inferior a 1.000 angstroms.
54. Microesfera según la reivindicación 43, caracterizada porque la microesfera no contiene aceites o disolventes orgánicos detectables.
55. Microesfera según la reivindicación 43, que comprende además un agente terapéutico.
56. Microesfera según cualquiera de las reivindicaciones 43 a 55, caracterizada porque el agente activo se selecciona de entre el grupo consistente en los agentes activos de la Tabla 4, preferentemente la hormona liberadora de la hormona luteinizante (LH-RH) o un análogo de la misma, preferentemente leuprolida.
57. Microesfera según cualquiera de las reivindicaciones 43 a 56, caracterizada porque la macromolécula es albúmina, preferentemente seroalbúmina humana, y el polímero soluble en agua es un polímero basado en hidrocarburos, preferentemente hetalmidón.
58. Microesfera según cualquiera de las reivindicaciones 43 a 57, que comprende además un agente complejante y un agente activo, preferentemente acetato de leuprolida.
59. Jeringuilla que contiene una única dosis de las microesferas según cualquiera de las reivindicaciones 43 a 58, caracterizada porque la jeringuilla preferentemente incluye además una aguja que tiene un tamaño de diámetro interior de calibre 14 a 30.
60. Método para formar una microesfera según las reivindicaciones 43 a 58, que comprende:
61. Método según la reivindicación 60, caracterizado porque la formación de la mezcla acuosa se lleva a cabo mediante la combinación en esencia simultánea de la proteína portadora, el polímero soluble en agua, el primer agente complejante y el segundo agente complejante.
62. Método según la reivindicación 60, que comprende además el paso de:
63. Método según la reivindicación 62, caracterizado porque el paso de poner en contacto la microesfera con la solución del agente activo resulta en un rendimiento de incorporación de al menos el 60%, preferentemente de al menos el 70%, al menos el 80%, al menos el 90% y en particular de al menos el 95% o al menos el 98% del agente activo.
64. Método según la reivindicación 60, 61 ó 62, que comprende además el paso de:
Patentes similares o relacionadas:
FORMA FARMACÉUTICA HINCHABLE QUE COMPRENDE GOMA GELLAN, del 22 de Diciembre de 2011, de Egalet Ltd: Forma farmacéutica en forma particulada para la administración oral de uno o más principios activos, comprendiendo la forma farmacéutica un vehículo en forma particulada que […]
FORMULACIÓN DE LIBERACIÓN LENTA BASADA EN UNA ASOCIACIÓN DE GLUCÓGENO Y ALGINATO, del 7 de Diciembre de 2011, de AZIENDE CHIMICHE RIUNITE ANGELINI FRANCESCO A.C.R.A.F. S.P.A.: Formulación farmacéutica que comprende por lo menos un principio activo disperso en una matriz que comprende por lo menos un excipiente de […]
FORMULACIONES SÓLIDAS DE OSPEMIFENO, del 19 de Septiembre de 2011, de HORMOS MEDICAL LTD.: Una formulación sólida de un fármaco, que comprende granulados que contienen 30 a 90 mg de ospemifeno o una de sus sales farmacéuticamente aceptables en combinación con una […]
COMPOSICIONES Y MÉTODOS PARA REDUCCIÓN DEL OXALATO, del 14 de Julio de 2011, de OXTHERA, INC: Una composición que comprende partículas que contienen una o más enzimas degradantes del oxalato incrustadas en un primer material polímero, en donde la enzima incrustada […]
NUEVA FORMA DE SUPOSITORIO QUE COMPRENDE UN COMPUESTO ACTIVO ÁCIDO-LÁBIL, del 5 de Julio de 2011, de NYCOMED GMBH: Un supositorio para compuestos activos ácido-lábiles, en donde el compuesto ácido-lábil es un inhibidor de la bomba de protones ácido-lábil, una sal […]
 PREMEZCLA ALIMENTARIA MEDICAMENTOSA QUE COMPRENDE HIDROCLORURO DE CLORTETRACICLINA, del 7 de Abril de 2011, de Alpharma, LLC: Premezcla alimentaria medicamentosa, que comprende: 15% en peso a 65% en peso de un hidrocloruro de clortetraciclina farmacéuticamente aceptable, 20% en peso a 85% […]
PREMEZCLA ALIMENTARIA MEDICAMENTOSA QUE COMPRENDE HIDROCLORURO DE CLORTETRACICLINA, del 7 de Abril de 2011, de Alpharma, LLC: Premezcla alimentaria medicamentosa, que comprende: 15% en peso a 65% en peso de un hidrocloruro de clortetraciclina farmacéuticamente aceptable, 20% en peso a 85% […]
COMPOSICIÓN SÓLIDA QUE CONTIENE ESPORAS DE BACTERIAS NO PATÓGENAS DEL GÉNERO BACILLUS, del 7 de Abril de 2011, de SANOFI-AVENTIS S.P.A: Composición sólida de esporas de bacterias no patogénicas del género Bacillus adsorbidas sobre una matriz formada: - por al menos un compuesto adsorbente […]
COMPOSICIÓN FARMACÉUTICA QUE COMPRENDE LOS DERIVADOS DE 2,3-DIHIDRO-6-NITROIMIDAZO[2,1-B]OXAZOL, del 28 de Marzo de 2011, de OTSUKA PHARMACEUTICAL CO., LTD.: Composición farmacéutica que comprende: (I) por lo menos un compuesto oxazol seleccionado de entre el grupo constituido por compuestos de 2,3-dihidro-6-nitroimidazo[2,1-b]oxazol […]