METODO PARA PRODUCIR ALERGENOS PRINCIPALES RBET V 1 HIPOALERGENICOS DE ABEDUL.
Procedimiento para la preparación de alergenos principales del polen de abedul rBet v 1 hipoalergénicos mediante una o varias etapas de purificación cromatográfica con el uso como eluyentes de bases acuosas esencialmente no tamponadas y a continuación neutralización,
caracterizado por que se emplea como producto de partida una proteína cruda rBet v 1 soluble preparada con métodos recombinantes
Tipo: Resumen de patente/invención. Número de Solicitud: W0301246EP.
Solicitante: MERCK PATENT GMBH.
Nacionalidad solicitante: Alemania.
Dirección: FRANKFURTER STRASSE 250,64293 DARMSTADT.
Inventor/es: SUCK, ROLAND, FIEBIG, HELMUT, CROMWELL, OLIVER.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- C07K14/415 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de vegetales.
Clasificación PCT:
- C07K1/113 C07K […] › C07K 1/00 Procedimientos generales de preparación de péptidos. › sin cambio de la estructura primaria.
- C07K1/36 C07K 1/00 […] › por una combinación de varios procesos de diferentes tipos.
- C07K14/415 C07K 14/00 […] › de vegetales.
Clasificación antigua:
- C07K1/113 C07K 1/00 […] › sin cambio de la estructura primaria.
- C07K1/36 C07K 1/00 […] › por una combinación de varios procesos de diferentes tipos.
- C07K14/415 C07K 14/00 […] › de vegetales.
Fragmento de la descripción:
Método para producir alergenos principales rBet v 1 hipoalergénicos de abedul.
Ámbito técnico de la invención
La invención se refiere a un procedimiento para la preparación de alergenos de polen de abedul que se caracterizan por la ausencia, o como mínimo una reducción, de la unión a inmunoglobulina E, es decir, se caracterizan por su hipoalergenicidad. Estos alergenos conservan totalmente la estimulación de células T terapéuticamente relevante. Por tanto, se pueden emplear como agentes terapéuticos con pocos efectos secundarios para inmunoterapia específica.
Antecedentes de la invención
Las alergias del tipo 1 han aumentado dramáticamente en todo el mundo durante las últimas décadas. Hasta el 20% de la población de los países industrializados sufre de dolencias, como rinitis alérgica, conjuntivitis o asma bronquial, provocadas por alergenos que se encuentran en el aire (aeroalergenos), que son liberados por diferentes fuentes, como polen vegetal, ácaros, mamíferos (gatos, perros, caballos) y mohos. Las alergias graves también pueden desencadenarse por picaduras de insectos, como por ejemplo, abejas y avispas.
Las sustancias desencadenantes de las alergias de tipo 1 son proteínas, glicoproteínas o polipéptidos. Estos alergenos reaccionan, tras la absorción a través de las mucosas o tras la picadura, con los anticuerpos IgE unidos en la superficie de los mastocitos de personas sensibilizadas. Si dos o más anticuerpos IgE se unen entre sí a través de un alérgeno, esto conduce a la producción de mediadores (p. ej., histamina, prostaglandinas) y citoquinas a través de células efectoras y por tanto conduce a la activación de los síntomas alérgicos. Entre los pólenes de árboles, el polen de abedul es el que desencadena más frecuentemente reacciones alérgicas (Jarolim E. y col., 1989, Allergy 44:385-95). Más del 90% de las personas que sufren de alergia al polen de abedul poseen anticuerpos IgE contra el alérgeno principal Bet v 1 (Elfman, L. y col., 1997, Int. Arch. Allergy Immunol., 113: 249-51).
Con ayuda de las secuencias de ADNc es posible preparar alergenos recombinantes que se pueden emplear en el diagnóstico y la terapia de las alergias. (Scheiner y Kraft, 1995, Allergy 50, 384-391). La preparación de alergenos recombinantes Bet v 1 (rBet v 1) y su purificación con fines farmacéuticos ha sido descrita p. ej. por Hoffmann-Sommergruber y col. (Protein Exp. Purif. 9 (1), 1997: 33-39).
Además, son posibles modificaciones mediante ingeniería genética dirigidas de los alergenos recombinantes, con lo que se puede alcanzar un potencial alergénico reducido (Schramm y col., 1999, J. Immunol. 162 (4): 2406-2414; Valenta y col., 1999, Biol. Chem. 380: 815-24; Singh y col., 1999, Int. Arch. Allergy Immunol. 119: 75-85). Dichas variantes de alergenos son futuros candidatos prometedores para la inmunoterapia específica de la alergia de tipo 1.
Sin embargo, un inconveniente potencial en las variantes de alergenos recombinantes es que mediante la modificación de la estructura primaria se pierden los epítopos de células T necesarios para el éxito terapéutico o se reduce su actividad. Esta posibilidad sólo se puede eludir si la estructura primaria correspondiente al alérgeno natural sirve como base para la preparación de la proteína recombinante.
En el caso del alérgeno principal del polen de abedul Bet v 1, para optimizarlo con fines terapéuticos mediante métodos recombinantes, es decir, para reducir la capacidad de unión a IgE, se preparó en dos mitades (Vrtala, S., y col., 1997, J. Clin. Invest. 99: 1673-81) o como trímero (Vrtala, S., y col., 1999, Int. Arch. Allergy Immunol. 118:218-9). En estos enfoques también resulta un inconveniente la pérdida potencial de los epítopos de células T, así como la insolubilidad de las proteínas. Otro inconveniente a considerar aquí es la costosa técnica de preparación de estas variantes rBet v 1.
Por consiguiente, un enfoque apropiado para la preparación de un alérgeno principal recombinante rBet v 1 que se pueda emplear con fines terapéuticos sería por tanto una molécula que equivaliera al tipo salvaje en la estructura primaria, no estuviera limitada en su estimulación de células T, pero presentara una actividad IgE reducida, es decir, fuera hipoalergénica.
Este objetivo se ha alcanzado en el marco de la presente invención mediante la realización de una serie de etapas de purificación bioquímica conocidas con el uso de alergenos principales recombinantes rBet v 1 solubles como producto de partida. Sorprendentemente, en las proteínas purificadas de este modo se ha comprobado una actividad IgE reducida y al mismo tiempo una estimulación de células T conservada.
Por consiguiente, el procedimiento según la invención proporciona una eficacia terapéutica mejorada y al mismo tiempo una clara reducción o ausencia de efectos secundarios.
Así, es de especial importancia el diseño del procedimiento de preparación de los alergenos recombinantes, ya que como consecuencia de este procedimiento las proteínas adquieren una conformación que no presenta ninguna afinidad con IgE o la presenta muy reducida, manteniéndose la estimulación de células T.
Figuras
Figura 1A: SDS-PAGE para la caracterización de rBet v 1 hipoalergénica
Rastro 1: Patrón de proteína para la estimación del peso molecular
Rastro 2: nBet v 1 natural
Rastro 3: rBet v 1 purificada según la invención
Rastro 4: rBet v 1 purificada de forma convencional
Figura 1B: Transferencia a nitrocelulosa del SDS-PAGE de la Fig. 1A
Figura 2A: Transferencia a nitrocelulosa para la determinación de la actividad IgE con 20 sueros de pacientes individuales
Posición 3: nBet v 1 natural
Posición 4: rBet v 1 purificada según la invención
Posición 5: rBet v 1 purificada de forma convencional
Figura 2B: Transferencia a nitrocelulosa para la determinación de la identidad de las muestras Bet v 1
Manchas 21-26: Diferentes anticuerpos policlonales anti-Bet v 1 de conejo
Mancha 27: Anticuerpo 6B6 monoclonal anti-Bet v 1 de ratón
Figura 3: Enzym-Allergo-Sorbent-Test (EAST) para la cuantificación de la unión a IgE
En el eje vertical se indica la concentración de un inhibidor de la unión IgE-Bet v 1 en ng/ml, en el eje horizontal se indica el grado de la inhibición en [%].
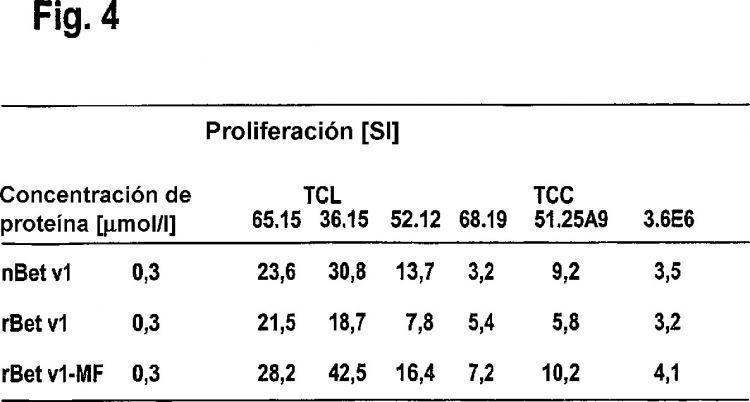
Figura 4: Determinación de la estimulación de células T por parte de variantes Bet v 1. Se comparan las concentraciones de nBet v 1 natural, de rBet v 1 recombinante purificada de forma convencional, así como de rBet v 1 recombinante purificada según la invención y los correspondientes índices de estimulación (SI) obtenidos con diferentes líneas de células T (TCL) y clones de células T (TCC).
Descripción detallada de la invención
La presente invención trata de un procedimiento de purificación bioquímica que a través de una purificación eficaz de, por ejemplo, alergenos producidos con métodos recombinantes, mediante el uso de eluyentes especiales, conduce a la obtención de proteínas con las propiedades modificadas según la invención.
Estas propiedades consisten en una ausencia de actividad IgE, como mínimo una actividad IgE fuertemente reducida, manteniendo al mismo tiempo la estimulación de células T.
Por tanto, es objeto de la presente invención un procedimiento para la reducción de la actividad IgE del alérgeno principal del polen de abedul rBet v 1, que consiste en el uso de alergenos principales del polen de abedul recombinantes rBet v 1 solubles, así como en la realización de las siguientes etapas de cromatografía descritas para su purificación y de la posterior etapa de neutralización.
Además, es objeto de la invención un procedimiento para la preparación de alergenos principales del polen de abedul rBet v 1 hipoalergénicos mediante varias etapas de purificación cromatográfica con el uso como eluyente de bases acuosas esencialmente no tamponadas y una neutralización posterior, empleándose como producto de partida una proteína cruda rBet v 1 soluble preparada mediante métodos recombinantes.
Las etapas de purificación cromatográfica comprenden preferiblemente cromatografía de intercambio aniónico, cromatografía de interacción hidrofóbica, así como filtración en gel y se pueden realizar una vez, varias veces sucesivamente o varias veces alternativamente. Sin...
Reivindicaciones:
1. Procedimiento para la preparación de alergenos principales del polen de abedul rBet v 1 hipoalergénicos mediante una o varias etapas de purificación cromatográfica con el uso como eluyentes de bases acuosas esencialmente no tamponadas y a continuación neutralización, caracterizado por que se emplea como producto de partida una proteína cruda rBet v 1 soluble preparada con métodos recombinantes.
2. Procedimiento según la reivindicación 1, caracterizado por que la proteína cruda rBet v 1 soluble preparada con métodos recombinantes se expresa en E. coli.
3. Procedimiento según la reivindicación 1 o 2, caracterizado por que las etapas de purificación cromatográfica comprenden cromatografía de intercambio aniónico, cromatografía de interacción hidrofóbica y filtración en gel.
4. Procedimiento según una o varias de las reivindicaciones 1 a 3, caracterizado por que las etapas de purificación cromatográfica se realizan en el orden siguiente: primera filtración en gel, cromatografía de intercambio aniónico, cromatografía de interacción hidrofóbica, segunda filtración en gel.
5. Procedimiento según una o varias de las reivindicaciones 1 a 4, caracterizado por que la base utilizada como eluyente se emplea en un intervalo de concentración de 5 mM a 100 mM, preferiblemente 5 mM a 40 mM.
6. Procedimiento según una o varias de las reivindicaciones 1 a 5, caracterizado por que la base utilizada como eluyente es NaOH.
7. Procedimiento según una o varias de las reivindicaciones 1 a 6, caracterizado por que al eluyente se le añade una sal neutra inorgánica y dado el caso NaHCO3.
8. Procedimiento según una o varias de las reivindicaciones 1 a 7, caracterizado por que la sal neutra inorgánica añadida al eluyente es NaCl.
9. Procedimiento según una o varias de las reivindicaciones 6 a 8, caracterizado por que las concentraciones de las sustancias NaOH, NaCl y NaHCO3 contenidas en el eluyente se selecciona de manera que en la etapa de neutralización incluida en la purificación se pueden ajustar las concentraciones típicas de una solución fisiológica salina.
10. Procedimiento según una o varias de las reivindicaciones 1 a 9, caracterizado por que la proteína cruda rBet v 1 se pre-purifica cromatográficamente en una solución tamponada y/o mediante precipitación de sal.
11. Procedimiento para la reducción de la actividad IgE del alérgeno principal del polen de abedul rBet v 1, caracterizado por que un alérgeno principal del polen de abedul rBet v 1 soluble preparado con métodos recombinantes se somete a uno de los procedimientos descritos en las reivindicaciones 1 a 10.
12. Alérgeno principal del polen de abedul rBet v 1 hipoalergénico, que se puede obtener según uno de los procedimientos descritos en las reivindicaciones 1 a 10.
13. Alérgeno principal del polen de abedul rBet v 1 hipoalergénico, según la reivindicación 12, como medicamento.
14. Uso del alérgeno principal del polen de abedul rBet v 1 hipoalergénico según la reivindicación 12 para la preparación de un medicamento para la inmunoterapia específica de alergias en cuya activación está implicado el alérgeno principal del polen de abedul Bet v 1.
15. Preparación farmacéutica que contiene un alérgeno principal del polen de abedul rBet v 1 hipoalergénico según la reivindicación 12, así como dado el caso excipientes y/o coadyuvantes.
Patentes similares o relacionadas:
Plantas con rendimiento incrementado y método de obtención de dichas plantas, del 15 de Julio de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS): Método para mejorar por lo menos un carácter fenotípico seleccionado de entre el rendimiento en semillas, la velocidad de germinación o el crecimiento […]
Polinucleótidos aislados y métodos y plantas que usan los mismos para regular la acidez de las plantas, del 10 de Junio de 2020, de The State of Israel, Ministry of Agriculture and Rural Development, Agricultural Research Organization, (A.R.O.), Volcani Cent: Una célula de planta o una planta que comprende una construcción de ácido nucleico que comprende una secuencia de ácido nucleico que codifica un polipéptido […]
Gen Cullin1 modificado, del 3 de Junio de 2020, de RIJK ZWAAN ZAADTEELT EN ZAADHANDEL B.V.: Gen Cullin1 modificado que comprende una modificación en la secuencia de nucleótidos de Cullin1 de tipo salvaje de SEQ ID NO: 1:, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: […]
Anticuerpos anti-ricina y sus usos, del 8 de Abril de 2020, de HER MAJESTY THE QUEEN IN RIGHT OF CANADA AS REPRESENTED BY THE MINISTER OF NATIONAL DEFENCE: Un anticuerpo, aislado o purificado, o fragmento de este, que comprende una cadena ligera variable que comprende una CDR L1 de secuencia KASQDINNYLR […]
Ensayo mejorado para el diagnóstico de alergia al cacahuete, del 1 de Abril de 2020, de EUROIMMUN MEDIZINISCHE LABORDIAGNOSTIKA AG: Un vehículo útil para el diagnóstico que comprende un medio para capturar específicamente un anticuerpo contra un epítopo del extremo C-terminal […]
Combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, y utilización en procedimientos de detección y selección, del 1 de Abril de 2020, de Institut national de recherche pour l'agriculture, l'alimentation et l'environnement: Utilización de una combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, comprendiendo dicha combinación, respectivamente: […]
Péptidos antiinflamatorios, y usos de los mismos, del 25 de Marzo de 2020, de Nuritas Limited: Péptido seleccionado de SEQ ID NO: 343 ó 344. Variante antiinflamatoria de un péptido según la reivindicación 1, que tiene de 1 a 3 alteraciones […]
Proteínas de armazón derivadas de cistatinas vegetales, del 18 de Marzo de 2020, de UNIVERSITY OF LEEDS: Una proteína de armazón sintética que comprende la secuencia: NSLEIEELARFAVDEHNKKENALLEFVRVVKAKEQ(Xn)TMYYLTLEAKDGGKKKLYEAKVWVK( Xn)NFKELQEFKPVGDA (SEQ ID NO: 4) o una secuencia […]