Enriquecimiento en dos etapas del ADN acelular en el plasma materno.
Un procedimiento para enriquecer el ácido nucleico fetal que comprende tratar una muestra biológicade un huésped materno que contiene ácido nucleico fetal acelular con una composición que comprende un agentecon actividad ADNasa,
en el que un primer porcentaje de ácido nucleico fetal en la muestra biológica previa altratamiento es más bajo que un segundo porcentaje de ácido nucleico fetal en la muestra biológica tras eltratamiento y en el que un primer porcentaje del ácido nucleico materno en la muestra biológica previa al tratamientoes mayor que un segundo porcentaje de ácido nucleico materno en la muestra biológica después del tratamiento.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2009/032614.
Solicitante: NOVARTIS AG.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35 4056 BASEL SUIZA.
Inventor/es: BISCHOFF,FARIDEH.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N15/09 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12N15/10 C12N 15/00 […] › Procedimientos para el aislamiento, la preparación o la purificación de ADN o ARN (preparación química de ADN o ARN C07H 21/00; preparación de polinucleótidos no estructurales a partir de microorganismos o con la ayuda de enzimas C12P 19/34).
- C12Q1/34 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que interviene una hidrolasa.
- C12Q1/68 C12Q 1/00 […] › en los que intervienen ácidos nucleicos.
PDF original: ES-2389038_T3.pdf
Fragmento de la descripción:
Enriquecimiento en dos etapas del ADN acelular en el plasma materno.
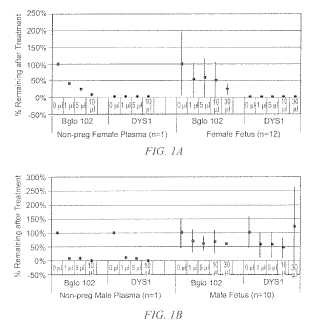
Aunque aparece ADN fetal en el plasma materno, los niveles son relativamente bajos como para permitir realizar un análisis genético prenatal de rutina. Sin estar ligado a ninguna teoría, los autores consideran que la porción de ADN fetal está empaquetada y, por tanto, protegida de las endonucleasas plasmáticas. Se propone una nueva técnica de enriquecimiento que combina dos procedimientos diferenciados. En primer lugar el plasma separado se trata con ADNasa para disminuir de forma eficaz el porcentaje de fragmentos contaminantes de ADN materno acelular. El aumento posterior de secuencias fetales se logra usando una técnica de amplificación del genoma completo (WGA, por sus siglas en inglés) modificada.
Procedimientos: el plasma se aisló de la sangre completa materna (n=24) ; a continuación, se trató con concentraciones crecientes de ADNasa. El ADN tratado con ADNasa se procesó adicionalmente usando el mini kit de extracción de ADN de Qiagen antes de un protocolo WGA modificado para enriquecer en fragmentos de ADN más pequeños. La presencia de secuencias fetales se confirmó usando PCR en tiempo real (PCR-TR) Taqman para determinar los niveles de º-globina y de secuencias DYS1.
Resultados: las secuencias de ADN fetal se detectaron siguiendo todos los tratamientos de ADNasa. La detección correcta de fetos varones se consiguió en todas las muestras en las que se confirmó que había un feto varón (n=10) tanto antes como después de la WGA. Además de la correcta determinación del género, las muestras (n=7) que se sometieron a la cantidad más alta de ADNasa así como al protocolo de WGA modificado mostraron un enriquecimiento significativo de secuencias fetales, consiguiendo el 50% del ADN fetal.
Conclusiones: los resultados confirman que el ADN fetal en plasma está protegido y es resistente a la degradación debido al tratamiento con ADNasa. Estos datos preliminares también sugieren que puede conseguirse un nivel óptimo de tratamiento con ADNasa que permite un enriquecimiento adicional usando WGA. La observación de que la ADNasa elimina predominantemente secuencias maternas siguiere que el ADN fetal acelular está empaquetado forma diferenciada con respecto al equivalente materno, lo que permite el enriquecimiento preferencial de las secuencias fetales.
INTRODUCCIÓN
El diagnóstico genético prenatal depende de procedimientos invasivos como la amniocentesis o el muestreo de vellosidades coriónicas (CVS, por sus siglas en inglés) . Aunque estos procedimientos han proporcionado resultados fiables durante muchos años siguen comportando un pequeño riesgo para el feto (1) . Desde el descubrimiento de ácidos nucleicos acelulares fetales amplificables en el plasma materno (2) , se han realizado numerosos estudios cuyo objetivo era determina el potencial de las pruebas genéticas prenatales clínicas no invasivas. Aunque muchos de estos estudios se ha mostrado muy prometedores, las pequeñas cantidades existentes de ADN fetal han hecho que sea difícil implementarlas a nivel clínico. Por tanto, los autores de la patente se han centrado en la mejora de los procedimientos de aislamiento y enriquecimiento de ADN fetal. Sin estar ligado a ninguna teoría, se considera que estos nucleótidos en circulación son el resultado de las células fetales que sufren apoptosis (3) . La estabilidad relativa de ADN y ARN acelular en plasma, que se sabe contiene nucleasas, sugiera que estos ácidos nucleicos están en circulación dentro de vesículas ligadas a membrana formadas como resultado del mecanismo de muerte celular programada (4) . Estos fragmentos de ADN fetal también se distinguen de los fragmentos maternos en base al tamaño, siendo los fragmentos fetales generalmente menores (<300 pb) que los fragmentos maternos (>500 pb) (5; Jorgez C. y col., 2007) . Dhallen y col. (JAMA 2004; 291 (9) 1114-1119) describen que la adición de formaldehído a las muestras de sangre materna, conjugada con protocolos de procesamiento cuidadosos, aumenta el porcentaje relativo de ADN fetal libre, proporcionando una base para el desarrollo de pruebas diagnósticas prenatales no invasivas para distinguir el ADN fetal del ADN materno en la circulación materna. Jorgez y Bischoff (Fetal Diagnosis and Therapy 2009; 25 (3) : 314-319) describen que la combinación de electroforesis para la separación por tamaño y la WGA llevan al enriquecimiento en ADN fetal del plasma. Huang y col. (Annals of the New York Academy of Sciences 2006: 308-312) compararon procedimientos manuales y automáticos de extracción de ADN y describieron que aunque con el procedimiento manual se producía más ADN acelular total, el sistema automático producía cantidades más altas de ADN acelular de origen fetal. Además, el ADN aislado usando el sistema automático parecía tener una mayor pureza que el aislado mediante el procedimiento manual, con pocos inhibidores para las reacciones posteriores a la PCR en tiempo real.
Los autores describen un nuevo procedimiento en dos etapas para el enriquecimiento de fragmentos fetales. La primera etapa supone el tratamiento del plasma materno total (que contiene tanto fragmentos de ADN materno como fetal) con ADNasa. Dado que los fragmentos fetales son más estables y probablemente están empaquetados por membranas unidas a cuerpos apoptóticos, se establece la hipótesis de que el tratamiento con ADNasa podría eliminar el total de secuencias derivadas de la madre (no empaquetadas) . La segunda etapa supone un protocolo de amplificación del genoma completo (WGA) modificado diseñado para amplificar los fragmentos más pequeños, preferiblemente fetales.
PROCEDIMIENTOS
Tras la aprobación del CIR y la obtención del consentimiento informado, se extrajeron un total de 24 muestras de sangre completa (10 embarazos de varones confirmados, media de edad de gestación 18 1/7 semanas oscilando de 11 4/7 a 25 2/7 semanas; 12 embarazos de hembras confirmados; media de edad de gestación 20 1/14 semanas oscilando de 9 6/7 a 37 4/7 semanas y 2 controles sin embarazo, una mujer y un varón) . Para cada caso, se procesaron aproximadamente 30 ml de sangre obtenidos con vacutainer ACD mediante una centrifugación inicial a 800 g durante 10 min para separar el plasma de la fracción celular. La fracción plasmática se retiró y se centrifugó de nuevo a 16.000 g durante 10 min para eliminar de nuevo cualquier contaminación por partículas celulares. A continuación, esta fracción se congeló en alícuotas de 800 µl y, posteriormente, se descongelaron para el procesamiento simultáneo del lote. Cada muestra de plasma de 800 µl se descongeló a temperatura ambiente y después se sometió a tratamiento con ADNasa (Promega, Nº de catálogo M6101) a diversas concentraciones (sin tratar, 1µl, 5µl, 10µl, 30µl de una unidad/µl) . Las muestras se incubaron a 37ºC durante una hora antes de añadir la solución de parada. A continuación, las muestras se sometieron a extracción usando el mini kit para sangre QiAamp de Qiagen (Nº de catálogo 51106) y se eluyó un volumen final de 100 µl. Con leves modificaciones, se siguió el protocolo de amplificación del genoma completo (WGA) GenomaPlex® (Sigma, Nº Cat. WGA2-50rxn) en siete muestras de sangre materna (4 varones confirmados y 3 hembras confirmadas) . Se modificó el procedimiento omitiendo en primer lugar la incubación de fragmentación sugerida por el fabricante debido al tamaño previsto de las secuencias diana. En segundo lugar se aumentó a 20 el número de ciclos en la fase de amplificación en lugar de los 14 sugeridos. Las muestras amplificadas se conservaron a 4ºC hasta el análisis por PCR-TR para la detección y cuantificación de -globina (BGL0345F: GTG CAC CTG ACT CCT GAG GAG A, BGLO455R: CCT TGA TAC CAA CCT GCC CAG) (6) y DYS1 (DYS1F: TCC TGC TTA TCC AAA TTC ACC AT, DYS1R: ACT TCC CTC TGA CAT TAC CTG ATA ATT G) (7) (Applied Biosystems 7700, Foster City, CA) . El nivel de enriquecimiento se determinó en base al % de ADN fetal que se calculó como relación entre DYS1 y -globina. La -globina representa la cantidad total de ADN aislado, materno y fetal, mientras que en los embarazos de varones confirmados DSY1 representa la cantidad de ADN fetal presente en la muestra.
RESULTADOS
Tras los tratamientos iniciales con ADNasa en las muestras controles sin embarazo, tanto los niveles de -globina como de DYS1 disminuían en función de la cantidad de enzima añadida. En cada caso se eliminó de forma eficaz mediante el tratamiento con ADNasa. (Figura 1) . En las muestras maternas, aunque los niveles detectados de -globina disminuyeron, estos niveles eran persistentes... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para enriquecer el ácido nucleico fetal que comprende tratar una muestra biológica de un huésped materno que contiene ácido nucleico fetal acelular con una composición que comprende un agente con actividad ADNasa, en el que un primer porcentaje de ácido nucleico fetal en la muestra biológica previa al tratamiento es más bajo que un segundo porcentaje de ácido nucleico fetal en la muestra biológica tras el
tratamiento y en el que un primer porcentaje del ácido nucleico materno en la muestra biológica previa al tratamiento es mayor que un segundo porcentaje de ácido nucleico materno en la muestra biológica después del tratamiento.
2. El procedimiento de la reivindicación 1, en el que la muestra biológica es una muestra de sangre de un huésped materno.
3. El procedimiento de la reivindicación 1, en el que la muestra biológica es una muestra de plasma o 10 suero de un huésped materno.
4. El procedimiento de la reivindicación 1, en el que el agente con actividad ADNasa es ADNasa.
5. El procedimiento de la reivindicación 1, en el que el agente con actividad ADNasa es ADNasa y la cantidad de ADNasa es de aproximadamente 10 a 200 unidades/µl.
6. El procedimiento de la reivindicación 1, en el que el segundo porcentaje es de aproximadamente el 15 10% al 50%.
7. El procedimiento de la reivindicación 1, en el que el segundo porcentaje es de aproximadamente el 10%, 20%, 30%, 40% o 50%.
8. El procedimiento de la reivindicación 1 que además comprende la amplificación del ácido nucleico fetal en la muestra biológica tras el tratamiento.
9. El procedimiento de la reivindicación 1 que además comprende la amplificación del ácido nucleico fetal en la muestra biológica tras el tratamiento mediante el procedimiento de amplificación del genoma completo (WGA) .
10. El procedimiento de la reivindicación 9, en el que el procedimiento de WGA se realiza sin incubación de fragmentación.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Anticuerpo anti-FGF23 y composición farmacéutica que comprende el mismo, del 15 de Julio de 2020, de Kyowa Kirin Co., Ltd: Anticuerpo o fragmento funcional del mismo que se une a la totalidad o a una parte del epítopo de FGF23 humano, al que se une un anticuerpo producido […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Producción de vectores de expresión y selección de células de alta capacidad de procesamiento, del 8 de Julio de 2020, de Kymab Limited: Un método para producir células que codifican un repertorio de anticuerpos que comprende cadenas pesadas y cadenas ligeras de anticuerpo cognadas, comprendiendo dicho […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]
Anticuerpo anti-Notch 4 humano, del 1 de Julio de 2020, de EISAI R&D MANAGEMENT CO., LTD: Un anticuerpo anti-Notch4 o un fragmento de unión a Notch4 de este, donde dicho anticuerpo o un fragmento de unión a Notch4 de este comprende cadenas pesadas y ligeras y […]
Vacuna de ADN contra pseudotuberculosis en peces marinos, del 1 de Julio de 2020, de NATIONAL UNIVERSITY CORPORATION TOKYO UNIVERSITY OF MARINE SCIENCE AND TECHNOLOGY: Una vacuna de ADN para peces, caracterizada por: - impartir inmunidad contra la pseudotuberculosis causada por Photobacterium damselae subsp. piscicida - que comprende, […]