DERIVADOS DE 9-DESOXO-9A-AZA-9A-METIL-9A-HOMOERITROMICINA A.
Un pseudopolimorfo isoestructural sustancialmente puro de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A que tiene la Fórmula I:
** ver fórmula** en la que S es un disolvente orgánico que es al menos parcialmente miscible en agua e y es 0 y x es 1, y en la que el pseudopolimorfo está caracterizado por que el grupo espacial monoclínico P21 y el promedio de parámetros de celda unitaria a 22ºC son: a = 16,368(5) Amstrongs, b = 1-6,301 (3) Amstrongs, c = 18,408(5) Amstrongs, Alfa = Gamma = 90º y Beta = 110,04(2)º. donde los datos entre paréntesis indican la variación estadística del último dígito del parámetro indicado
Tipo: Resumen de patente/invención. Número de Solicitud: W0300987IB.
Solicitante: PLIVA HRVATSKA D.O.O.
Nacionalidad solicitante: Croacia.
Dirección: ULICA GRADA VUKOVARA 49,10000 ZAGREB.
Inventor/es: LAZAREVSKI, GORJANA, FILIC, DARKO, DUMIC, MILJENKO, DANILOVSKI, ALEKSANDAR, ORESIC, MARINA, VINKOVIC, MLADEN, MESTROVIC,ERNEST, DUMBOVIC,ALOJZ, KNEZEVIC,ZDRAVKA, CINCIC,DOMINIK, LAZARIC,KATICA, BUCAR,DEJAN-KRESIMIR.
Fecha de Publicación: .
Fecha Concesión Europea: 19 de Agosto de 2009.
Clasificación Internacional de Patentes:
- C07H17/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › Compuestos que contienen radicales heterocíclicos unidos directamente a los heteroátomos de los radicales sacárido.
- C07H17/08F
Clasificación PCT:
- A61K31/70 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Hidratos de carbono; Azúcares; Sus derivados (sorbitol A61K 31/047).
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
- A61P33/02 A61P […] › A61P 33/00 Agentes antiparasitarios. › Antiprotozoarios, p. ej. para la leishmaniasis, tricomoniasis, toxoplasmosis.
- C07H17/00 C07H […] › Compuestos que contienen radicales heterocíclicos unidos directamente a los heteroátomos de los radicales sacárido.
- C07H17/08 C07H […] › C07H 17/00 Compuestos que contienen radicales heterocíclicos unidos directamente a los heteroátomos de los radicales sacárido. › Heterociclos que contienen ocho o más miembros cíclicos, p. ej. eritromicinas.
Clasificación antigua:
- A61K31/70 A61K 31/00 […] › Hidratos de carbono; Azúcares; Sus derivados (sorbitol A61K 31/047).
- A61P31/04 A61P 31/00 […] › Agentes antibacterianos.
- A61P33/02 A61P 33/00 […] › Antiprotozoarios, p. ej. para la leishmaniasis, tricomoniasis, toxoplasmosis.
- C07H17/00 C07H […] › Compuestos que contienen radicales heterocíclicos unidos directamente a los heteroátomos de los radicales sacárido.
- C07H17/08 C07H 17/00 […] › Heterociclos que contienen ocho o más miembros cíclicos, p. ej. eritromicinas.
Fragmento de la descripción:
Derivados de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A
Campo de la invención
Esta invención se refiere a nuevos pseudopolimorfos isoestructurales de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A, a un proceso para la preparación de dichos pseudopolimorfos, a formulaciones farmacéuticas que incorporan los mismos y a métodos de uso de dichas formulaciones en el tratamiento de infecciones bacterianas y protozoarias y enfermedades relacionadas con la inflamación.
Antecedentes de la invención
La 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A es el primer y todavía el único antibiótico macrólido semi-sintético comercializado de 15 miembros del grupo de las azalidas [The Merck Index, 12ª Ed. (1996), pág. 157 (946)]. Tiene la fórmula
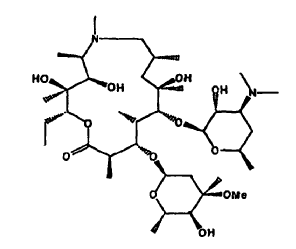
La síntesis de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A se describe en la Patente de Estados Unidos Nº 4.517.359. Se conocen bien su espectro antibacteriano (J. Antimicrob. Chemother., 1987, 19.275), modo de acción (Antimicrob. Ag. Chemother., 1987, 31, 1939) y farmacología (J. Antimicrob. Chemother. 1993,31, Supl. E, 1-198).
Se da 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A en forma amorfa y en varias formas cristalinas diferentes caracterizadas por diferentes disposiciones de los átomos en la red cristalina. La mayoría de las formas son cristalinas, conteniendo sus celdas unitarias cristalinas, además de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A, diferentes números de moléculas de agua y/o moléculas de disolvente (pseudopolimorfos).
Se describe 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A anhidra amorfa, que tiene un punto de fusión de 113-115ºC, en la Patente de Estados Unidos Nº 4.517.359. Puede obtenerse por evaporación del disolvente a partir de una solución en cloroformo de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A en bruto. No es cristalina pero en lugar de un producto amorfo, parece una masa de espuma sólida. Puede obtenerse un producto puro a escala de laboratorio, por cromatografía del producto final en bruto o por disolución de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A monohidrato o dihidrato cristalino puro en un disolvente orgánico, seguido por evaporación del disolvente. De este modo, puede obtenerse 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A amorfa anhidra. Este procedimiento no es adecuado para fabricación a gran escala.
La preparación de diversas formas amorfas, cristalinas solvatadas e hidratadas de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A se han descrito en la bibliografía de patentes. Véanse, por ejemplo, los documentos U.S. 4.474.768; U.S. 6.245.903; EP1 103 558; CN 1 093370; CN 1 161971; WO 99/58541; WO 00/32203; WO 01/00640; WO 02/09640; WO 02/10144; WO 02/15842; WO 02/10181 y WO 02/42315. Los materiales producidos de esta manera se han visto sometido a diversas desventajas incluyendo pérdida de pureza, inestabilidad, higroscopicidad y similares.
Se preparó 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A dihidrato no higroscópico ya a mediados de 1980 mediante la neutralización de una solución ácida de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A en una mezcla de acetona-agua. Su estructura cristalina (cristal simple) se evaluó tras la recristalización en éter y se caracterizó por el grupo espacial ortorrómbico P 212121. Los parámetros de celda unitaria, es decir, los ejes cristalinos a = 17,860 Å, b = 16,889 Å y c = 14,752 Å y los ángulos entre los ejes cristalinos, a = ß = ? = 90º, se publicaron en 1987 en el Encuentro de Químicos de Croacia (Book of Abstracts, Meeting of Chemists of Croatia, Feb. 19-20, 1987, pág. 29). Desde entonces, su estructura cristalina y su preparación se describen en detalle (J. Chem. Res. (S), 1988, 152, Ibid., miniprint 1988, 1239; recibido el 4 de junio de 1987; Cambridge Crystallographic Data Base: GEGJAD).
Posteriormente, en la Patente de Estados Unidos Nº 6.268.489 se describió 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A dihidrato. Esa patente describió la preparación del dihidrato por cristalización en tetrahidrofurano y hexano con la adición de agua. Por tanto, el producto formado es cristalino y puede obtenerse a escala comercial de forma pura. Sin embargo, su preparación se somete a varias desventajas asociadas con el uso de disolventes tóxicos orgánicos, inmiscibles en agua y la necesidad de un control cuidadoso en el secado del mismo.
Se han descrito otras técnicas para preparar el dihidrato en la bibliografía de patentes, por ejemplo, en los documentos U.S. 5.869.629; EP 0 941 999; EP 1 103 558; HR P 921491; WO 01/49697; y WO 01/87912. Diversos de los procedimientos que se han descrito implican la precipitación del dihidrato por recristalización en disolventes miscibles en agua mediante la adición de agua. Sin embargo, los productos formados por estos y otros procesos que se describen en la bibliografía se ven sometidos a varias desventajas distintas, que varían desde la necesidad de tratar materiales de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A farmacéuticamente puros hasta el rendimiento, pureza y homogeneidad de los propios productos. De hecho, los productos formados por diversas técnicas de la técnica anterior incorporan cantidades que difieren de disolventes combinados y adsorbidos y agua y, por tanto, que imparten características de estabilidad irregular, pureza, liberación y potencia cuando se incorporan en formulaciones farmacéuticas.
Está entre los objetos de la presente invención proporcionar varios nuevos polimorfos isoestructurales de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A de estructuras cristalinas predeterminadas y que, en virtud de dichas estructuras, proporcionan propiedades más uniformes y previsibles en las formulaciones farmacéuticas.
Sumario de la invención
Esta invención se refiere a un pseudopolimorfo isoestructural sustancialmente puro de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A, que tiene la fórmula I
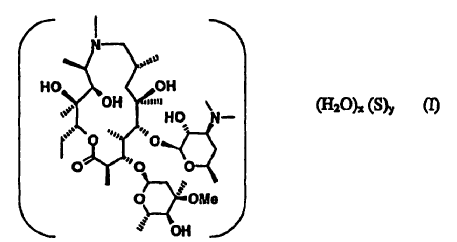
en la que
S es un disolvente orgánico que es al menos parcialmente miscible con agua,
x es 1,
y es 0,
caracterizándose los pseudopolimorfos por el grupo espacial monoclínico P 21 y el promedio de parámetros de celda unitaria a 22ºC son longitudes de ejes cristalinos de a = 16,368(5) Å, b = 16,301 (3) Å y c = 18,408(5) Å y los ángulos entre los ejes cristalinos de a = ? = 90º y ß = 110,04(2)º, donde los datos entre paréntesis indican la variación estadística del último dígito del parámetro indicado.
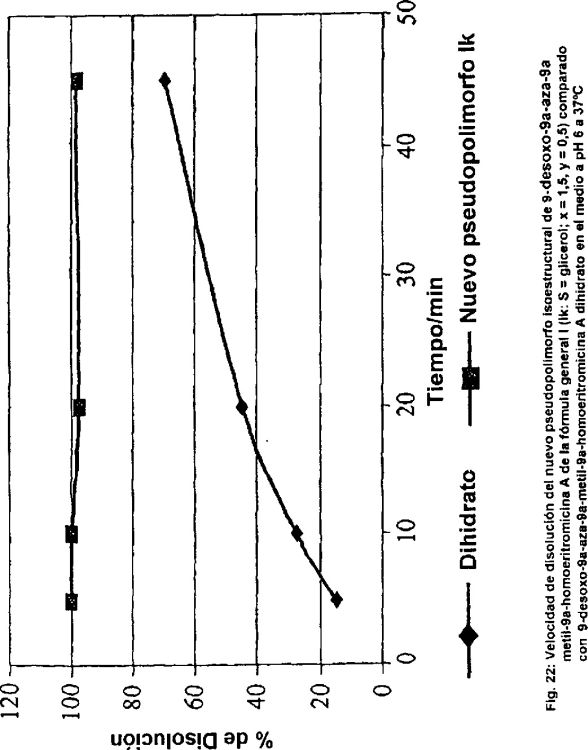
El pseudopolimorfo isoestructural de la invención se identifica como el compuesto Ia en la Tabla 1 a continuación, cuyo empaquetamiento cristalino se ilustra en la Figura 2 de los dibujos adjuntos. También se describen pseudopolimorfos isoestructurales relacionados. Estos se identifican como compuestos Ib a Im en la Tabla I a continuación y se ilustran en las Figuras 3 a 14. Como se ilustran, son compuestos que tienen empaquetamiento cristalino único con formación de canal separado en sus celdas unitarias (véase la Figura 15). Como consecuencia de la formación de canal pueden equiparse de moléculas de agua y/o disolvente en sus cavidades y retirarse después del secado para proporcionar formas en estado sólido isoestructurales, es decir, el pseudopolimorfo de la invención, que tiene una estructura cristalina única como que se caracteriza por su grupo espacial monoclínico P 21 y la longitud de sus ejes cristalinos y los ángulos intermedios de sus celdas unitarias.
Se conoce por los libros de texto que los hidratos y/o los solvatos en general de cualquier compuesto deben definirse como formas en estado sólido que deben tener moléculas cristalinas de agua y/o disolvente en la unidad asimétrica de la celda unitaria cristalina además del resto del compuesto núcleo. Además, estas moléculas hidratadas y/o solvatadas deben encontrarse en proporción estequiométrica al resto de compuesto núcleo y, por lo tanto, son claramente distinguibles de las moléculas adsorbidas de agua y/o disolvente.
La cristalografía de rayos X es el único método que debe usarse en una caracterización inequívoca analíticamente y válida de dichos hidratos y/o solvatos. Únicamente pueden usarse diversos métodos térmicos (por ejemplo, TGA o DSC) junto con determinaciones de contenido de agua y/o disolvente (por ejemplo, determinaciones...
Reivindicaciones:
1. Un pseudopolimorfo isoestructural sustancialmente puro de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A que tiene la Fórmula I:
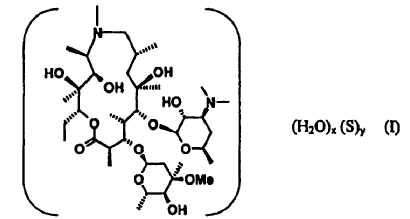
en la que S es un disolvente orgánico que es al menos parcialmente miscible en agua e y es 0 y x es 1, y en la que el pseudopolimorfo está caracterizado por que el grupo espacial monoclínico P21 y el promedio de parámetros de celda unitaria a 22ºC son:
a = 16,368(5) Å,
b = 1-6,301 (3) Å,
c = 18,408(5) Å,
a = ? = 90º y
ß = 110,04(2)º.
donde los datos entre paréntesis indican la variación estadística del último dígito del parámetro indicado.
2. Un pseudopolimorfo isoestructural sustancialmente puro de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A como se ha indicado en la reivindicación 1, que no contiene más del 10% de otro compuesto.
3. Un pseudopolimorfo isoestructural sustancialmente puro de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A como se ha indicado en la reivindicación 2, que no contiene más del 5% de otro compuesto.
4. Un pseudopolimorfo isoestructural sustancialmente puro de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A como se ha indicado en cualquiera de las reivindicaciones 1 a 3, que no contiene más del 10% de ninguna otra forma cristalina o amorfa de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A.
5. Un pseudopolimorfo isoestructural sustancialmente puro de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A de acuerdo con la reivindicación 4, que no contiene más del 5% de ninguna otra forma cristalina o amorfa de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A.
6. Una composición farmacéutica que comprende un pseudopolimorfo isoestructural sustancialmente puro de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A, como se ha definido en cualquiera de las reivindicaciones 1 a 5, junto con un vehículo farmacéuticamente aceptable.
7. Un pseudopolimorfo isoestructural sustancialmente puro de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A como se ha indicado en cualquiera de las reivindicaciones 1 a 6, para uso en terapia médica.
8. El uso de un pseudopolimorfo isoestructural sustancialmente puro de 9-desoxo-9a-aza-9a-metil-9a-homoeritromicina A, como se ha indicado en cualquiera de las reivindicaciones 1 a 6, en la preparación de un medicamento para el tratamiento de infecciones bacterianas y protozoarias o enfermedades relacionadas con la inflamación.
Patentes similares o relacionadas:
Terapias de combinación para el tratamiento de la enfermedad de Alzheimery transtornos relacionados, del 19 de Marzo de 2020, de THE GENERAL HOSPITAL CORPORATION: Combinación farmacéutica que comprende un primer compuesto y un segundo compuesto para su uso en disminuir la progresión de o en el tratamiento […]
Complejos de galio, composiciones farmacéuticas y métodos de uso, del 15 de Marzo de 2017, de Odonate Therapeutics, LLC: Un compuesto que comprende galio iónico en un complejo con un ligando seleccionado del grupo que consiste en histidina, carnosina y ácido mandélico, y en donde la ratio de ligando […]
Procedimiento de preparación de derivados 4''-sustituidos de 9-desoxo-9a-aza-9a-homoeritromicina A, del 2 de Noviembre de 2016, de Zoetis Services LLC: Un procedimiento de preparación de un compuesto de fórmula 1a **Fórmula** o una sal farmacéuticamente aceptable del mismo, haciendo reaccionar un compuesto de […]
Derivados bicíclicos de morfina-6-glucurónido, su preparación y su aplicación en terapéutica, del 12 de Marzo de 2014, de SANOFI: Compuesto de fórmula general (I)**Fórmula** en la que : R1 representa un átomo de hidrógeno o un grupo alquilo (C1-C4). R2 representa un grupo hidroxilo, un grupo tiol, […]
Síntesis de morfina-6-glucurónido o de uno de sus derivados, del 12 de Marzo de 2014, de SANOFI: Procedimiento de preparación de morfina-6-glucurónido o uno de sus derivados, que comprende las etapas que consisten: (i) en hacer reaccionar […]
Derivados de morfina-6-glucurónido, proceso para su preparación y su uso en terapia, del 26 de Febrero de 2014, de SANOFI: Compuesto de fórmula general (I):**Fórmula** en la que: R1 es un grupo heterocíclico aromático de 5 eslabones eventualmente sustituido con uno o varios sustituyentes […]
 Compuestos macrólidos dotados de actividad antiinflamatoria, del 22 de Agosto de 2012, de ZAMBON S.P.A.: Compuesto de fórmula
en la que
R1 es un grupo -X-R3 en el que
X es un grupo -C(≥O)-, -C(≥O)-NH- o -SO2- y
R3 es un átomo de hidrógeno, […]
Compuestos macrólidos dotados de actividad antiinflamatoria, del 22 de Agosto de 2012, de ZAMBON S.P.A.: Compuesto de fórmula
en la que
R1 es un grupo -X-R3 en el que
X es un grupo -C(≥O)-, -C(≥O)-NH- o -SO2- y
R3 es un átomo de hidrógeno, […]
Agentes antibacterianos que comprenden conjugados de glucopéptidos y elementos peptídicos asociados a la membrana, del 30 de Mayo de 2012, de CAMBRIDGE ENTERPRISE LIMITED: Un compuesto antibacteriano de fórmula V-L-W-X; en la que V es un resto glucopeptídico que inhibe la biosíntesis de peptidoglucano en bacterias; L es un grupo ligador; […]