Método para la cuantificación fluorimétrica de la enzina LDH en disolución.
Método para la cuantificación fluorimétrica de la enzima LDH en disolución.
La invención está dirigida al desarrollo de un método y creación de un kit para la cuantificación del efecto citotóxico y/o viabilidad celular ante agentes químicos (elemento, compuesto, mezcla o fármaco en cualquier de sus estados) y/o físicos (i.e. iluminación, temperatura, turbulencia, fluidodinámica, etc.) que puedan producir rotura de la membrana celular. El kit mide la liberación de la enzima citoplasmática lactato deshidrogenasa (LDH) proveniente de células muertas y/o lisadas. Esta enzima cataliza la oxidación del lactato, presente en el kit, a piruvato. Durante la reacción, el NAD+, también presente en el kit, es reducido a NADH. La concentración de LDH, se cuantifica a través de la fluorescencia del NADH formado. Las mediciones indirectas de la enzima LDH se realizan en el sobrenadante de cultivos celulares. El método es aplicable tanto en medios inorgánicos para microalgas como en medios comerciales para células animales y de insecto.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201300775.
Solicitante: UNIVERSIDAD DE ALMERIA.
Nacionalidad solicitante: España.
Inventor/es: MOLINA GRIMA,EMILIO, GARCIA CAMACHO, FRANCISCO, SANCHEZ MIRON,ASTERIO, GALLARDO RODRÍGUEZ,Juan José, LÓPEZ ROSALES,Lorenzo.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/32 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › una deshidrogenosa.
- G01N33/50 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
Fragmento de la descripción:
MÉTODO PARA LA CUANTIFICACIÓN FLUORIMÉTRICA DE LA ENZIMA
LDH EN DISOLUCIÓN
CAMPO DE LA INVENCIÓN
La presente invención se refiere al desarrollo de un procedimiento para la
cuantificación de la enzima lactato deshidrogenasa (LDH) en disolución acuosa mediante técnicas fluorimétricas. El procedimiento desarrollado podrá utilizarse para cuantificar concentraciones de la enzima LDH sea cual sea su origen. Se podrán preparar kits para hacer más práctica y comercializable la aplicación de la invención.
ESTADO DE LA TÉCNICA
Los procedimientos actuales para determinar concentraciones de enzima LDH en disolución son aplicados principalmente al análisis clínico y a la determinación de la viabilidad celular en cultivos celulares. Existen además métodos de cuantificación que se 15 basan en principios parecidos y que suelen ser comercializados en forma de kits.
Muchos de los métodos para cuantificación clínica se basan en la oxidación del lactato a piruvato por la acción de la enzima LDH, y la reducción de la forma oxidada del cofactor nicotinamida adenina dinucleótido (NAD^) a su forma reducida (NADH) (ver Figura 1). La concentración de NADH generada se sigue por espectrofotometría de 20 absorción y la concentración de LDH se correlaciona con la concentración de NADH generado.
Así, se pueden encontrar en el mercado los siguientes kits basados en la reacción y el método de detección antes mencionados: «Reactivo LDH-L» de Thermo Fischer Scientific, Inc.; kit «Ref.7096» de Far Diagnostics, SRL.; «Lactate dehydrogenase Reagent Set» de Pointe Scientific, Inc.; «LDH liqui-V» de Stanbio Laboratory. La metodología empleada en 5 todos estos kits presenta dos importantes inconvenientes: la espectrofotometría de absorción es una técnica poco sensible y en el máximo de absorción del NADH absorben otras sustancias orgánicas como los compuestos nitrogenados. Faltaría, por tanto, el desarrollo de un método de cuantificación que se basase en una técnica de detección más sensible y selectiva.
Los métodos para determinar la viabilidad o respuesta citotóxica de células
expuestas a un tóxico, o a determinadas condiciones de cultivo, son claves para la investigación farmacéutica, medioambiental, en tests de pesticidas, biotecnología en general, etc. La determinación de la viabilidad celular para evaluar cualquier tipo de exposición necesita de un método preciso, rápido y fiable.
Los métodos más comunes para cuantificar la viabilidad celular se basan en la
capacidad de la membrana de las células viables de excluir ciertos marcadores como el azul de trypan o yoduro de propidio. Por tanto, las células viables no se tiñen con dichos marcadores. Por el contrario, células muertas o en fase de muerte, que han perdido la integridad de la membrana celular, permiten el paso de estos marcadores al citoplasma
donde se unen a varias moléculas u orgánulos celulares marcándolos y permitiendo así la distinción entre células viables y no viables.
Otros métodos para determinar viabilidad celular se basan en la alteración de propiedades físicas y/o químicas de un determinado marcador, en función de cambios celulares; por ejemplo, alteración del espectro de absorción de radiación electromagnética. Por tanto, siguiendo el grado de conversión del marcador de un estado a otro se puede 5 cuantificar la viabilidad celular. La mayoría de este tipo de marcadores, como las sales de tetrazolio, tienen grupos aceptores de electrones. Estas incluyen el MTT (bromuro de 3- (4,5-dimetilthiazol-2-il)-2,5-difeniltreazolio), XTT (hidrato ácido de 3-{(l-fenilamino- carbonil)-3,4-treazolio}-bis(4-metoxi-6-nitro) benceno sulfónico) y el MTS (sal de 3-(4,5- dimetiltiazol-2-il)-5-(3carboximetoxifenil)-2-(4-sulfofenil)-2H-tretrazolio). Un método 10 típico para medir viabilidad celular usando MTS fue descrito por Buttke y col. (J. Immunol. Meth. 1993, 157: 233-240).
Las células no viables que han perdido la integridad celular también liberan componentes citoplasmáticos al medio. La medida de la concentración de dichos componentes en el medio permite determinar el progreso de la muerte celular. Uno de estos 15 métodos se basa en la medida de la gliceraldehído-3-fosfato deshidrogenasa (G3PDH) (Corey y col., J. Immunol. Meth. 1997, 207:43-51) mediante la producción de trifosfato de adenosina (ATP).
Una gran cantidad de reacciones redox del metabolismo celular responsable de la generación de energía utilizan NADH o la forma reducida de la nicotinamida adenina 20 dinucleótido fosfato (NADPH) como donadores de protones (Duningan y col., Biotechniques 1995, 19:640-649). Aunque, en teoría, podría seguirse la concentración de estas dos especies espectrofotométricamente, su determinación directa mediante esta
técnica es difícil porque existen numerosas sustancias celulares que absorben luz cerca de la longitud que corresponde al máximo de absorción para NADH y NADPH (256 nm); por ejemplo, NAD+, NADP+, RNA y la mayoría de las proteínas tienen máximos de absorción alrededor de los 260 nm.
Buttke y col. (J. Immunol. Meth. 1993,157: 233-240) describen cómo se usa el MTS
para medir la reducción causada por las células vivas mediante el cambio de absorbancia desde la forma oxidada a la reducida del MTS. La combinación de MTS y el agente transferente de electrones (PMS) es un método útil para el seguimiento y cuantificación del NADH y NADPH en sistemas libres de células.
Bergmeyer y Bemt (Enzymol. biol clinic. 1965, 19:65-76) describen un método
para cuantificar LDH liberada por las células muertas midiendo la oxidación del p-NADH a P-NAD+ cuando la enzima LDH reduce el piruvato a lactato. La conversión del P-NADH a P-NAD+ se sigue por una disminución en la absorbancia a 340 nm. Dicha disminución es proporcional a la cantidad de LDH presente.
Moran y Schnellmann (J. Pharmacol. Toxicol. Methods 1996, 36 (l):41-44)
proponen una modificación del método de Bergmeyer y Bemt (1963). El método propuesto es no homogéneo (es decir, se aplica al sobrenadante libre de células) y mide el descenso que se produce en la fluorescencia del NADH al transformarse en NAD+. Este método es más sensible y más barato que el de Bergmeyer y Bemt (1965) puesto que usa menos
reactivos, especialmente NADH, ya que la fluorimetría es más sensible que la espectrofotometría.
Deutsch (1970, US Pat. 3,539,453) desarrollaron kits en estado anhidro para la determinación de LDH. El primer kit utiliza piruvato sódico como sustrato, la forma reducida del difosfopiridina nucleótido (DPNH) como coenzima y el manitol como estabilizante. El piruvato es transformado por la LDH en presencia de DPNH a lactato 5 produciendo DPN+. La producción de DPN+ se determina colorimétricamente a la longitud de onda de 340 nm.
Un segundo kit utiliza lactato de litio como sustrato, DPN+ como coenzima y manitol como estabilizador. En este caso el lactato es transformado a piruvato por la LDH reduciendo la DPN+ a DPNH. La producción de DPNH y, por tanto, la cantidad de LDH 10 presente en la muestra se determina colorimétricamente a 340 nm.
Basados en las técnicas anteriores, se pueden encontrar varios kits comerciales para determinar rotura o lisis celular. Así, Molecular Probes (Life Technologies Corp.) vende kits para viabilidad celular basados en Resazurin, MTT y XTT. Esta compañía también comercializa Vybrant y el Citotoxicity Assay Kit. Vybrant detecta la liberación de la 15 enzima citoplasmática glucosa-6-fosfato deshidrogenasa (G6PDH) por las células muertas y no viables. Este método detecta la enzima por medio de un proceso de dos fases que lleva a la reducción de resazurin a resorufín. Según las recomendaciones del fabricante (Flier n°. mp-23111), periodos de incubación superiores a 24 horas suponen una importante degradación de la G6PHD que imposibilita su medida. Ya que la vida media de la G6PDH 20 es de menos de dos horas a 37°C, el principio de medida no está indicado para determinar citotoxicidad en largos periodos de tiempo.
Promega Corporation (Madison, Wi) comercializa kits para viabilidad celular, citotoxicidad y proliferación celular bajo los nombres de «CellTiter 96», «Celltiter-Glo», «CytoTox 96» y «CellTiter-Blue». «CytoTox 96» es un ensayo colorimétrico para determinar la citotoxicidad de un compuesto. Este ensayo mide cuantitativamente la 5 liberación de LDH de células muertas usando la reducción enzimática de 2-(4-yodofenil)-3- (4-nitrofenil)-5-fenil-2H-tetrazolio (INT) y un marcador tipo MTS tetrazolio (US Pat. N° 5,185,450). Este ensayo consiste en un proceso (no homogéneo) en dos etapas en el que el NADH formado por la acción de la enzima LDH se...
Reivindicaciones:
1. Un método para la cuantifícación de la enzima LDH en disolución acuosa. El método comprende las siguientes etapas:
a) Preparación de la disolución conteniendo la enzima LDH,
b) la adición a la disolución de la etapa a) de una mezcla de reactivos que contiene:
un disolvente, un sustrato y un cofactor para la enzima LDH. Posteriormente,
c) precipitación de las partículas que pueda haber en suspensión y
d) medida de la disolución de la etapa b) para la producción de la forma reducida del cofactor causada por la acción de la enzima sobre el sustrato contenidos en la
mezcla de reactivos añadida en la etapa b).
2. El método de la reivindicación 1, en el que se añade una etapa de parada de la reacción mediante la adición de un reactivo despúes de la etapa c).
3. El método, según las reivindicaciones 1 y 2, en el que la forma reducida del cofactor puede ser diferenciada de la forma oxidada fluorimétricamente.
4. El método, según las reivindicaciones 1, 2 y 3, en el que en la etapa b) de la
reivindicación 1, el disolvente es una solución acuosa, el sustrato es lactato, el cofactor es NAD+ y en la etapa c) de la reivindicación 1, la producción de la forma reducida del cofactor es NADH producida por la enzima lactato deshidrogenasa (LDH) y cuantifícada por espectrofotometría de fluorescencia.
5. El método, según las reivindicaciones 1 a 4, donde en la etapa b) de la reivindicación 1, el disolvente es una disolución tamponada de pH entre 8 y 9.
6. El método, según las reivindicaciones 1 a 5, en el que la mezcla de reactivos de la etapa b) de la reivindicación 1 se emplean las siguientes concentraciones de lactato y NAD+:
desde 1,5 mM a 250 mM de lactato
desde 1,5 mM a 10 mM de NAD+
7. El método, según la reivindicaciones 1 a 6, en los que del disolvente de la etapa b) de la reivindicación 1 es una solución tampón de carbonato/bicarbonato con las siguientes concentraciones:
Desde 0,1 M a 0,1 mM
8. El método, según las reivindicaciones 2 a 7, donde si la hubiere la solución de parada es un jabón o detergente.
9. El método, según las reivindicaciones 2 a 7, donde si la hubiere la solución de parada es dodecil sulfato sódico (SDS).
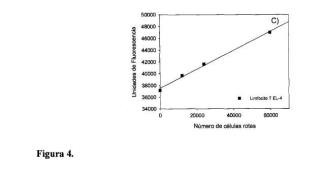
10. La aplicación de los métodos descritos en las reivindicaciones de 1 a 9 para la determinación de la rotura y/o muerte celular en cultivos de células procariotas o eucariotas, causada por un tóxico (por ejemplo, antibióticos, fármacos, aditivos del medio de cultivo, etc), condición ambiental (por ejemplo, pH, osmolaridad, etc) o por una perturbación física (por ejemplo, temperatura, irradiancia, nivel de agitación, etc). La determinación se realizará cuantificando la concentración de LDH (liberada al medio tras la rotura y/o muerte celular) de acuerdo a una curva patrón realizada midiendo, mediante
espectrofotometría, la fluorescencia del NADH producido por la enzima LDH en volúmenes con concentración conocida de células que son Usadas previamente.
Patentes similares o relacionadas:
Cultivo de tejido tridimensional heterogéneamente diferenciado, del 22 de Julio de 2020, de IMBA-INSTITUT FÜR MOLEKULARE BIOTECHNOLOGIE GMBH: Un cultivo de tejido neuronal tridimensional artificial cultivado in vitro que comprende una población heterogénea de células humanas o células de primate no humanas […]
Gangliósidos para estandarizar y aumentar la sensibilidad de las células a las neurotoxinas botulínicas en los sistemas de prueba in vitro, del 15 de Julio de 2020, de MERZ PHARMA GMBH & CO. KGAA: Un método para determinar la actividad biológica de un polipéptido de neurotoxina, que comprende las etapas de: a) cultivar neuronas de diferentes […]
Procedimiento para evaluación de la función hepática y el flujo sanguíneo portal, del 15 de Julio de 2020, de The Regents of the University of Colorado, a body corporate: Procedimiento in vitro para la estimación del flujo sanguíneo portal en un individuo a partir de una única muestra de sangre o suero, comprendiendo el procedimiento: […]
ANTICUERPO MONOCLONAL O UNA PORCIÓN DE UNIÓN A ANTÍGENO DEL MISMO QUE SE UNE A LA PROTEÍNA L DEL VIRUS PARAINFLUENZA HUMANO (PIV); MÉTODO Y KIT PARA DETECTAR AL VIRUS PIV, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína L del virus parainfluenza humano (PIV), donde dichos […]
ANTICUERPOS MONOCLONALES ESPECÍFICOS PARA EL ANTÍGENO PB2 DEL VIRUS DE LA INFLUENZA HUMANA (FLU), SECUENCIAS NUCLEOTÍDICAS; MÉTODO Y KIT DE DIAGNÓSTICO DE INFECCIÓN PRODUCIDA POR FLU, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína PB2 del virus de la influenza humana (Flu), […]
Reactivos SIRP-alfa de alta afinidad, del 24 de Junio de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un polipéptido SIRPα de alta afinidad que comprende al menos una y no más de 15 modificaciones de aminoácidos dentro del dominio d1 de una secuencia SIRPα de tipo […]
Diagnóstico y terapia de cáncer que implica células madre cancerosas, del 24 de Junio de 2020, de BioNTech SE: Un anticuerpo que tiene la capacidad de unirse a Claudina 6 (CLDN6) para usar en un método de tratamiento o prevención del cáncer que comprende inhibir y/o eliminar […]
Nueva inmunoterapia contra diversos tumores como el cáncer gastrointestinal y gástrico, del 24 de Junio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido seleccionado del grupo siguiente: a) péptido consistente en la secuencia conforme a la SEQ ID N.º 86, b) el péptido conforme a a), en la […]