Composiciones farmacéuticas que enmascaran el sabor.
Una composición farmacéutica para administración oral adecuada para la preparación de una suspensión acuosa lista para usar que comprende
a) partículas revestidas que comprenden al menos una sustancia farmacéuticamente activa que tiene un sabor desagradable y/o amargo y opcionalmente al menos un excipiente,
y
b) una base de suspensión que comprende al menos una sustancia osmóticamente activa que es capaz de proporcionar una alta osmolalidad a la mezcla de dicha base de suspensión con un medio de suspensión acuoso en la suspensión lista para usar, en donde la al menos una sustancia osmóticamente activa se selecciona del grupo que consiste en carbohidratos, compuestos relacionados con carbohidratos y sales inorgánicas, y
c) opcionalmente al menos un excipiente farmacéuticamente aceptable,
en donde dicha alta osmolalidad no es menor de 2.000 mosmol por kg del medio de suspensión acuoso.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/010890.
Solicitante: SANDOZ AG.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35 4056 BASEL SUIZA.
Inventor/es: SCHWARZ, FRANZ, XAVER, KOSILEK,IRINA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/7048 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo el oxígeno como heteroatomo de un ciclo, p. ej. Leucoglucosano, hesperidina, eritromicina, nistatina.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61K9/50 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Microcápsulas (A61K 9/52 tiene prioridad).
PDF original: ES-2514468_T3.pdf
Fragmento de la descripción:
Composiciones farmacéuticas que enmascaran el sabor Campo de la Invención La presente invención se refiere a una composición farmacéutica para administración oral como la definida en las reivindicaciones que comprende partículas revestidas que comprenden una sustancia activa que tiene un sabor desagradable y/o amargo cuando se administra oralmente. Más particularmente, la presente invención se refiere a una composición farmacéutica como la definida en las reivindicaciones que comprende partículas revestidas de sabor enmascarado que comprenden un antibiótico macrólido, preferiblemente claritromicina, que está en la forma de una suspensión que mantiene su palatabilidad a lo largo de un período de tiempo prolongado por medio de condiciones osmóticas definidas. Por otra parte, la presente invención se refiere a una procedimiento como el definido en las reivindicaciones para preparar dicha composición. La invención también se refiere a una suspensión lista para usar como la definida en las reivindicaciones y a un estuche de partes como el definido en las reivindicaciones.
Antecedentes de la invención La administración oral de sustancias farmacéuticamente activas en formas sólidas convencionales tales como comprimidos o cápsulas es a menudo problemática en grupos de pacientes especiales que tienen dificultades para tragar dichas formas sólidas enteras, por ejemplo niños y pacientes ancianos. Para estos pacientes, formas de dosificación adecuadas para fármacos pueden ser, p. ej. formas líquidas, p. ej. soluciones, suspensiones, jarabes o emulsiones, o formas sólidas alternativas tales como comprimidos masticables, comprimidos efervescentes o comprimidos solubles. Estas formas de dosificación habitualmente no impiden un grado perceptible de exposición de la sustancia activa a las papilas gustativas, que es un problema importante cuando la sustancia activa tiene un sabor desagradable y/o amargo. En tales casos, el sabor de la sustancia activa se tiene que enmascarar, de modo que la forma de dosificación se vuelva apetecible, reduciendo de ese modo el riesgo de que los pacientes rechacen la toma del medicamento.
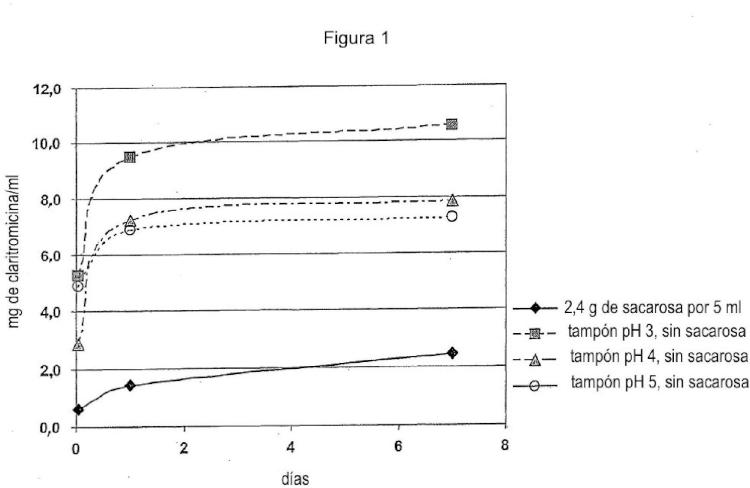
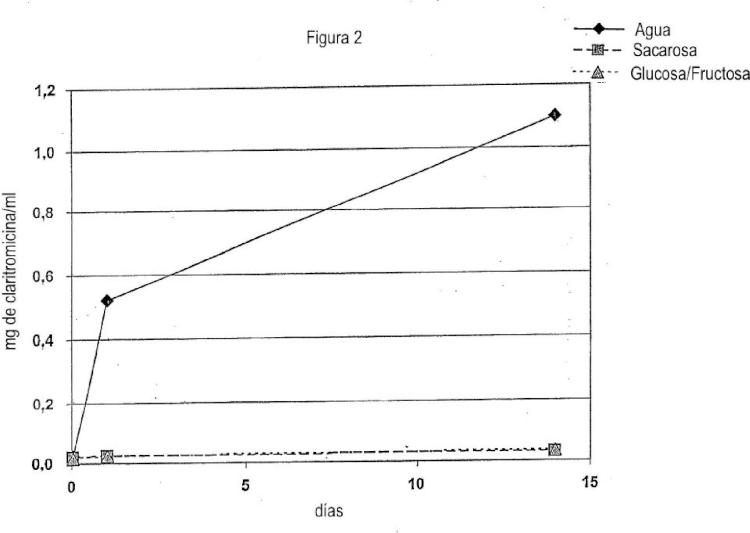
Es un gran reto enmascarar el sabor de sustancias activas de sabor extremadamente amargo tales como macrólidos, p. ej. eritromicina o claritromicina, especialmente cuando están comprendidas en suspensiones. Técnicas de enmascaramiento del sabor convencionales tales como la adición de edulcorantes tales como azúcar, edulcorantes artificiales, aromas de frutas, espesantes y aminoácidos a menudo no dan a la composición farmacéutica un sabor aceptable.
Principalmente, es la porción de la sustancia activa en tales formas de dosificación que se disuelve en la saliva y/o en el líquido para la administración la que genera el sabor desagradable. Para vencer este problema, es común influir en la solubilidad de dicha sustancia activa de tal modo que solo una pequeña porción de dicha sustancia, o incluso nada de ella, se disuelva en una suspensión, o en la boca. Esto se consigue a menudo embebiendo la sustancia activa de sabor amargo en un material de imbibición especial o revistiendo dichos fármacos. Sin embargo, estas técnicas tienen sus limitaciones y habitualmente resultan eficaces solo para fármacos moderadamente amargos. Las técnicas de imbibición y/o revestimiento también pueden afectar adversamente a la liberación deseada de la sustancia activa en el tracto digestivo para conseguir una buena biodisponibilidad.
Para asegurar una biodisponibilidad suficiente de la sustancia activa, se pueden usar revestimientos, p. ej. revestimientos de lípido y/o cera que retardan la disolución de la sustancia activa durante un corto período de tiempo, o películas poliméricas ligeramente retardantes o similares. Sin embargo, estos revestimientos solo pueden proporcionar un enmascaramiento del sabor satisfactorio si dichas suspensiones se administran poco después de su reconstitución, es decir después de la dispersión en un medio acuoso.
La Solicitud Internacional WO 93/12771 divulga otra técnica para enmascarar el sabor revistiendo partículas nucleares que comprenden, p. ej., claritromicina con una capa de revestimiento polimérico que comprende una fracción de prolamina derivada de proteínas de cereales, preferiblemente zeína, y plastificantes que son preferiblemente ácidos grasos, en donde dicho revestimiento es relativamente grueso.
Otra técnica se describe en la Solicitud Internacional WO 00/76479 A1, en la que la sustancia activa de sabor amargo se embebe en una matriz de enmascaramiento del sabor compuesta por una combinación de dos polímeros entéricos, a saber un copolímero de ácido metacrílico y un polímero de ftalato, que opcionalmente está revestido.
WO9603976 (A1) divulga un sistema de aporte farmacéutico líquido sustancialmente insípido que comprende: a) un material activo; y b) un sistema acuoso de alta osmolaridad que comprende: (i) agua; (ii) de aproximadamente 20% a aproximadamente 45% en peso de derivado sacárico; (iii) de aproximadamente 10% a aproximadamente 15% en peso de jarabe de maltosa hidrogenado; y (iv) de aproximadamente 0% a aproximadamente 35% en peso de alcohol
polihidroxilado.
WO02092106 (A1) divulga una composición adecuada para administración oral que comprende un macrólido y un policarbófilo. En particular, el macrólido se selecciona del grupo que comprende eritromicina A, eritromicina B, eritromicina C, eritromicina D, claritromicina, diritromicina, josamicina, midecamicina, kitasamicina, tilosina, roxitromicina, rokitamicina, oleandomicina, miocamicina, fluritromicina, rosarmicina, espiramicina y azitromicina.
La mayoría de las técnicas de enmascaramiento del sabor convencionales no proporcionan un enmascaramiento del sabor satisfactorio en una suspensión que se requiere que mantenga su sabor agradable a lo largo de un período de tiempo largo, p. ej. durante al menos de 1 a 2 semanas como una suspensión reconstituida. En tales casos, se usan comúnmente revestimientos peliculares con una solubilidad relacionada con el pH. Esto significa que el valor del pH en la suspensión se ajusta hasta un valor al que no sea soluble el componente peliculígeno, p. ej. el polímero peliculígeno, comprendido en el revestimiento pelicular. El valor del pH cambia durante la administración, y dependiendo del material de revestimiento usado, la sustancia activa se liberará bien en el estómago en el caso de que el revestimiento sea soluble en ácido, o bien en los intestinos, p. ej. el intestino delgado, en el caso de revestimientos entéricos o gastrorresistentes solubles en base.
La Solicitud Internacional WO 91/16043 divulga la aplicación a una partícula nuclear de un revestimiento polimérico que es soluble sólo a un pH de 5 o más, y la adición de un compuesto ácido a la formulación para reducir o evitar la disolución de la membrana de revestimiento en la cavidad oral.
Sin embargo, el dimensionamiento de dichos revestimientos peliculares es crítico: los revestimientos peliculares que son demasiado resistentes y/o gruesos pueden retardar la velocidad de la liberación de fármaco en el tracto gastrointestinal hasta un punto que sería inaceptable para formulaciones de liberación inmediata convencionales.
Otro problema es que los revestimientos peliculares mencionados anteriormente, p. ej. revestimientos poliméricos, nunca son totalmente "a prueba de fugas", lo que significa que incluso con revestimientos peliculares intactos, una porción de la sustancia activa siempre se libera de las partículas revestidas por medio de difusión hacia la suspensión, lo que en la presente memoria se denomina "fuga". Esto puede conducir a la sensación de un sabor amargo después de la ingestión.
Generalmente, el valor del pH del componente líquido de composiciones farmacéuticas tales como suspensiones se ajusta hasta un valor que asegurará que el revestimiento no se disuelva y/o corroa. Sin embargo, si la sustancia activa de sabor enmascarado posee una buena solubilidad en este intervalo de pH, esto, a su vez, incrementará la difusión de la sustancia activa de sabor desagradable y de ese modo provocar la fuga a la suspensión y/o la boca después de la administración oral.
Adicionalmente, las técnicas convencionales para preparar una forma de dosificación líquida apetecible que comprende un fármaco de sabor desagradable y/o amargo pueden implicar métodos preparativos costosos y complicados.
Según esto, un objetivo de la presente invención es proporcionar una forma de dosificación líquida, que es una suspensión acuosa, que comprende partículas revestidas que contienen una sustancia farmacéuticamente activa de sabor desagradable y/o amargo, que sea apetecible y que mantenga... [Seguir leyendo]
Reivindicaciones:
1. Una composición farmacéutica para administración oral adecuada para la preparación de una suspensión acuosa lista para usar que comprende a) partículas revestidas que comprenden al menos una sustancia farmacéuticamente activa que tiene un sabor desagradable y/o amargo y opcionalmente al menos un excipiente, y b) una base de suspensión que comprende al menos una sustancia osmóticamente activa que es capaz de proporcionar una alta osmolalidad a la mezcla de dicha base de suspensión con un medio de suspensión acuoso en la suspensión lista para usar, en donde la al menos una sustancia osmóticamente activa se selecciona del grupo que consiste en carbohidratos, compuestos relacionados con carbohidratos y sales inorgánicas, y c) opcionalmente al menos un excipiente farmacéuticamente aceptable, en donde dicha alta osmolalidad no es menor de 2.000 mosmol por kg del medio de suspensión acuoso.
2. La composición farmacéutica según la reivindicación 1, en la que las partículas revestidas tienen sabor enmascarado.
3. La composición farmacéutica según la reivindicación 1 o 2, en la que dicha alta osmolalidad no es menor de 2.500 mosmol por kg de medio de suspensión.
4. La composición farmacéutica según cualquiera de las reivindicaciones 1 a 3, en la forma de un polvo seco.
5. Una composición farmacéutica en la forma de una suspensión lista para usar que se prepara suspendiendo la composición farmacéutica según cualquiera de las reivindicaciones 1 a 4 en un medio de suspensión acuoso.
6. La composición farmacéutica según cualquiera de las reivindicaciones 1 a 5, en la que el medio de suspensión acuoso es agua.
7. La composición farmacéutica según cualquier reivindicación precedente, en la que la sustancia osmóticamente activa se selecciona del grupo que consiste en sacarosa, sorbitol, xilitol, eritritol, maltodextrina, ciclodextrina, fosfato potásico, fosfato sódico, sulfato sódico y cloruro sódico, y mezclas de los mismos.
8. La composición farmacéutica según cualquier reivindicación precedente, en la que la cantidad de la sustancia osmóticamente activa es de aproximadamente 6% a aproximadamente 100% p/p con relación al medio de suspensión.
9. La composición farmacéutica según la reivindicación 8, en la que la cantidad de la sustancia osmóticamente activa es de aproximadamente 85% a aproximadamente 95% p/p con relación al medio de suspensión.
10. La composición farmacéutica según la reivindicación 9, en la que la cantidad de la sustancia osmóticamente activa es aproximadamente 89% p/p con relación al medio de suspensión.
11. La composición farmacéutica según cualquiera de las reivindicaciones 6 a 10, en la que el medio de suspensión acuoso es agua y en la que la osmolalidad de la mezcla de la base de suspensión con agua no es menor de 2.000 mosmol por litro.
12. La composición farmacéutica según la reivindicación 11, en la que la osmolalidad de la mezcla de la base de suspensión con agua no es menor de 2.500 mosmol por litro.
13. La composición farmacéutica según cualquiera de las reivindicaciones precedentes, en la que el revestimiento de dichas partículas revestidas es un revestimiento funcional.
14. La composición farmacéutica según la reivindicación 13, en la que dicho revestimiento funcional es un revestimiento entérico.
15. La composición farmacéutica según cualquier reivindicación precedente, en la que dicha suspensión lista para usar es apetecible.
16. La composición farmacéutica según la reivindicación 15, en la que la suspensión lista para usar mantiene su
palatabilidad a lo largo de al menos 2 semanas.
17. La composición farmacéutica según cualquiera de las reivindicaciones precedentes, en la que la sustancia farmacéuticamente activa que tiene un sabor desagradable y/o amargo es un antibiótico macrólido.
18. La composición farmacéutica según la reivindicación 17, en la que el antibiótico macrólido es claritromicina.
19. La composición farmacéutica según cualquier reivindicación precedente, que está esencialmente libre de un aditivo ácido y/o básico.
20. Un método para preparar una composición farmacéutica según cualquiera de las reivindicaciones 1 a 4, que comprende las etapas de
a) mezclar dichas partículas revestidas con dicha base de suspensión que comprende al menos una sustancia osmóticamente activa seleccionada del grupo que consiste en sacarosa, sorbitol, xilitol, eritritol, maltodextrina, ciclodextrina, fosfato potásico, fosfato sódico, sulfato sódico y cloruro sódico, y mezclas de los mismos, y opcionalmente al menos un excipiente farmacéuticamente aceptable, para obtener una mezcla seca para suspensión, en donde la cantidad de sustancia osmóticamente activa es suficiente para proporcionar una alta osmolalidad a la mezcla de dicha base de suspensión con un medio de suspensión acuoso en la suspensión lista para usar, y b) opcionalmente cargar la mezcla para suspensión obtenida en la etapa a) en un recipiente.
21. Un método para preparar una composición farmacéutica según cualquiera de las reivindicaciones 1 a 5, que comprende las etapas de a) mezclar dichas partículas revestidas con dicha base de suspensión que comprende al menos una sustancia osmóticamente activa seleccionada del grupo que consiste en sacarosa, sorbitol, xilitol, eritritol, maltodextrina, ciclodextrina, fosfato potásico, fosfato sódico, sulfato sódico y cloruro sódico, y mezclas de los mismos, y opcionalmente al menos un excipiente farmacéuticamente aceptable, para obtener una mezcla seca para suspensión, en donde la cantidad de sustancia osmóticamente activa es suficiente para proporcionar una alta osmolalidad a la mezcla de dicha base de suspensión con un medio de suspensión acuoso en la suspensión lista para usar, y b) añadir agua a la mezcla seca para suspensión obtenida en la etapa a) para formar una suspensión lista para usar, y c) opcionalmente cargar la suspensión lista para usar en un recipiente.
22. Un método según las reivindicaciones 20 o 21, en el que la sustancia farmacéuticamente activa es claritromicina.
23. Una composición farmacéutica según cualquiera de las reivindicaciones 1 a 19, para el uso como un medicamento.
24. Una composición farmacéutica según cualquiera de las reivindicaciones 1 a 19, para el uso en la preparación de un medicamento para el tratamiento y/o la profilaxis de enfermedades infecciosas.
25. Una composición farmacéutica según cualquiera de las reivindicaciones 1 a 19, para el uso en un método para el tratamiento y/o la profilaxis de enfermedades infecciosas, que comprende administrar dicha composición farmacéutica a un mamífero humano o no humano que lo necesite.
26. La composición farmacéutica para el uso según la reivindicación 25, en la que dicho mamífero humano es un niño o un paciente anciano.
27. Un estuche de partes que comprende el componente a) y el componente b) y opcionalmente el componente c) según la reivindicación 1, para la administración separada, secuencial o simultánea.
Patentes similares o relacionadas:
Potenciador de la conservación, del 29 de Julio de 2020, de DSM IP ASSETS B.V.: Una composición tópica que comprende fitantriol y eritrulosa.
 Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Administración intravascular de composiciones de nanopartículas y usos de las mismas, del 29 de Julio de 2020, de ABRAXIS BIOSCIENCE, LLC: Una composición que comprende nanopartículas que comprenden rapamicina y albúmina para su uso en un procedimiento para inhibir la remodelación […]
 Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Matrices de microagujas obtenidas mediante disolución y colada que contienen un principio activo, del 29 de Julio de 2020, de Corium, Inc: Un método para formar una matriz de microprotusiones, que comprende: (a) dispensar en un molde que tiene una matriz de cavidades correspondientes al negativo […]
Reducción de tejido adiposo, del 22 de Julio de 2020, de Dobak, John, Daniel: Una formulacion farmaceutica inyectable que comprende: (i) polidocanol en una cantidad del 0,5 % p/v al 2,0 % p/v; e (ii) un alcohol C3-C6 en una cantidad del […]