Biomasa enriquecida en cinc, método para la preparación de la misma y productos probióticos, cosméticos, dietéticos y nutracéuticos que comprenden la misma.
Método de preparación de una biomasa enriquecida en cinc, caracterizado porque dicha biomasa se obtiene
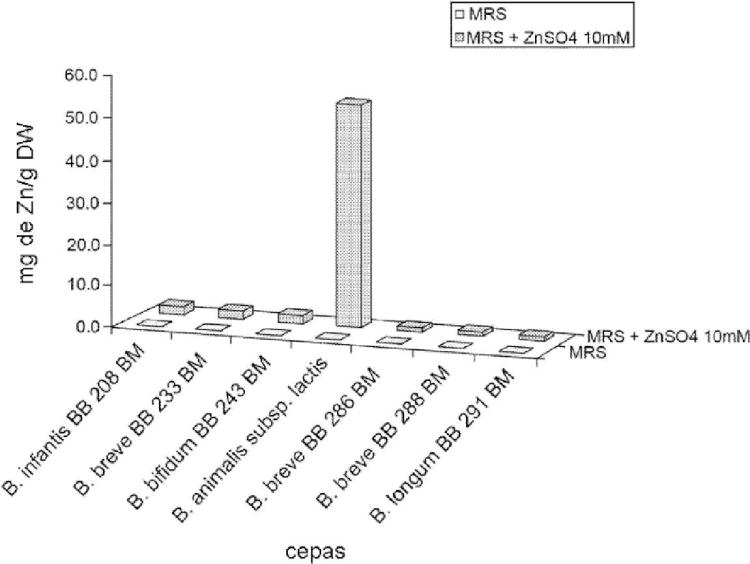
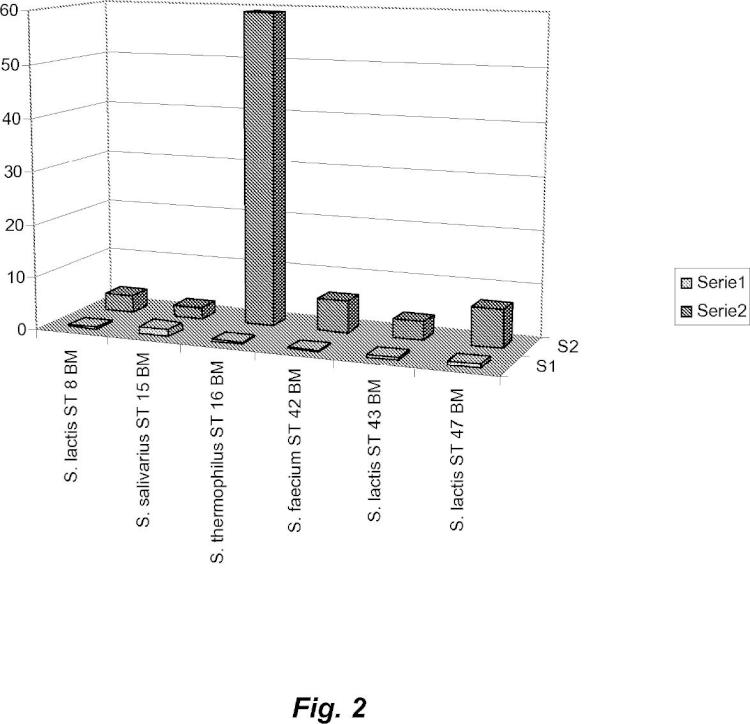
i) cultivando microorganismos seleccionados del grupo que consiste en Streptococcus thermophilus ST 16 BM,
depositado según el Tratado de Budapest en la DSMZ, Braunschweig, Alemania, con el número de registro DSM 19526 el 13 de julio de 2007, y Bifidobacterium animalis subsp. lactis BB 1 BM, depositado según el Tratado de Budapest en la DSMZ, Braunschweig, Alemania, con el número de registro DSM 17850 el 23 de diciembre de 2005, y combinaciones de los mismos, en un medio de cultivo nutriente que comprende una sal de cinc, de modo que dichos microorganismos acumulan cinc; y
ii) separando los microorganismos enriquecidos en cinc del medio de cultivo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2008/052943.
Solicitante: BIOMAN S.R.L.
Nacionalidad solicitante: Italia.
Dirección: Via Alfieri 18 10121 Torino ITALIA.
Inventor/es: BENEDETTI, ALBERTO, GIRARDO,FRANCESCO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A23L1/30
- A23L1/304
- A61K35/744 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Bacterias del ácido láctico, p. ej. Enterococci, Pediococci, Lactococci, Streptococci o Leuconostocs.
- A61K35/747 A61K 35/00 […] › Lactobacilos, p. ej. L. acidophilus o L. brevis.
- C12N1/20 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › Bacterias; Sus medios de cultivo.
- C12R1/01 C12 […] › C12R SISTEMA DE INDEXACION ASOCIADO A LAS SUBCLASES C12C - C12Q, RELATIVO A LOS MICROORGANISMOS. › C12R 1/00 Microorganismos. › Bacterias o actinomicetos.
- C12R1/46 C12R 1/00 […] › Streptococcus.
PDF original: ES-2553583_T3.pdf
Patentes similares o relacionadas:
Método para producir carne capaz de reducir el consumo de ácidos grasos saturados, del 22 de Julio de 2020, de Biobalance Co., Ltd: Lactobacillus plantarum BB-PLT (NITE BP-02097).
Composición adecuada para proteger microorganismos, del 15 de Julio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Una composición que comprende un material soporte formado por un polisacárido, al menos un antioxidante y una combinación de aminoácidos seleccionados entre cisteína y […]
Consorcio de microorganismos y su uso para reducir la demanda química de oxígeno del fluido consumido para trabajar metales, del 15 de Julio de 2020, de FORD MOTOR COMPANY LIMITED: Un consorcio de microorganismos que comprende, consiste o consiste esencialmente en Rhizobium radiobacter NCIMB 42280, Bacillus subtilis NCIMB […]
PROCEDIMIENTO DE OBTENCIÓN DE SUBPRODUCTOS A PARTIR DE RESIDUOS DE CAFÉ Y APLICACIONES DE LOS MISMOS, del 13 de Julio de 2020, de UNIVERSIDAD DE GRANADA: Procedimiento de obtención de subproductos a partir de residuos de café y aplicaciones de los mismos. La presente invención consiste en un proceso […]
UNA FORMULACIÓN PARA LA PROTECCIÓN CONTRA LA BACTERIOSIS DEL KIWI, CAUSADA POR LA BACTERIA PSEUDOMONAS SYRINGAE PV. ACTINIDIAE (PSA), del 9 de Julio de 2020, de UNIVERSIDAD DE CONCEPCION: La tecnología corresponde a una formulación para la protección contra la bacteriosis del kiwi, causada por la bacteria Pseudomonas syringae […]
Novedosa cepa de Gluconacetobacter diazotrophicus (Gd) y uso de la misma en agricultura, del 8 de Julio de 2020, de Azotic Technologies Ltd: Una cepa fijadora de nitrógeno de Gluconacetobacter diazotrophicus (Gd) depositada por CABI en el Reino Unido con el número de acceso del depósito IMI 504958.
Selección y uso de cepas de bacilos tolerantes al frío como fitoestimuladores biológicos, del 8 de Julio de 2020, de Abitep GmbH: Composición para estimular el crecimiento de plantas de cultivo, caracterizada por el hecho de que contiene la cepa tolerante al frío Bacillus atrophaeus ABI02A […]
PROCEDIMIENTO PARA REDUCIR EL CONTENIDO DE HISTAMINA EN VINOS, del 7 de Julio de 2020, de PAGO DE CARRAOVEJAS, S.L: Procedimiento para reducir el contenido de histamina en vinos. La invención consiste en un proceso a través del cual, seleccionando una serie de poblaciones de bacterias […]