APARATO DE PATOLOGÍA MOLECULAR AUTOMATIZADO QUE TIENE CALEFACTORES DE PORTAOBJETOS INDEPENDIENTES.
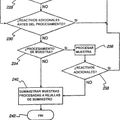
Un procedimiento para tratar automáticamente muestras de tejido montadas en una pluralidad de portaobjetos (37) en un tambor giratorio (34) montado en una plataforma de instrumento fija que comprende las etapas de:
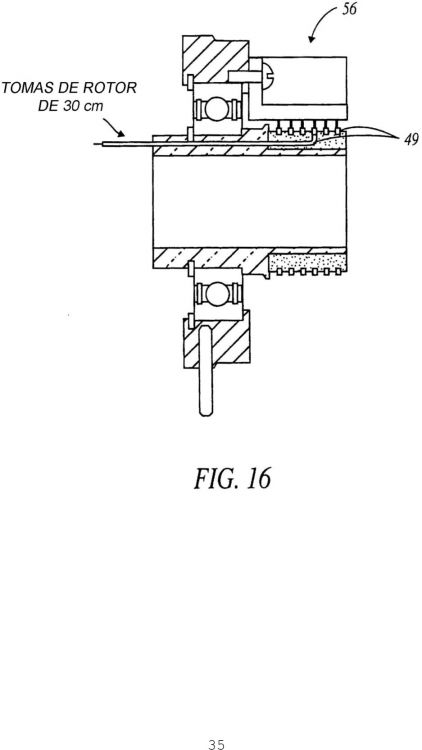
proporcionar una pluralidad de plataformas térmicas separadas (50) montadas en el tambor (34), comprendiendo cada plataforma térmica (50) un calefactor (64) para calentar cada uno de dicha pluralidad de portaobjetos (37) y un sensor para detectar la temperatura de cada portaobjetos, en el que la temperatura de cada portaobjetos (37) puede estar controlada independientemente; controlar el calor de cada uno de la pluralidad de calefactores (64) con electrónica de control (52) montada en el tambor (34) que vigila y controla individualmente cada plataforma térmica (50) por separado; y tratar dichas muestras de tejido, en el que dicho tratamiento comprende el calentamiento de al menos un portaobjetos (37) con uno de dichos calefactores (64), y en el que la información y la potencia pasan entre el tambor giratorio y la plataforma de instrumento fija a través de una estructura de anillo colector (56)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US1999/004181.
Solicitante: VENTANA MEDICAL SYSTEMS, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1910 E. INNOVATION PARK DRIVE TUCSON, ARIZONA 85755 ESTADOS UNIDOS DE AMERICA.
Inventor/es: RICHARDS,William , LEMME,Charles,D. , CHRISTENSEN,Kimberly , MACREA,Ethel,R.
Fecha de Publicación: .
Fecha Solicitud PCT: 26 de Febrero de 1999.
Clasificación Internacional de Patentes:
- G01N1/31B
- G01N35/10A
Clasificación PCT:
- G01N1/30 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 1/00 Muestreo; Preparación de muestras para la investigación (manipulación de materiales para un análisis automático G01N 35/00). › Tintura; Impregnación.
Clasificación antigua:
- G01N1/30 G01N 1/00 […] › Tintura; Impregnación.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia, Chipre.
Fragmento de la descripción:
SOLICITUD DE REFERENCIA CRUZADA
Esta es una continuación en parte de la solicitud de EE.UU. nº serie 60/076.198 presentada el 27 de febrero de 1998.
CAMPO DE LA INVENCIÓN 5
La presente invención se dirige a un aparato para su uso en patología molecular de diagnóstico y, más en particular, a dicho aparato usado para la tinción y/o el tratamiento automatizado de muestras de tejido montadas en portaobjetos de microscopio.
ANTECEDENTES DE LA INVENCIÓN
La patología molecular es el examen a un nivel molecular del ADN, el ARNm y las proteínas que 10 causan enfermedades o que están relacionadas de otra forma con enfermedades. A partir de este examen puede obtenerse información importante sobre el diagnóstico, el pronóstico y las opciones de tratamiento del paciente. La práctica de la patología molecular se divide generalmente en dos áreas principales: (i) análisis de ADN, ARNm y proteínas en células intactas (in situ), y (ii) análisis de estos materiales biológicos después de que han sido extraídos de los tejidos. La primera categoría, a la que se dirige principalmente la presente invención, tiene la ventaja de que permite 15 al patólogo o científico estudiar la arquitectura o morfología histopatológica de la muestra de tejido al microscopio al mismo tiempo que se somete a ensayo el ácido nucleico o las proteínas. Entre estas técnicas se incluyen la inmunohistoquímica (IHQ) que estudia las proteínas, la hibridación in situ (HIS) que estudia los ácidos nucleicos, la histoquímica (HQ) que estudia los hidratos de carbono, y la enzimohistoquímica (EHQ) que estudia la química de las enzimas. Por ejemplo, puede usarse la HIS para estudiar la presencia de una anomalía o trastorno genético como la 20 amplificación de cáncer que provoca genes específicamente en células que, cuando se miran al microscopio, parecen morfológicamente malignas. La HIS también es útil en el diagnóstico de enfermedades infecciosas ya que permite la detección no sólo de una secuencia microbiana sino también indicar exactamente qué células están infectadas. Esto puede tener importantes implicaciones clinicopatológicas y es un medio eficaz para descartar la posibilidad de que la señal de hibridación positiva pueda proceder de un tejido adyacente sin interés clínico o por contaminación sanguínea o 25 externa.
La IHQ usa anticuerpos que se unen específicamente con epítopos únicos presentes sólo en ciertos tipos de tejido celular enfermo. La IHQ necesita una serie de etapas de tratamiento realizadas en una sección de tejido o células (por ejemplo, sangre o médula ósea) montada en un portaobjetos de vidrio para resaltar mediante tinción selectiva ciertos indicadores morfológicos de estados de enfermedad. Entre las etapas típicas se incluyen 30 pretratamiento de la sección del tejido para eliminar la parafina y reducir la unión inespecífica, recuperación de antígenos enmascarados por reticulación de las proteínas a partir de los fijadores químicos, tratamiento e incubación de anticuerpos, tratamiento e incubación de anticuerpos secundarios marcados con enzimas, reacción del sustrato con la enzima para producir un fluoróforo o cromatóforo para resaltar áreas de la sección del tejido que tienen epítopos que se unen con el anticuerpo, contratinción, y similares. La mayoría de estas etapas están separadas por múltiples etapas de 35 aclarado para eliminar el reactivo residual sin reaccionar de la etapa anterior. Las incubaciones pueden realizarse a temperaturas elevadas, normalmente de 37°C aproximadamente, y el tejido debe protegerse continuamente de la deshidratación. El análisis por HIS, que se basa en la afinidad de unión específica de las sondas con secuencias de nucleótidos únicas o repetitivas de las células de muestras de tejido o fluidos corporales, necesita una serie similar de etapas de procesamiento con numerosos reactivos diferentes y se complica adicionalmente con diversos requisitos de 40 temperatura.
En vista del gran número de etapas de tratamiento repetitivas necesarias para IHQ e HIS, se han introducido sistemas automatizados para reducir el trabajo humano y los costes y la tasa de errores asociados con las mismas, y para introducir uniformidad. Entre los ejemplos de sistemas automatizados que se han empleado con éxito se incluyen los sistemas de tinción NEXES® y Gen II® disponibles en Ventana Medical Systems (Tucson, Arizona) así 45 como el sistema desvelado en la patente de EE.UU. nº 5.654.199 para Copeland y col. Estos sistemas emplean un sistema controlado por microprocesador que incluye un tambor de revolución que sostiene portaobjetos dispuestos radialmente. Un motor paso a paso hace girar el tambor colocando cada portaobjetos debajo de uno de una serie de dispensadores de reactivo situados encima del portaobjetos. Los códigos de barras del portaobjetos y los dispensadores de reactivo permiten que el ordenador controle la posición de los dispensadores y los portaobjetos de manera que 50 puedan realizarse diferentes tratamientos de reactivos para cada una de las diversas muestras de tejido mediante la
programación apropiada del ordenador.
Los sistemas de tinción mencionados anteriormente incluyen un ventilador de aire caliente o una lámpara de calor para calentar las muestras por encima de las temperaturas ambiente de laboratorio para etapas que requieren temperaturas elevadas. El calentamiento del portaobjetos mejora la calidad de tinción al acelerar la reacción química y puede permitir una temperatura de reacción que se equipare más cercanamente con la temperatura corporal 5 (37°C aproximadamente) para la que está diseñada la reacción de los anticuerpos. Aunque dichos sistemas de calentamiento radiantes o por convección han sido adecuados generalmente para IHQ, que se basa en anticuerpos, son menos adecuados para HIS, que se basa en ácidos nucleicos y requiere un control de temperatura superior y más preciso. Con el fin de desnaturalizar la doble hélice del ADN de la muestra diana y de la sonda de manera que se convierta en monocatenaria, la temperatura debe elevarse por encima del punto de fusión del dúplex, normalmente 10 74°C aproximadamente. Al mismo tiempo es imperativo que la muestra no se caliente en exceso por encima de 100°C ya que al hacerlo se destruye la morfología celular, y se hace difícil de ver al microscopio. También se requiere un control preciso de la temperatura en HIS para realizar hibridación de sondas con el carácter restrictivo deseado. La temperatura seleccionada debe ser suficientemente baja para permitir la hibridación entre sonda y plantilla, pero suficientemente elevada para evitar que se formen híbridos mal emparejados. Sería deseable, por tanto, tener un 15 aparato de tinción de tejidos automático que pueda controlar la temperatura de las reacciones con suficiente precisión para la mayoría de las aplicaciones de HIS.
Otra desventaja de las unidades de calentamiento empleadas normalmente con dispositivos de tinción de tejidos automatizados es que no permiten que la temperatura de portaobjetos individuales se controle por separado. Con los sistemas de la técnica anterior, todos los portaobjetos se calientan a la misma temperatura en un momento 20 dado durante el procedimiento. Por ejemplo, la patente de EE.UU. nº 5.645.114 para Bogen y col. desvela una estructura de dispensación adaptada para llevar una pluralidad de portaobjetos de microscopio. Se proporcionan recipientes de los portaobjetos individuales que contienen unidades de calentamiento por resistores. Sin embargo, con la estructura enseñada por Bogen y col., todos los portaobjetos se calentarían a una temperatura común ya que, por ejemplo, no se desvelan medios para separar los controles de calentamiento o para proteger los portaobjetos del calor 25 generado por portaobjetos adyacentes. Esto impide que se apliquen protocolos que tengan diferentes parámetros de temperatura en muestras diferentes al mismo tiempo. Por ejemplo, ensayos de sondas de ADN que tuvieran diferentes requisitos de restrictividad no podrían ejecutarse con eficacia al mismo tiempo. Sería deseable, por tanto, tener un aparato de tinción de tejidos automático en el que pudieran aplicarse sobre portaobjetos adyacentes diferentes pruebas aun cuando las pruebas tuvieran requisitos de calentamiento especiales. 30
Una dificultad que se encuentra frecuentemente en pruebas de IHQ e HIS procede del modo en que se conservan normalmente los tejidos. El pilar del laboratorio de patología de diagnóstico ha sido durante muchas décadas el bloque...
Reivindicaciones:
1. Un procedimiento para tratar automáticamente muestras de tejido montadas en una pluralidad de portaobjetos (37) en un tambor giratorio (34) montado en una plataforma de instrumento fija que comprende las etapas de:
proporcionar una pluralidad de plataformas térmicas separadas (50) montadas en el tambor (34), comprendiendo 5 cada plataforma térmica (50) un calefactor (64) para calentar cada uno de dicha pluralidad de portaobjetos (37) y un sensor para detectar la temperatura de cada portaobjetos, en el que la temperatura de cada portaobjetos (37) puede estar controlada independientemente;
controlar el calor de cada uno de la pluralidad de calefactores (64) con electrónica de control (52) montada en el tambor (34) que vigila y controla individualmente cada plataforma térmica (50) por separado; y 10
tratar dichas muestras de tejido, en el que dicho tratamiento comprende el calentamiento de al menos un portaobjetos (37) con uno de dichos calefactores (64),
y en el que la información y la potencia pasan entre el tambor giratorio y la plataforma de instrumento fija a través de una estructura de anillo colector (56).
2. El procedimiento de la reivindicación 1 en el que dicha etapa de tratamiento comprende además la 15 aplicación de un tinte detectable seleccionado entre el grupo que consiste en una sonda de ácido nucleico, un cebador de ácido nucleico, un anticuerpo y un colorante.
3. El procedimiento de la reivindicación 1 en el que dicha etapa de tratamiento comprende además un proceso automatizado seleccionado entre el grupo que consiste en lavado, aclarado, secado, cubrimiento, mezclado, incubación y enfriamiento. 20
4. El procedimiento de la reivindicación 1 en el que al menos uno de dichos calefactores (64) es capaz de calentar un portaobjetos (37) a una temperatura de hasta 94° aproximadamente.
5. El procedimiento de la reivindicación 1 en el que dicha muestra de tejido se selecciona entre el grupo que consiste en una sección de tumor, una sección de órgano, una sección congelada, un fluido corporal, un frotis, una preparación de citología y una línea celular. 25
6. El procedimiento de la reivindicación 1 en el que dicha etapa de tratamiento comprende además la etapa de aplicar un fluido para eliminar la parafina.
7. El procedimiento de la reivindicación 1, procedimiento que es para tratar simultáneamente dos o más muestras de tejido montadas en portaobjetos sostenidas en el tambor giratorio (34), en el que la temperatura de cada calefactor (64) es controlada independientemente por un ordenador (55) mediante: 30
(i) programación de dicho ordenador (55) con los parámetros de temperatura de dicho tratamiento;
(ii) selección a partir del ordenador (55) de dos o más tratamientos para realizar; y
(iii) realización simultáneamente de dichos tratamientos.
8. El procedimiento de la reivindicación 7 en el que dicho tratamiento es seleccionado entre el grupo que consiste en desnaturalización de ADN, renaturalización de ADN, hibridación de sonda y lavado posthibridación. 35
9. El procedimiento de la reivindicación 1 en el que se aplica una corriente de fluido a las muestras de tejido montadas en el portaobjetos calentado (37) para eliminar los medios incluidos de las muestras de tejido.
10. Aparato para calentar automáticamente materiales biológicos que experimentan un tratamiento, comprendiendo dicho aparato:
una plataforma de instrumento fija (30, 32); 40
un tambor giratorio (34) montado en la plataforma de instrumento fija (30, 32) que incluye una pluralidad de lugares para sostener una pluralidad de portaobjetos (37) que incluyen dichos materiales biológicos;
plataformas térmicas separadas (50) montadas en el tambor (34), comprendiendo cada plataforma térmica un
calefactor (64) para cada uno de dicha pluralidad de portaobjetos (37) y un sensor de temperatura (68) para detectar la temperatura de cada portaobjetos,
y electrónica de control (52) montada en el tambor (34) que vigila y controla individualmente cada plataforma térmica (50) por separado para controlar la temperatura de dichos materiales biológicos,
en el que la información y la potencia pasan entre el tambor giratorio y la plataforma de instrumento fija a 5 través de una estructura de anillo colector (56).
11. El aparato de la reivindicación 10 en el que cada uno de dichos calefactores (64) está aislado térmicamente de la transferencia de calor de los calefactores adyacentes.
12. El aparato de la reivindicación 11 en el que los calefactores (64) están montados en el tambor a través de plataformas (70). 10
13. El aparato de la reivindicación 10 que comprende además un procesador en comunicación con los sensores de temperatura (68); y
medios para modificar individualmente la producción de calor de los calefactores (64) para cada uno de la pluralidad de portaobjetos (37), estando los medios de modificación en comunicación con el procesador.
14. Un aparato de la reivindicación 13 que es un sistema de calentamiento de portaobjetos de microscopio en el 15 que los medios para modificar el calor incluyen medios para modificar ciclos de trabajo de los calefactores (64).
15. Un procedimiento para realizar automáticamente PCR in situ para amplificar un ácido nucleico diana en células montadas en al menos un portaobjetos de microscopio (37) que comprende las etapas de:
(a) proporcionar el aparato de la reivindicación 10;
(b) aplicar un conjunto de reactivos de PCR para dichas células; 20
(c) usar dichos calefactores (64) para someter dichas células a ciclos térmicos suficientes para amplificar dicho ácido nucleico diana; y
(d) detectar dicho ácido nucleico diana amplificado.
Patentes similares o relacionadas:
RECIPIENTE PARA REACTIVOS, REACCIÓN EN PORTAOBJETOS, BANDEJA DE RETENCIÓN Y MÉTODO DE FUNCIONAMIENTO, del 13 de Diciembre de 2011, de SAKURA FINETEK U.S.A., INC.: Una bandeja de retención de muestra que define una superficie inferior y que comprende paredes internas : una parte de soporte […]
 EQUIPO PARA MODIFICAR LA PRESION EN EL INTERIOR DE UN DISPENSADOR DE FLUIDO, del 30 de Septiembre de 2010, de VENTANA MEDICAL SYSTEMS, INC.: Un dispensador de fluido que comprende:
un cuerpo cilíndrico que tiene una cámara del depósito que incluye una porción […]
EQUIPO PARA MODIFICAR LA PRESION EN EL INTERIOR DE UN DISPENSADOR DE FLUIDO, del 30 de Septiembre de 2010, de VENTANA MEDICAL SYSTEMS, INC.: Un dispensador de fluido que comprende:
un cuerpo cilíndrico que tiene una cámara del depósito que incluye una porción […]
 SISTEMA AUTOMATICO DE DISPENSACION DE REACTIVO Y METODO DE OPERACION, del 19 de Febrero de 2010, de SAKURA FINETEK U.S.A., INC.: Un método de dispensar reactivo, incluyendo los pasos de: determinar un inventario de teñidor ; descargar un programa de procesado de una serie de pasos de procesado de un […]
SISTEMA AUTOMATICO DE DISPENSACION DE REACTIVO Y METODO DE OPERACION, del 19 de Febrero de 2010, de SAKURA FINETEK U.S.A., INC.: Un método de dispensar reactivo, incluyendo los pasos de: determinar un inventario de teñidor ; descargar un programa de procesado de una serie de pasos de procesado de un […]
 CASETE DE REACTIVOS, del 18 de Marzo de 2011, de F. HOFFMANN-LA ROCHE AG: Casete de reactivos , que puede utilizarse de modo reemplazable en un analizador y contiene varias bolsas de reactivos (A, B, C, D), […]
CASETE DE REACTIVOS, del 18 de Marzo de 2011, de F. HOFFMANN-LA ROCHE AG: Casete de reactivos , que puede utilizarse de modo reemplazable en un analizador y contiene varias bolsas de reactivos (A, B, C, D), […]
 APARATO DISPENSADOR DE REACTIVOS DE MULTIPLES CANALES Y PROCEDIMIENTO DE DISPENSACION, del 3 de Noviembre de 2010, de BIOSEARCH TECHNOLOGIES, INC: Cabezal dispensador de reactivos de múltiples canales (14a, 14b) para introducir una pluralidad de reactivos en una celda , comprendiendo el cabezal dispensador: un cuerpo […]
APARATO DISPENSADOR DE REACTIVOS DE MULTIPLES CANALES Y PROCEDIMIENTO DE DISPENSACION, del 3 de Noviembre de 2010, de BIOSEARCH TECHNOLOGIES, INC: Cabezal dispensador de reactivos de múltiples canales (14a, 14b) para introducir una pluralidad de reactivos en una celda , comprendiendo el cabezal dispensador: un cuerpo […]
 APARATO Y METODO PARA MANEJAR FLUIDOS PARA ANALISIS, del 17 de Febrero de 2010, de ABBOTT LABORATORIES: Un dispositivo de manejo de espécimen, que incluye: una plataforma que tiene una pluralidad de posiciones definidas en la misma, incluyendo una pluralidad de […]
APARATO Y METODO PARA MANEJAR FLUIDOS PARA ANALISIS, del 17 de Febrero de 2010, de ABBOTT LABORATORIES: Un dispositivo de manejo de espécimen, que incluye: una plataforma que tiene una pluralidad de posiciones definidas en la misma, incluyendo una pluralidad de […]
Procedimiento para la fijación de muestras tisulares, del 18 de Marzo de 2020, de VENTANA MEDICAL SYSTEMS, INC.: Un procedimiento para fijar una muestra tisular, que comprende: a) poner en contacto la muestra tisular con una primera solución de aldehído a una primera […]
Sistema de procesamiento para procesar muestras usando energía acústica, del 2 de Octubre de 2019, de VENTANA MEDICAL SYSTEMS, INC.: Un procedimiento de evaluación de una muestra biológica, comprendiendo dicho procedimiento - realizar un procedimiento histológico en una muestra biológica , […]