Anticuerpos anti-hepsina y métodos de uso de los mismos.
Un anticuerpo anti-hepsina aislado, en el que una forma monovalente del anticuerpo se une a hepsina humana con una afinidad inferior o igual a 10 nM o mejor,
en el que una forma monovalente del anticuerpo se une a hepsina de ratón con una afinidad inferior o igual a 330 nM, y en el que el anticuerpo se une a hepsina presente en un complejo que comprende hepsina y un inhibidor de serina proteasa que se une al subsitio S1 de hepsina humana, y en el que el anticuerpo comprende:
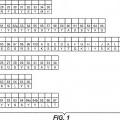
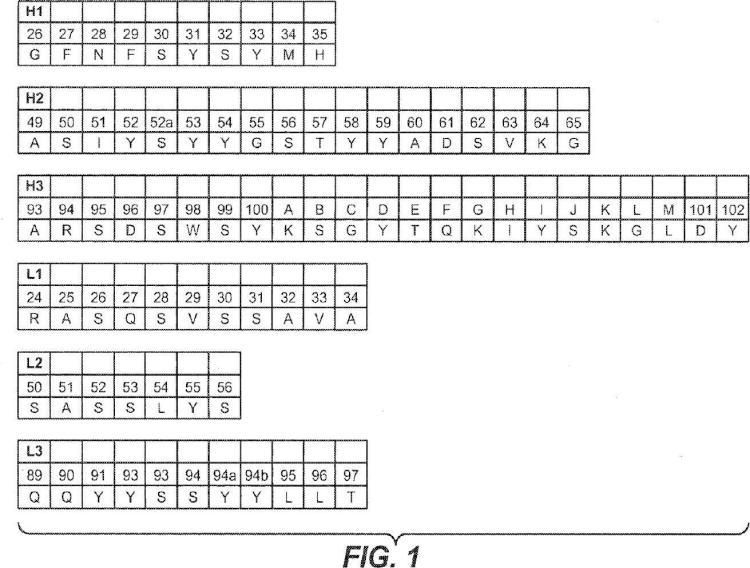
(a) HVR-H1 que comprende la secuencia ; GFNFSYSYMH (SEQ ID NQ:4);
(b) HVR-H2 que comprende la secuencia ; ASIYSYYGSTYYADSVKG(SEQ:IDNO:5);
(c) HVR-H3 que comprende la secuencia; ARSDSWSYKSGYTQKIYSKGLDY (SEQ ID NQ:6)
(d) HVR-L1 que comprende la secuencia ; RASQSVSSAVA (SEQ ID NO:1);
(e) HVR-L2 que comprende la secuencia ; SASSLYS (SEQ ID NO:2): y
(f) HVR-L3 que comprende la secuencia ; QQYYSSYYLLT (SEQ ID NO:3).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2010/053591.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Inventor/es: KIRCHHOFER, DANIEL, ZHANG,Yingnan, MORAN,PAUL M, GANESAN,RAJKUMAR.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K16/40 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra enzimas.
- C07K16/44 C07K 16/00 […] › contra material no previsto.
PDF original: ES-2534646_T3.pdf


Fragmento de la descripción:
Anticuerpos anti-hepsina y métodos de uso de los mismos CAMPO DE LA INVENCIÓN
La presente invención se refiere generalmente al campo de la biología molecular. Más específicamente, la invención se refiere a anticuerpos anti-hepsina, y a usos de los mismos.
ANTECEDENTES DE LA INVENCIÓN
La hepslna es una serina proteasa de transmembrana de tipo II (TTSP) expresada sobre la superficie de células epiteliales. La proteína de 417 aminoácidos está compuesta por un dominio cltoplásmico del extremo N corto, un dominio transmembrana y un único dominio rico en cisterna de receptor depurador que se compacta estrechamente contra el dominio de proteasa del extremo C (Somoza y col. (23) Structure 11(9), 1123-1131). La función fisiológica de la hepsina no está clara. A pesar de su expresión en las fases muy tempranas de la embriogénesis (Vu y col. (1997) J Biol Chem 272 (5), 31315-3132), los ratones deficientes en hepsina fueron viables y se desarrollaron normalmente (Yu y col. (2) Thromb Haemost 84(5), 865-87; Wu y col. (1998) J Clin Invest 11(2), 321-326). Se encontró que la hepsina no era esencial para la regeneración del hígado y para las funciones fisiológicas relacionadas con la coagulación (ídem). Un estudio reciente demostró que los ratones inactivados en hepsina están auditivamente alterados. Guipponi y col. (27) Am J Pathol 171:68-616. Sin embargo, la hepsina participa en el cáncer de ovario [(Tanimoto y col. (1997) Cáncer Res 57(14), 2884-2887); documento W21/62271] y de próstata. Varios estudios de expresión génica identificaron la hepsina como uno de los genes más altamente inducidos en cáncer de próstata (Dhanasekaran y col. (21) Nature 412, 822-826; Luo y col. (21) Cáncer Res 61(12), 4683-4688; Magee y col. (21) Cáncer Res 61(15), 5692-5696; Stamey y col. (21) J Urol 166(6), 2171-2177; Stephan y col. (24) J Urol 171(1), 187-191; Welsh y col. (21) Cáncer Res 61(16), 5974- 5978). Se encontró que los niveles de ARN de hepsina eran bajos en próstata normal e hlperplasla benigna, pero fuertemente elevados en carcinoma de próstata, particularmente en estadios avanzados ((Dhanasekaran y col. (21) Nature 412, 822-826; Luo y col. (21) Cáncer Res 61(12), 4683^688; Magee y col. (21) Cáncer Res 61(15), 5692-5696; Stamey y col. (21) J Urol 166(6), 2171-2177; Stephan y col. (24) J Urol 171(1), 187-191; Welsh y col. (21) Cáncer Res 61(16), 5974-5978). La tinción de la proteína hepslna con un anticuerpo anti- hepsina monoclonal mostró que la expresión de la hepslna era la mayor en sitios de metástasis al hueso y en tumores primarlos de estadio tardío (Xuan y col. (26) Cáncer Res 66(7), 3611-3619), que está de acuerdo con el hallazgo de que niveles de ARN de hepslna elevados se correlacionaron con mayores grados de Gleason y progresión tumoral ((Luo y col. (21) Cáncer Res 61(12), 4683-4688; Magee y col. (21) Cáncer Res 61(15), 5692-5696; Stamey y col. (21) J Urol 166(6), 2171-2177; Stephan y col. (24) J Urol 171(1), 187-191; Chen y col. (23) J Urol 169(4), 1316-1319).
La evidencia experimental de una función de la hepslna en el cáncer de próstata provino de un estudio por Klezovltch y col. (Klezovltch y col. (24) Cáncer Cell 6(2), 185-195) que demostró que en un modelo de ratón de cáncer de próstata no metastatlzante, la expresión en exceso de hepslna condujo a la progresión de tumor primarlo y metástasis. Curiosamente, la expresión en exceso de hepslna se asoció a rotura de la membrana basal (ídem), indicando hacia la posibilidad de que la actividad de la hepsina estuviera algo asociada a la degradación de componentes de la membrana basal. In vitro, la hepslna puede convertir el factor de crecimiento latente el pro-factor de crecimiento de hepatocltos (pro-HGF) en su forma blcatenarla activa (HGF), que Indujo la señalización del receptor de Met (Herter y col. (25) Biochem J 39 (Pt 1), 125-136; Kirchhofer y col. (25) FEBS Lett 579(9), 1945-195; documento W26/14928). La hepslna también es capaz de convertir pro-uPA en su forma activa (Moran y col., (26) J Biol Chem. 281(41):3439-46) y escindir lamina in vitro (Trlpathl y col. (28) J Biol Chem. 283:3576). Debido a que la ruta de FIGF/Met participa en el crecimiento tumoral Invasivo y la metástasis, es posible que la expresión en exceso de la hepsina active el eje de FIGF/Met en cáncer de próstata (Flerter y col. (25) Biochem J 39 (Pt 1), 125-136; Kirchhofer y col. (25) FEBS Lett 579(9), 1945-195; documento W26/14928). También se mostró que la hepslna escindía otros sustratos in vitro, principalmente proteínas relacionadas con la coagulación (Flerter y col., ídem; Kazama y col. (1995) J Biol Chem 27(1), 66-72). Sin embargo, no se conoce su función en la tumorlgénesls.
Xuan y col. (26) Cáncer Res 66(7), 3611-3619, desvelan anticuerpos murlnos monoclonales para una forma actlvable de hepslna, que neutralizaron parcialmente la actividad proteolítlca en ensayos enzlmáticos con el sustrato pNA.
El documento W24/3363 desvela anticuerpos producidos contra moléculas de hepsina modificadas, que bloquearon parcialmente la actividad proteolítlca en ensayos enzlmáticos con el sustrato cromogénico.
El documento W27/149932 desvela anticuerpos anti-hepsina monoclonales, que no afectan la actividad proteolítlca de la hepslna.
Es evidente que sigue existiendo una necesidad de agentes que tengan atributos clínicos que sean óptimos para el desarrollo como agentes terapéuticos. La invención descrita en el presente documento satisface esta necesidad y proporciona otros beneficios.
SUMARIO DE LA INVENCIÓN
La invención se basa en parte en la identificación de una variedad de agentes de unión a hepsina (tales como anticuerpos, y fragmentos de los mismos). La hepsina presenta una diana terapéutica importante y ventajosa, y la invención proporciona composiciones y métodos basados en la unión de los agentes a hepsina. Los agentes de unión a hepsina de la invención, como se describen en el presente documento, proporcionan importantes agentes terapéuticos y de diagnóstico para su uso en elegir como diana afecciones patológicas asociadas a la expresión y/o actividad de las rutas de señalización de hepsina. Por consiguiente, la invención proporciona métodos, composiciones, kits y artículos de fabricación relacionados con la unión a hepsina.
El sitio activo de las serlna proteasas similares a tripsina, tales como hepsina, está formado por varios bucles intrínsecamente móviles (el 'dominio de activación') (Huber y Bode, 1978). En particular, el bucle 22 forma parte del bolsillo S1 y pueden adoptar diversos estados conformacionales en algunas serina proteasas (Johnson y col., 25; Shia y col., 25; Spraggon y col., 29; Wilken y col., 24). Sin embargo, las estructuras co-cristalinas de las serina proteasas con un inhibidor del sitio activo mostraron sitios activos apropiadamente formados, lo más probablemente debido a fuerzas estabilizantes aplicadas por el inhibidor (Ami y col., 1994; Shia y col., 25; Spraggon y col., 29). Se razonó que la ocupación del bolsillo S1 por un inhibidor de serina proteasa podía aplicar fuerzas estabilizantes sobre la flexibilidad del bucle del sitio activo de la serina proteasa, facilitando el reconocimiento de anticuerpos del sitio activo de la serina proteasa. Así, para identificar anticuerpos anti-hepsina que bloquean la actividad enzlmátlca de hepsina, se obtuvieron anticuerpos que se unen a hepsina en el complejo con un inhibidor de serina proteasa que ocupa el bolsillo S1, 3,4-dicloro-isocumarina (DCI).
La presente invención proporciona anticuerpos que se unen a hepsina. En un aspecto, la invención caracteriza un anticuerpo aislado que se une a hepsina.
En un aspecto, la invención proporciona un anticuerpo anti-hepsina aislado, en el que una forma monovalente (tal como una forma Fab) del anticuerpo se une específicamente a hepsina humana con una afinidad de unión de aproximadamente 1 nM o mejor. En algunas realizaciones, el anticuerpo se une específicamente a hepsina humana con una afinidad de unión de aproximadamente 6 nM o mejor. Como está bien establecido en la técnica, la afinidad de unión de un ligando a su receptor puede determinarse usando cualquiera de una variedad de ensayos, y expresarse en términos de una variedad de valores cuantitativos. Por consiguiente, en una realización, la afinidad de unión se expresa como valores de Kd y refleja afinidad de unión intrínseca (por ejemplo, con efectos de avidez minimizados). Generalmente y preferentemente, la afinidad de unión se mide in vitro, tanto en un entorno libre de células como asociado a células. Puede usarse cualquiera de varios ensayos conocidos en la técnica, que incluyen aquellos descritos en el presente documento, para obtener mediciones de afinidad de unión, que incluyen, por ejemplo,... [Seguir leyendo]
Reivindicaciones:
1.- Un anticuerpo anti-hepsina aislado, en el que una forma monovalente del anticuerpo se une a hepsina humana con una afinidad Inferior o Igual a 1 nM o mejor, en el que una forma monovalente del anticuerpo se une a hepsina de ratón con una afinidad inferior o igual a 33 nM, y en el que el anticuerpo se une a hepsina presente en un complejo que comprende hepsina y un inhibidor de serina proteasa que se une al subsitio S1 de hepsina humana, y en el que el anticuerpo comprende:
(a) HVR-H1 que comprende la secuencia GFNFSYSYMH (SEQ ID NO:4);
(b) HVR-H2 que comprende la secuencia ASIYSYYGSTYYADSVKG (SEQ ID NO:5);
(c) HVR-H3 que comprende la secuencia ARSDSWSYKSGYTQKIYSKGLDY (SEQ ID NO:6)
(d) HVR-L1 que comprende la secuencia RASQSVSSAVA (SEQ ID NO: 1) j
(e) HVR-L2 que comprende la secuencia SASSLYS (SEQ ID NO:2); y
(f) HVR-L3 que comprende la secuencia QQYYSSYYLLT (SEQ ID NO:3).
2.- El anticuerpo de la reivindicación 1, en el que el inhibidor de serina proteasa es 3,4-dicloro-isocumarlna (DCI).
3.- El anticuerpo de la reivindicación 1, en el que el anticuerpo inhibe la activación mediada por hepsina de proteína
estimulante de macrófagos (MSP).
4.- El anticuerpo de la reivindicación 1, en el que el anticuerpo inhibe la migración de células dependiente de lamlnlna.
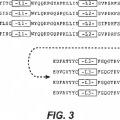
5.- El anticuerpo de la reivindicación 1, que comprende además una secuencia de la región estructural del dominio variable de la cadena pesada o dominio variable de la cadena ligera mostrada en la Figura 3, 4, 5 o 6.
6.- El anticuerpo de la reivindicación 1, que comprende (a) una secuencia de VH que tiene al menos el 95 % de identidad de secuencias con la secuencia de aminoácidos de SEQ ID NO: 1; o (b) una secuencia de VL que tiene al menos el 95 % de identidad de secuencias con la secuencia de aminoácidos de SEQ ID NO: 9; o (c) una secuencia de VH como en (a) y una secuencia de VL como en (b).
7 - El anticuerpo de la reivindicación 6, que comprende una secuencia de VH de SEQ ID NO: 1 y una secuencia de
VL de SEQ ID NO: 9.
8 - El anticuerpo de cualquiera de las reivindicaciones precedentes, que es un anticuerpo lgG1 de longitud completa.
9.- El anticuerpo de cualquiera de las reivindicaciones precedentes, en el que el anticuerpo comprende la secuencia de la región estructural consenso del subgrupo k humano.
1.- El anticuerpo de cualquiera de las reivindicaciones precedentes, en el que el anticuerpo comprende la secuencia de la región estructural consenso del subgrupo III humano de la cadena pesada.
11.- Ácido nucleico aislado que codifica el anticuerpo de cualquiera de las reivindicaciones precedentes.
12.- Un inmunoconjugado que comprende el anticuerpo de la reivindicación 1 y un agente citotóxico.
13.- Una formulación farmacéutica que comprende el anticuerpo de la reivindicación 1 y un vehículo farmacéuticamente aceptable.
Patentes similares o relacionadas:
Bloqueo de CD73, del 22 de Julio de 2020, de Innate Pharma: Un anticuerpo aislado que específicamente se une a un polipéptido CD73 humano en la superficie de una célula y que tiene capacidad de neutralizar […]
Formulaciones estables que contienen anticuerpos anti-PCSK9, del 15 de Julio de 2020, de AMGEN INC.: Una formulación estable que comprende un anticuerpo monoclonal que se une específicamente a PCSK9, en donde PCSK9 comprende los aminoácidos de la SEQ ID NO: […]
PTPRS y proteoglicanos en enfermedad autoinmune, del 15 de Julio de 2020, de LA JOLLA INSTITUTE FOR ALLERGY AND IMMUNOLOGY: Una proteína recombinante no enzimática que comprende una secuencia de aminoácidos de un dominio extracelular de PTPRS, donde la proteína comprende tanto el dominio 1 (Ig1) […]
Uso de un anticuerpo antipresenilina para la prevención y/o tratamiento del cáncer, del 20 de Mayo de 2020, de ALZHEIMUR 2012 S.L: Un anticuerpo o un fragmento del mismo que se une específicamente a la SEQ ID NO: 1 de la presenilina para su uso en la prevención y/o tratamiento del cáncer.
Proteínas de unión a antígeno para proproteína convertasa subtilisina kexina tipo 9 (PCSK9), del 6 de Mayo de 2020, de AMGEN INC.: Una proteína de unión a antígeno, donde dicha proteína de unión a antígeno (i) comprende (a) un dominio variable de cadena ligera que comprende una secuencia […]
Anticuerpos frente a CD73 y sus usos, del 6 de Mayo de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un anticuerpo aislado que se une a Grupo de Diferenciación 73 (CD73) humano y que comprende las secuencias CDR1, CDR2 y CDR3 de la cadena pesada que comprenden las […]
Composiciones y métodos terapéuticos, del 6 de Mayo de 2020, de INSTITUT PASTEUR: Un compuesto para su uso en un método para tratar una inmunodeficiencia de células T CD4 en un sujeto que lo necesita, en el que el compuesto es […]
Inmunotoxinas de unión a CD20 para inducir la internalización celular y procedimientos que usan las mismas, del 6 de Mayo de 2020, de MOLECULAR TEMPLATES, INC: Una proteína de unión a CD20 que comprende: a) una región de unión a CD20 que comprende una región de unión de tipo inmunoglobulina: (i) capaz […]