Proteínas híbridas de pincipales alérgenos de Parietaria judaica y usos de las mismas.
Proteína híbrida que consiste en alérgenos Par j 1 y Par j 2 mutados,
opcionalmente separados por unligador, en la que:
a) la secuencia de Par j 1 es o bien SEQ ID NO:1 o bien una secuencia de una proteína que se produce demanera natural idéntica a SEQ ID NO:1 en al menos el 95%,
yen dicha secuencia de Par j 1, los residuos de Lys en las posiciones 23, 27, 41 y 66 de SEQ ID NO:1, o enlas posiciones correspondientes de dicha proteína que se produce de manera natural en las que estánpresentes residuos de Lys correspondientes en alineaciones de secuencias respectivas, se sustituyen poraminoácidos neutros, polares o ácidos;
b) la secuencia de Par j 2 es o bien SEQ ID NO:2 o bien una secuencia de una proteína que se produce demanera natural idéntica a SEQ ID NO:2 en al menos el 95%,y
en dicha secuencia de Par j 2, los residuos de Lys en las posiciones 19, 23, 27, 35, 41, 46, 73 y 78 de SEQID NO:2, o en las posiciones correspondientes de dicha proteína que se produce de manera natural en lasque están presentes residuos de Lys correspondientes en alineaciones de secuencias respectivas, sesustituyen por aminoácidos neutros, polares o ácidos;
c) las secuencias de Par j 1 y Par j 2, tal como se definió anteriormente, pueden ubicarse indistintamente enlos extremos N o C terminales de la proteína híbrida, siempre que tengan orientación cabeza a cola;
d) si está presente, dicho ligador consiste en de 1 a 8 aminoácidos.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E10171705.
Solicitante: LOFARMA S.P.A..
Nacionalidad solicitante: Italia.
Dirección: VIALE CASSALA, 40 20143 MILANO ITALIA.
Inventor/es: FALAGIANI, PAOLO, MISTRELLO, GIOVANNI, RONCAROLO, DANIELA, ZANOTTA, STEFANIA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/36 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › del polen.
- C07K14/415 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de vegetales.
- C12N15/62 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Secuencias de ADN que codifican proteínas de fusión.
PDF original: ES-2384231_T3.pdf
Fragmento de la descripción:
Proteínas híbridas de principales alérgenos de Parietaria judaica y usos de las mismas La presente invención proporciona proteínas hipoalergénicas diméricas de Parietaria judaica, moléculas de ácido nucleico que codifican para estas, composiciones farmacéuticas que contienen las mismas, y su uso en la inmunoterapia de enfermedades alérgicas provocadas por polen de plantas de la especie Parietaria judaica.
Antecedentes de la invención
Las alergias están provocadas por una anomalía en el sistema inmunitario que reacciona produciendo anticuerpos IgE frente a proteínas que, en sí mismas, son completamente inocuas y están principalmente contenidas en polen, ácaros, epitelios y algunos alimentos.
Estimaciones recientes muestran que más del 25% de las personas en naciones industrializadas están afectadas por esta enfermedad, que, persistiendo en el tiempo, puede inducir el empeoramiento de síntomas (por ejemplo, aparición de asma) , y sensibilización a otros alérgenos, haciendo por tanto que la elección de la terapia más apropiada sea más complicada (1) .
La inmunoterapia específica hiposensibilizante (SIT) , a diferencia de la terapia farmacológica, es la única forma de tratamiento etiológico de enfermedades alérgicas que puede afectar positivamente a algunos parámetros inmunológicos que son la base de la enfermedad.
SIT consiste en la administración de dosis crecientes de extractos normalizados (vacunas) obtenidos de la misma sustancia que provoca la enfermedad (2) .
De este modo, se induce gradualmente una especie de “tolerancia inmunológica” frente a tal sustancia en los pacientes. Esta tolerancia inmunológica está asociada con una reducción o incluso desaparición de síntomas alérgicos.
El riesgo para provocar efectos secundarios que son incluso de naturaleza grave (3) , también si se reduce considerablemente mediante el uso de vacunas de liberación lenta o vacunas que se administran por vías alternativas a inyecciones, ha limitado la aplicabilidad de SIT en la terapia de enfermedades alérgicas. Además, puesto que SIT se lleva a cabo administrando una mezcla de proteínas alergénicas y no alergénicas de origen natural sin tener en cuenta el perfil de sensibilización del paciente, pueden surgir nuevas reactividades de IgE frente a alérgenos inicialmente nocivos que están presentes en el extracto.
Un elemento relacionado con el beneficio provocado por SIT es la inducción de anticuerpos IgG específicos para el alérgeno sensibilizante. Estos anticuerpos (protectores) pueden inhibir la unión de IgE al antígeno, influyendo por tanto en la estructura tridimensional de esta molécula (4, 5) . El desarrollo de vacunas constituidas por proteínas recombinantes que tienen menos alergenicidad pero una capacidad inmunogénica inalterada puede dar como resultado una mejora adicional en el campo de terapia de enfermedades alérgicas.
Durante los últimos 15 años, se han hecho avances considerables en el campo de la caracterización de alérgenos gracias a la aplicación de tecnologías basadas en ADN recombinante. Los ADNc que codifican para principales alérgenos están disponibles para estudios de alergenicidad y el desarrollo de pruebas de diagnóstico, y permiten SIT innovadoras basadas en el uso de proteínas recombinantes purificadas y sus variantes genéticamente modificadas que se caracterizan por actividad alergénica reducida (6) .
El polen de Parietaria es una de las causas más importantes de alergia en la zona mediterránea. En particular, al menos el 50% de todos los sujetos alérgicos en el sur de Italia muestran una respuesta positiva a la prueba cutánea de punción (SPT) para el polen de Parietaria (7) .
Los dos principales alérgenos de polen de Parietaria judaica, es decir Par j 1 (cuya secuencia de nucleótidos se identifica por el n.º de registro de GenBank X95867) , y Par j 2 (AC X95865) , son proteínas con pesos moleculares de 14, 4 y 11, 3 kD, respectivamente, y comparten homología funcional y de secuencia (8, 9) . El porcentaje de identidad de secuencia es de alrededor del 45%, y es más prominente en la región N terminal de las proteínas, en la que se ubica el epítopo de IgE más importante. Este epítopo es responsable de mucha de la reactividad cruzada entre las dos moléculas (10, 11) . Estos dos alérgenos independientes presentan características comunes, y pertenecen a una familia de proteínas de origen vegetal que se denominan ns-LTP (proteínas de transferencia de lípidos no específicas) y se caracterizan por una estructura tridimensional altamente conservada (12) . Estas proteínas tienen la función de transportar moléculas lipídicas a través de la membrana.
Se han realizado numerosos estudios para identificar o alterar epítopos de IgE de principales alérgenos de Parietaria.
Cambiando algunas cisteínas que son relevantes para mantener la estructura tridimensional en ambos alérgenos, se han obtenido mutantes tridimensionales con unión a IgE reducida y alergenicidad disminuida frente a seres humanos mediante mutagénesis específica del sitio (13) .
El uso de péptidos sintéticos solapantes correspondientes a las secuencias enteras de Par j 1 y Par j 2 permitió la detección de epítopos lineales que pueden unirse a IgE de pacientes alérgicos a Parietaria. El posicionamiento de estas secuencias en el modelo tridimensional de los dos alérgenos permitió la localización de tres regiones con reactividad a IgE fuerte y un alto grado de homología en ambas moléculas (11) .
El documento WO02/22674 (14) da a conocer una variante hipoalergénica del principal alérgeno Par j 2 (correspondiente a SEQ ID NO: 10 mostrada a continuación) , en la que el cambio en 8 lisinas distribuidas por toda la proteína provoca una fuerte disminución en la capacidad de unión a IgE específicas.
El documento EP1712560 (15) identifica los aminoácidos implicados en reacciones de unión entre IgE específicas y Par j 1. Las diferentes combinaciones de residuos mutagenizados dan lugar a moléculas con diferentes grados de alergenicidad, y muestran la presencia de múltiples epítopos que se reconocen de manera variable por pacientes alérgicos a Parietaria judaica.
La posibilidad de usar moléculas multiméricas modificadas por ingeniería constituidas por diferentes alérgenos del mismo organismo para terapia específica de hiposensibilización se ha considerado fascinante desde hace mucho tiempo.
La alergia al polen de Parietaria es un modelo de estudio óptimo ya que esta alergia se provoca principalmente por los dos componentes alergénicos, Par j 1 y Par j 2, una mezcla de los cuales puede inhibir la unión entre IgE específicas y polen de Parietaria judaica hasta el 95% (16) , demostrando así que otros alérgenos en el extracto son clínicamente menos importantes. Se sabe que Par j 1 y Par j 2 comparten numerosos epítopos de IgE, y que puede usarse Par j 2 como un marcador para el diagnóstico de alergia a Parietaria.
La asociación de Par j 1 y Par j 2 en una molécula híbrida individual representaría el repertorio completo de epítopos T, y podría inducir una fuerte respuesta de IgG protectora.
El documento W02004/104047 (17) propone un multímero que comprende al menos una primera secuencia de aminoácidos que corresponde a uno de los principales alérgenos Par j 1 o Par j 2 de Parietaria, una segunda secuencia que codifica para Par j 1 o Par j 2, y preferiblemente una tercera secuencia de uno de los dos principales alérgenos de Parietaria. El objeto de la invención también son moléculas multiméricas en las que los principales alérgenos se mutan en la región entre los aminoácidos de 1 a 30, preferiblemente en las posiciones Lys 23, Glu 24, y Lys 27. En la sección de resultados, se analiza la capacidad de inducir la liberación de histamina a partir del dímero Parj2-Parj 1 mutagenizado o de tipo natural en comparación con una mezcla equimolar de los alérgenos Par j 1 y Par j 2 recombinantes individuales. Se notifica (figura 6, página 12) que el dímero de tipo natural (clon PjED) induce menos liberación de histamina en dos de los tres pacientes sometidos a prueba (paneles G y H) , mientras que el dímero mutagenizado (clon PjEDmut) es igual al dímero de tipo natural en dos de los tres pacientes, y es menos eficaz en uno de los tres (panel F) , mostrando así que las mutaciones insertadas en el clon PjEDmut en las posiciones Lys 23, Glu 24 y Lys 27 no son cruciales para la unión específica a IgE de todos los pacientes alérgicos.... [Seguir leyendo]
Reivindicaciones:
1. Proteína híbrida que consiste en alérgenos Par j 1 y Par j 2 mutados, opcionalmente separados por un ligador, en la que:
a) la secuencia de Par j 1 es o bien SEQ ID NO:1 o bien una secuencia de una proteína que se produce de manera natural idéntica a SEQ ID NO:1 en al menos el 95%,
y en dicha secuencia de Par j 1, los residuos de Lys en las posiciones 23, 27, 41 y 66 de SEQ ID NO:1, o en las posiciones correspondientes de dicha proteína que se produce de manera natural en las que están presentes residuos de Lys correspondientes en alineaciones de secuencias respectivas, se sustituyen por aminoácidos neutros, polares o ácidos;
b) la secuencia de Par j 2 es o bien SEQ ID NO:2 o bien una secuencia de una proteína que se produce de manera natural idéntica a SEQ ID NO:2 en al menos el 95%,
y en dicha secuencia de Par j 2, los residuos de Lys en las posiciones 19, 23, 27, 35, 41, 46, 73 y 78 de SEQ ID NO:2, o en las posiciones correspondientes de dicha proteína que se produce de manera natural en las que están presentes residuos de Lys correspondientes en alineaciones de secuencias respectivas, se sustituyen por aminoácidos neutros, polares o ácidos;
c) las secuencias de Par j 1 y Par j 2, tal como se definió anteriormente, pueden ubicarse indistintamente en los extremos N o C terminales de la proteína híbrida, siempre que tengan orientación cabeza a cola;
d) si está presente, dicho ligador consiste en de 1 a 8 aminoácidos.
2. Proteína híbrida según la reivindicación 1, en la que dichos residuos de Lys se sustituyen por aminoácidos seleccionados de Ala, Gly, Pro, Leu, Ile, Phe, Thr, Ser, Gln, Asn, Glu, Asp.
3. Proteína híbrida según la reivindicación 2, en la que dichos aminoácidos se seleccionan de Ala, Gly, Thr, Ser, Gln, Asn, Glu, Asp.
4. Proteína híbrida según la reivindicación 1, en la que dicho ligador es un dipéptido.
5. Proteína híbrida según la reivindicación 1, en la que Par j 1 y Par j 2 se ubican en los extremos N y C terminales, respectivamente.
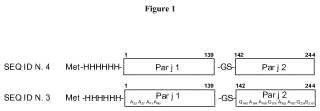
6. Proteína híbrida según la reivindicación 1, que tiene la secuencia SEQ ID NO:3.
7. Molécula de ácido nucleico que codifica para una proteína híbrida según las reivindicaciones 1-6.
8. Molécula de ácido nucleico según la reivindicación 6, que tiene la secuencia SEQ ID NO: 8.
9. Vector de expresión que contiene la molécula de ácido nucleico según las reivindicaciones 7-8.
10. Célula huésped que contiene el vector según la reivindicación 9.
11. Composición farmacéutica que comprende una cantidad eficaz de una proteína híbrida según las reivindicaciones 1-6 junto con excipientes y portadores farmacéuticamente aceptables.
12. Composición farmacéutica según la reivindicación 11, que está en forma de una vacuna adecuada para la inmunoterapia de enfermedades alérgicas.
13. Proteína híbrida según las reivindicaciones 1-6, o composición farmacéutica según las reivindicaciones 1112, para el tratamiento preventivo o terapéutico de enfermedades alérgicas provocadas por el polen de Parietaria judaica.
14. Proteína híbrida según las reivindicaciones 1-6, o composición farmacéutica según las reivindicaciones 1112, para el tratamiento de asma bronquial alérgica o rinoconjuntivitis alérgica.
Patentes similares o relacionadas:
Cadena ligera de enteroquinasa modificada, del 22 de Julio de 2020, de NOVO NORDISK A/S: Un análogo de la cadena ligera de la enteroquinasa bovina que comprende una secuencia de aminoácidos establecida en la SEQ ID NO: 1, en donde dicho análogo comprende […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Métodos y composiciones para ingeniería genómica, del 3 de Junio de 2020, de Sangamo Therapeutics, Inc: Una pareja de nucleasas de dedo de zinc (ZFN) que comprende una ZFN izquierda y una ZFN derecha, comprendiendo cada ZFN un dominio de escisión […]
Métodos y composiciones para escisión dirigida y recombinación, del 20 de Mayo de 2020, de Sangamo Therapeutics, Inc: Un método in vitro para la escisión selectiva de un gen HLA clase I, un gen HLA que codifica una proteína de clase 1 del Complejo de Histocompatibilidad Mayor (MHC) […]
Antígenos de coagulasa estafilocócica y métodos para su uso, del 13 de Mayo de 2020, de UNIVERSITY OF CHICAGO: Una composición inmunógena que comprende al menos dos dominios 1-2 de coagulasa estafilocócica diferentes, en donde cada uno de los al menos dos dominios […]
Reconocimiento de unión a diana celular mediante un agente bioactivo usando transferencia de energía de resonancia de bioluminiscencia intracelular, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un sistema de ensayo que comprende: (a) una biblioteca de agentes bioactivos, cada uno de los cuales está fijado a un fluoróforo; (b) una diana celular fusionada a […]
Etiqueta de epítopo y método de detección, captura y/o purificación de polipéptidos etiquetados, del 15 de Abril de 2020, de ChromoTek GmbH: Péptido epítopo aislado que tiene de 12 a 25 aminoácidos, en donde la secuencia de aminoácidos comprende una secuencia según se define en SEQ ID NO: 32 (X1X2RX4X5AX7SX9WX11X12), […]
Utilización diagnóstica de un polipéptido de fusión que comprende una proteína vírica y un enzima MGMT, del 15 de Abril de 2020, de INSTITUT PASTEUR: Utilización in vitro de un polipéptido de fusión que comprende una proteína vírica y i) el enzima 6-metilguanina-ADN-metiltransferasa (MGMT, EC 2.1.1.63) o un homólogo […]