HIDROLIZADO DE ANIMALES MARINOS, PROCEDIMIENTO, OBTENCIÓN Y UTILIZACIÓN.
La presente invención se relaciona con un procedimiento de obtención de un hidrolizado de vísceras de animales marinos,
con el hidrolizado susceptible de ser obtenido por este procedimiento y utilización del hidrolizado como medicamento, alimento o aditivo o complemento alimentario.
El hidrolizado susceptible de ser obtenido por el procedimiento de la presente invención permite particularmente frenar o detener los procesos de degeneración muscular, aumentar el desarrollo muscular, disminuir la masa grasa en beneficio de la masa seca, luchar contra patologías musculares, disminuir la absorción de nutrientes a nivel intestinal, reforzar el sistema inmunitario, aumentar la tasa de hemoglobina y/o de hematocrito, disminuir la celulitis, y/o aumentar la saciedad.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201031393.
Solicitante: LABORATOIRES LE STUM.
Nacionalidad solicitante: Francia.
Dirección: PARC ARMON OCEAN 4 IMPASSE DE KERHOAS LARMOR PLAGE F 56260 FRANCIA.
Inventor/es: LE STUM,MICHEL, LE STUM,RAYMOND.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A23J1/04 NECESIDADES CORRIENTES DE LA VIDA. › A23 ALIMENTOS O PRODUCTOS ALIMENTICIOS; SU TRATAMIENTO, NO CUBIERTO POR OTRAS CLASES. › A23J COMPOSICIONES A BASE DE PROTEINAS PARA LA ALIMENTACION; TRATAMIENTO DE PROTEINAS PARA LA ALIMENTACION; COMPOSICIONES A BASE DE FOSFATIDOS PARA LA ALIMENTACION. › A23J 1/00 Preparación de composiciones a base de proteínas para la alimentación; Apertura de huevos en grandes cantidades y separación de la yema de la clara. › a partir del pescado o de otros animales marinos.
- A23J3/04 A23J […] › A23J 3/00 Tratamiento de proteínas para la alimentación. › Proteínas animales.
- A23J3/34 A23J 3/00 […] › utilizando enzimas.
- A23L1/325
- A23L1/333
- A61K35/56 A […] › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sustancias procedentes de animales distintos de los mamíferos.
- A61P21/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del sistema muscular o neuromuscular.
- A61P37/00 A61P […] › Medicamentos para el tratamiento de problemas inmunológicos o alérgicos.
- C12P21/06 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › preparados por hidrólisis de un enlace peptídico, p. ej. hidrolizados.
- C12S3/24
PDF original: ES-2361348_A1.pdf
Fragmento de la descripción:
Hidrolizado de animales marinos, procedimiento, obtención y utilización.
Campo técnico
La presente invención se relaciona con un procedimiento de obtención de un hidrolizado de coproductos de animales marinos, siendo el hidrolizado susceptible de ser obtenido por este procedimiento y la utilización del hidrolizado como medicamento, alimento o aditivo o complemento alimentario.
El hidrolizado susceptible de ser obtenido por el procedimiento de la presente invención permite particularmente frenar o detener los procesos de degeneración muscular, aumentar el desarrollo muscular, disminuir la masa grasa para aprovechar la masa seca, luchar contra patologías musculares, disminuir la absorción de nutrientes a nivel intestinal, reforzar el sistema inmunitario, aumentar la tasa de hemoglobina y/o de hematocrito, disminuir la celulitis, y/o aumentar la saciedad.
Estado de la técnica
Cada año, cerca de cientos de millones de toneladas de biomasa marina, entre los pescados, moluscos, crustáceos, etc., son explotados por el hombre alrededor del mundo. Es decir, solo menos de la mitad de esos recursos son directamente consumidos por el ser humano. Sería por lo tanto interesante poder valorizar la parte actualmente no utilizada de esos recursos, particularmente en la alimentación humana o animal.
A título de ejemplo, la sepia (sepia officinalis) es un cefalópodo cuyo crecimiento es extremadamente rápido y la duración de vida demasiado reducida.
Desde un punto de vista nutricional, la carne de la sepia tiene una relación proteína/lípidos muy elevada, un poco similar a la carne magra, lo que la hace en efecto un alimento interesante.
En Francia, la pesca de la sepia representó un poco menos de 15 mil toneladas en 2007. Estos cefalópodos son destinados principalmente a la exportación bajo forma pelada, eviscerada y congelada hacia los países mediterráneos y el Japón. La cantidad de coproductos provenientes de la transformación de los cefalópodos, como las pieles, las cabezas, las vísceras, los huesos o los cartílagos, corresponden a aproximadamente 30 o 40% del volumen de la sepia. Es por lo tanto interesante tratar de valorizar estos coproductos.
De manera general, los coproductos provenientes de la biomasa marina son generalmente dirigidos hacia la industria de alimentos para animales o la producción de aceites. La valorización de estos coproductos es un asunto de actualidad y numerosas formas de valorización quedan por explorar.
La utilización de extractos de coproductos de especies marinas que presentan complemento alimentario para post-larvas de crustáceos o juveniles de moluscos y de peces, muestran un muy fuerte potencial en la aceleración de su crecimiento y en el refuerzo de su sistema inmunitario.
El conjunto de estas investigaciones que llevan a moléculas bioactivas al seno de hidrolizados de coproductos de especies marinas muestra la presencia de moléculas con carácter de factor de crecimiento, regulador de la digestión e inmunomodulador, que tiene un importante papel que jugar en la acuacultura en los años por venir.
Paralelamente a los estudios que llevan en los extractos de estos coproductos de especies marinas, se han realizado investigaciones sobre los procedimientos de obtención de hidrolizados de los mismos.
Los procedimientos de obtención de hidrolizados de coproductos de especies marinas descritas hasta ahora no permiten obtener hidrolizados que sean utilizables para la nutrición humana.
En particular, los hidrolizados obtenidos por los procedimientos de la técnica anterior no son utilizables en nutrición humana puesto que no permiten una seguridad alimentaria suficiente para el ser humano. Además, los hidrolizados de la técnica anterior hacen llamado a sustancias no autorizadas o incluso están mal soportados por las personas que los consumen.
Por otro lado, los desacuerdos engendrados por la toma de hidrolizados de la técnica anterior no son compensados por un efecto valorizable en nutrición humana.
Existe por lo tanto una necesidad real de valorizar los coproductos de especies marinas, particularmente en nutrición humana, produciéndose la necesidad de poner a punto un procedimiento de obtención de un hidrolizado de estos productos que palien los defectos, inconvenientes y obstáculos de la técnica anterior, y permitan reducir los costos y procurar a los hidrolizados obtenidos uno o varios efectos valorizables.
Descripción de la invención
La presente invención tiene precisamente por meta resolver el conjunto de los problemas precitados, particularmente proveyendo un procedimiento de obtención de un hidrolizado de vísceras de animales marinos.
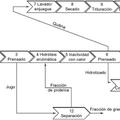
El procedimiento de la presente invención comprende las etapas siguientes:
Se entiende por "animales marinos", cualquier tipo de animales vivientes en medio acuático. Por ejemplo, los animales marinos pueden ser animales bénticos o pelágicos. Por ejemplo los animales bénticos son peces. A título de ejemplo de peces, pueden ser citados las anchoas, sardinas, bacalao, tiburones, caballa, atún. Los animales pelágicos pueden ser, por ejemplo, moluscos o crustáceos. Los moluscos pueden ser, por ejemplo, cefalópodos. Los cefalópodos pueden, por ejemplo, ser calamares, sepias o pulpos. Las gambas, cangrejos, langostas pueden ser citadas a título de ejemplo de crustáceos.
Se entiende por "coproductos", una parte o el conjunto de subproductos de animales marinos. Se trata generalmente del conjunto de partes de animales marinos que no son en general utilizados en nutrición humana, por ejemplo, cabezas, ojos, pieles, vísceras de estos animales.
Se entiende por "mezcla de coproductos de animales marinos", una mezcla de uno o varios animales marinos, idénticos o diferentes.
Se entiende por "hidrólisis enzimática", una reacción catalizada por una o varias enzimas que actúan en la escisión de un compuesto proveniente de uno o varios coproductos de animales marinos en presencia de una molécula de agua.
Los compuestos pueden ser, por ejemplo, una proteína, un glúcido, un lípido, una glicoproteína, un glicolípido, un fosfolípido, un glicerofosfolípido, un ácido graso, un polipéptido, un péptido, o cualquier otra molécula biológica o química que se encuentran en los dichos coproductos.
Las enzimas pueden ser hidrolasas, por ejemplo estearasas, peptidasas, oxidasas, lipasas o una combinación de éstas. Por ejemplo, las enzimas pueden ser escogidas en el grupo que comprende la aminopeptidasa, la betaglucosidasa, carboxipeptidasa, colesterol estearasa, amilasa, proteasa, quimotripsina, desoxirribonucleasa, lipasa, lisozima, maltasa, fosfatasa alcalina, fosfolipasa, ribonucleasa, tripsina, alcalasa, lipaina, o una combinación de éstas.
Las enzimas pueden, por ejemplo, ser enzimas endógenas, enzimas exógenas o las dos. Cuando en la hidrólisis enzimática intervienen enzimas endógenas únicamente, se habla entonces "de autolisis". Las enzimas endógenas provienen de los coproductos de animales marinos utilizados como sustrato en el procedimiento de la presente invención.
Se entiende por "hidrolizado", el o los productos provenientes de la etapa (d) de la hidrólisis enzimática.
Ventajosamente, la etapa (a) del procedimiento de la presente invención conduce a suministrar una mezcla homogénea. Preferiblemente, la mezcla se efectuó durante una duración que va de 5 a 30 minutos.
La etapa (a) puede comprender además una etapa de trituración de vísceras. Esta etapa complementaria... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento de obtención de un hidrolizado de vísceras de animales marinos que comprenden las siguientes etapas:
(a) mezcla de coproductos de animales marinos,
(b) calentamiento de la mezcla obtenida en la etapa (a) a una temperatura que va de 30 a 65ºC,
(c) ajuste del pH de la mezcla obtenida en la etapa (b) a un valor que va de 1 a 8,
(d) hidrolizado enzimático de la mezcla obtenida en la etapa (c) durante una duración que va de 1 a 8 horas,
(e) calentamiento del hidrolizado obtenido en la etapa (d) a una temperatura que va de 75 a 150ºC, y
(f) enfriamiento del hidrolizado obtenido.
2. Procedimiento según la reivindicación 1, en la cual los animales marinos son cefalópodos.
3. Procedimiento según la reivindicación 1 o 2, en la cual la etapa (a) comprende además una etapa de dilución de la mezcla de vísceras de animales marinos con agua.
4. Procedimiento según la reivindicación 3, en la cual la dilución se opera en una relación agua/mezcla de vísceras de animales marinos que van de 0,5 a 3.
5. Procedimiento según una cualquiera de las reivindicaciones 1 a 4, en la cual el pH se ajusta a un valor que va de 2 a 6.
6. Procedimiento según una cualquiera de las reivindicaciones 1 a 5, en la cual la etapa de hidrólisis (d) se realiza durante una duración de 3 horas.
7. Procedimiento según una cualquiera de las reivindicaciones 1 a 6, que comprende además una etapa de recubrimiento/gelación de hidrolizado obtenido en la etapa (e) con polisacáridos.
8. Procedimiento según una cualquiera de las reivindicaciones 1 a 7, que comprende además una etapa (g) de secado, sucesivo a la etapa (f).
9. Hidrolizado susceptible de ser obtenido por el procedimiento según una cualquiera de las reivindicaciones 1 a 8.
10. Hidrolizado según la reivindicación 9, que comprende 70% en peso de proteínas cuyo peso molecular es inferior a 4,4 kDa.
11. Hidrolizado según la reivindicación 9 o 10, que comprende además 2.3% de taurina.
12. Utilización del hidrolizado según una cualquiera de las reivindicaciones 9 a 11, para fabricar medicamento, alimento o aditivo o complemento alimentario destinado a frenar o detener los procesos de degeneración muscular, fomentar el desarrollo muscular, disminuir la masa grasa en beneficio de la masa seca, luchar contra patologías musculares. Disminuir la absorción de nutrientes a nivel intestinal, reforzar el sistema inmunitario, aumentar la tasa de hemoglobina y/o de hematocrito, disminuir la celulitis, y/o aumentar la saciedad.
Patentes similares o relacionadas:
 Quitina, hidrolizado y procedimiento para la producción de uno o más productos de interés a partir de insectos mediante
hidrólisis enzimática, del 29 de Julio de 2020, de Ynsect: Hidrolizado preparado a partir de insectos, que comprende al menos 40 % en peso de proteínas sobre el peso total de materia seca, un contenido […]
Quitina, hidrolizado y procedimiento para la producción de uno o más productos de interés a partir de insectos mediante
hidrólisis enzimática, del 29 de Julio de 2020, de Ynsect: Hidrolizado preparado a partir de insectos, que comprende al menos 40 % en peso de proteínas sobre el peso total de materia seca, un contenido […]
 Procedimiento de fermentación de alimentación discontinua de alta densidad celular para producir proteínas recombinantes, del 25 de Marzo de 2020, de WYETH LLC: Un procedimiento de producción de una proteína recombinante que comprende:
cultivar una célula bacteriana recombinante para expresar una proteína recombinante […]
Procedimiento de fermentación de alimentación discontinua de alta densidad celular para producir proteínas recombinantes, del 25 de Marzo de 2020, de WYETH LLC: Un procedimiento de producción de una proteína recombinante que comprende:
cultivar una célula bacteriana recombinante para expresar una proteína recombinante […]
Uso de tripeptidil peptidasas tolerantes a la prolina en composiciones de aditivo para piensos, del 26 de Febrero de 2020, de Dupont Nutrition Biosciences ApS: Un método para preparar una composición de aditivo para piensos que comprende: mezclar al menos una tripeptidil peptidasa tolerante a la prolina que tiene […]
Enzimas específicas de sitio y métodos de uso, del 19 de Febrero de 2020, de Poseida Therapeutics, Inc: Un polipéptido que comprende al menos una secuencia de aminoácidos que tiene la secuencia de LSTEQVVAIASX1X2GGKQALEAVKAQLLVLRAAPYE (SEQ ID NO: 1), en donde […]
Composiciones para unir módulos de dedos de cinc, del 15 de Enero de 2020, de Sangamo Therapeutics, Inc: Una proteína de dedos de cinc de múltiples dedos que se une específicamente a un sitio diana, comprendiendo la proteína de dedos de cinc de […]
Concentrado de proteínas de granos que contienen almidón: composición, método de fabricación y usos del mismo, del 1 de Enero de 2020, de THE UNITED STATES OF AMERICA AS REPRESENTED BY THE SECRETARY OF AGRICULTURE: Un proceso para producir un concentrado de proteinas a partir de un grano o semilla oleaginosa que contiene almidon, el proceso comprende: (i) moler el […]
 Terapia de ARNm para el tratamiento de enfermedades oculares, del 25 de Diciembre de 2019, de Translate Bio, Inc: Una composición que comprende un ARNm que codifica un péptido o polipéptido terapéutico para su uso en el tratamiento de una enfermedad, trastorno o afección ocular en un […]
Terapia de ARNm para el tratamiento de enfermedades oculares, del 25 de Diciembre de 2019, de Translate Bio, Inc: Una composición que comprende un ARNm que codifica un péptido o polipéptido terapéutico para su uso en el tratamiento de una enfermedad, trastorno o afección ocular en un […]
 Purificación de proteínas con prefiltrado, del 27 de Noviembre de 2019, de EMD Millipore Corporation: Un método para eliminar constituyentes de unión no específica de una corriente que contiene proteínas que comprende:
hacer fluir la corriente que contiene proteínas […]
Purificación de proteínas con prefiltrado, del 27 de Noviembre de 2019, de EMD Millipore Corporation: Un método para eliminar constituyentes de unión no específica de una corriente que contiene proteínas que comprende:
hacer fluir la corriente que contiene proteínas […]