Producción del péptido 2 de tipo glucagón y análogos.
Un multímero proteico de cadena sencilla que comprende al menos dos unidades del péptido GLP-2 acopladas en tándem por un conector que proporciona en el multímero un sitio de escisión con ácido en su extremo N,
y un sitio de escisión con enzima en su extremo C, donde la escisión de dicho multímero con un ácido y una enzima libera dichas unidades del péptido GLP-2, teniendo cada una residuos N y C terminales auténticos y donde el sitio de escisión con ácido tiene la secuencia Asp-Pro y el sitio de escisión con enzima se selecciona entre el sitio de escisión con enteroquinasa que tiene la secuencia Asp-Asp-Asp-Asp-Lys, un sitio de escisión con Factor Xa que tiene la secuencia Ile-Glu-Gly-Arg y un sitio de escisión con trombina que tiene la secuencia Val-Ser-Gly-Pro-Arg.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2004/004439.
Solicitante: NPS PHARMACEUTICALS, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 550 HILLS DRIVE, 3RD FLOOR BEDMINSTER NJ 07921 ESTADOS UNIDOS DE AMERICA.
Inventor/es: SASAKI,KEN, WILLIAMSON,Vanessa Jane, ARAUJO,Alberto de, WALCZYK,Ewa.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/26 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Glucagón.
- C07K14/605 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Glucagones.
- C12N1/21 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12N15/16 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Hormonas.
- C12N15/74 C12N 15/00 […] › Vectores o sistemas de expresión especialmente adaptados a huéspedes procariotas distintos a E. coli, p. ej. Lactobacillus, Micromonospora.
- C12P21/02 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › que tienen una secuencia conocida de varios aminoácidos, p. ej. glutation.
PDF original: ES-2380765_T3.pdf
Fragmento de la descripción:
Producción del péptido 2 de tipo glucagón y análogos Campo de la Invención Esta invención aplica la técnica de la biología molecular en el campo de la producción de proteínas. Más concretamente, la invención se refiere a la producción del péptido 2 de tipo glucagón recombinante, o GLP-2, y sus análogos.
Antecedentes de la Invención
El GLP-2 es un producto de 33 aminoácidos del gen del proglucagón. La evidencia reciente indica que el GLP-2 promueve la absorción de nutrientes a través de la expansión del epitelio de la mucosa mediante la estimulación de la proliferación de las células de las criptas y la inhibición de la apoptosis en el intestino delgado. El GLP-2 también reduce la permeabilidad epitelial, y disminuye la secreción de ácido gástrico y la motilidad gastrointestinal estimuladas por la comida. Muchos de estos efectos han sido atribuidos no solamente al péptido de tipo salvaje, sino también a sus análogos, incluyendo particularmente aquellos que se vuelven resistentes a la digestión por parte de las enzimas del suero, tales como DPP-IV, mediante la sustitución de la alanina residente en la posición 2 por glicina, por ejemplo. Se describen una variedad de análogos de GLP-2 bioactivos, por ejemplo, en la Patente de los Estados Unidos Núm. 5.789.379.
Con el reciente reconocimiento de sus propiedades farmacéuticas, existe una demanda de grandes cantidades de GLP-2 y análogos del mismo para permitir el desarrollo y el posterior uso médico de estos productos. Los métodos sintéticos en fase sólida o en fase de solución han sido empleados típicamente para producir las cantidades para investigación de GLP-2 y análogos utilizados hasta la fecha. La producción de GLP-2 como producto recombinante de anfitriones diseñados por ingeniería genética ha sido sugerida, por ejemplo en las Patentes de los Estados Unidos Núms. 5.789.379 y 6.287.806, y se describen en la Patente de los Estados unidos Núm. 5.629.205. No obstante, los sistemas de producción de la técnica anterior tienen limitaciones en términos de rendimiento y calidad del producto, y sería deseable proporcionar un sistema que produzca péptido GLP-2 de calidad con un coste eficaz.
El documento WO 99/64611 A1 describe multímeros de péptidos antimicrobianos que son expresados con un compañero de fusión del gen purF. El gen que codifica el péptido se repite y se transcribe en un único ARNm, pero el producto de expresión del gen no está conectado. Por lo tanto, el ARNm es traducido en muchas copias separadas del producto proteico.
Los documentos WO 03/099848 A2 y WO 03/099854 A2 describen ambos un método de producción de polipéptidos de copia sencilla o de múltiples copias por medio de escisión con clostripaína a partir de una molécula precursora. La escisión específica de la proteína de fusión se logra seleccionando los aminoácidos que flanquean el sitio de escisión, evitando de ese modo la escisión dentro del péptido deseado.
Lidell et al. (2003) J. Biol. Chem. 278 (16) : 13954-13951) describen la escisión autocatalítica de la mucina MUC2 en un enlace Asp-Pro a un pH inferior a 6, 0.
El documento WO 03/10022 A2 describe un polipéptido en tándem que consiste en un compañero de fusión de un cuerpo de inclusión y un polipéptido preseleccionado cuyo polipéptido en tándem forma un cuerpo de inclusión que permite la producción y la purificación del polipéptido deseado.
Por consiguiente un objeto de la presente invención es proporcionar un procedimiento, y los intermedios y reactivos útiles en él, por medio del cual se puedan producir cantidades comerciales de GLP-2.
Otro objeto de la presente invención es proporcionar GLP-2 y análogos del mismo, concretamente el análogo [Gly2]hGLP-2, en una forma auténtica estructuralmente.
Compendio de la Invención De acuerdo con la presente invención, se proporciona un procedimiento por medio del cual se producen GLP-2 y sus análogos no solamente con un rendimiento relativamente elevado, sino también como productos estructuralmente auténticos, que comprenden solamente la forma natural de los aminoácidos de origen natural en la secuencia que constituye el péptido GLP-2. Preferiblemente, los residuos N-y C-terminales son "auténticos terminalmente". En particular, el presente procedimiento produce el GLP-2 deseado en forma de péptido que tiene residuos N- y Cterminales que están sin aminoácidos residuales y otros radicales químicos que a menudo resultan de los métodos recombinantes de la producción de proteínas, concretamente aquellos que dependen de la producción de la proteína como un precursor fusionado a partir del cual debe ser liberada la proteína diana.
Más concretamente, y de acuerdo con un aspecto de la presente invención, se proporciona un precursor polipeptídico de cadena sencilla en el cual dos o más copias del péptido GLP-2 están acopladas en tándem por medio de un conector que es escindible para liberar cada unidad del péptido GLP-2 en forma de un producto que tiene extremos N y C auténticos. Los péptidos GLP-2 se acoplan utilizando un conector que presenta sitios de escisión en cada uno de sus flancos. El conector presenta un sitio de escisión con ácido en un flanco, y un sitio de escisión con enzima en su otro flanco.
En otro aspecto, la presente invención proporciona un método para producir un péptido GLP-2 que tiene extremos N y C auténticos, en el que el presente multímero del péptido GLP-2 es escindido para liberar cada unidad del péptido GLP-2 residente en él.
En otros aspectos de la presente invención, se proporcionan adicionalmente polinucleótidos útiles en la producción de tales precursores de péptido GLP-2 multimérico.
Tanto la descripción general anterior como la breve descripción de los dibujos y la descripción detallada siguientes son ilustrativas y explicativas y se pretende que proporcionen una explicación adicional de la invención reivindicada. Otros objetos, ventajas, y características novedosas serán fácilmente evidentes para los expertos en la técnica a partir de la siguiente descripción detallada de la invención.
Breve Referencia a los Dibujos La Figura 1 ilustra la construcción basada en la PCR de un gen que codifica una unidad de [Gly2]hGLP-2 flanqueada por un sitio de escisión con trombina y un sitio de escisión con ácido;
La Figura 2 ilustra la secuencia de ADN esperada del producto de la amplificación de la Figura 1. La secuencia de la unidad de [Gly2]hGLP-2 está subrayada;
La Figura 3 es un mapa plasmídico de pKS58 que porta un gen que codifica un hexámero de [Gly2]hGLP-2;
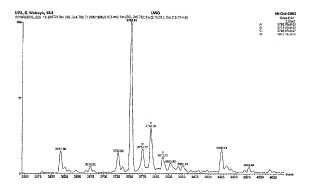
La Figura 4 proporciona la secuencia de nucleótidos de pKS58, que porta un constructo que codifica un hexámero de [Gly2]hGLP-2, donde la secuencia de aminoácidos también es ilustrada, mostrando las unidades del péptido GLP2 en negrita; y La Figura 5 proporciona un análisis espectrométrico de masas de un péptido GLP-2 producido como se describe en la presente memoria.
Descripción Detallada de la Invención En un aspecto, la presente invención proporciona un constructo genético, en forma de un polinucleótido, adaptado para producir el péptido GLP-2 en forma de un precursor multimérico, de cadena sencilla que comprende al menos dos copias de un péptido GLP-2. Cada uno de tales péptidos está acoplado al siguiente por medio de un conector que tiene flancos que presentan sitios de escisión que permiten la liberación de los péptidos GLP-2 en forma de monómeros que tienen extremos N y C que son auténticos, y de este modo están esencialmente libres de residuos químicos que se originan a partir del conector o del procedimiento de escisión. En cuanto al producto recombinante, el péptido GLP-2 resultante también está libre de radicales químicos tales como grupos bloqueadores utilizados en la síntesis de péptidos en fase de solución y sólida.
En la presente invención, las unidades del péptido GLP-2 dentro del multímero están acopladas utilizando un conector que presenta sitios de escisión en los extremos N y C de las unidades del péptido GLP-2 residentes. Estos sitios, y los agentes utilizados para escindirlos, se seleccionan de manera que el péptido GLP-2 permanezca intacto durante el procedimiento de escisión, para que así el aislamiento y la purificación produzcan un péptido GLP-2 que tenga los residuos N- y C-terminales deseados sin ningún requerimiento de procesamiento adicional.
En una realización preferida de la presente invención,... [Seguir leyendo]
Reivindicaciones:
1. Un multímero proteico de cadena sencilla que comprende al menos dos unidades del péptido GLP-2 acopladas en tándem por un conector que proporciona en el multímero un sitio de escisión con ácido en su extremo N, y un sitio de escisión con enzima en su extremo C, donde la escisión de dicho multímero con un ácido y una enzima libera dichas unidades del péptido GLP-2, teniendo cada una residuos N y C terminales auténticos y donde el sitio de escisión con ácido tiene la secuencia Asp-Pro y el sitio de escisión con enzima se selecciona entre el sitio de escisión con enteroquinasa que tiene la secuencia Asp-Asp-Asp-Asp-Lys, un sitio de escisión con Factor Xa que tiene la secuencia Ile-Glu-Gly-Arg y un sitio de escisión con trombina que tiene la secuencia Val-Ser-Gly-Pro-Arg.
2. Un multímero proteico de cadena sencilla de acuerdo con la reivindicación 1, donde dicho conector consiste en no más de 25 residuos, menos de 20 residuos, menos de 15 residuos, o menos de 10 residuos.
3. Un multímero proteico de cadena sencilla de acuerdo con la reivindicación 1 o 2, donde dicho conector tiene la secuencia ProValSerGlyProArg.
4. Un multímero proteico de cadena sencilla de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde dicho péptido GLP-2 es [Gly2]hGLP-2.
5. Un multímero proteico de cadena sencilla de acuerdo con una cualquiera de las reivindicaciones 1 a 4, que comprende adicionalmente un péptido portador acoplado liberablemente al extremo N del mismo, proporcionando el péptido portador un residuo de Met en su extremo N y, en su extremo C, un sitio escindible por dicha enzima.
6. Un multímero proteico de cadena sencilla de acuerdo con una cualquiera de las reivindicaciones 1 a 5, que comprende adicionalmente un péptido de prolongación C-terminal.
7. Un procedimiento para preparar un multímero de acuerdo con una cualquiera de las reivindicaciones 1 a 6, que comprende la etapa de cultivar un anfitrión celular que incorpora un constructo de expresión en el que una molécula de ADN que codifica dicho multímero se conecta operablemente con ADN proporcionando la expresión del mismo.
8. El procedimiento de acuerdo con la reivindicación 7, donde dicho anfitrión en un anfitrión E. coli .
9. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 7 u 8, donde el constructo de expresión comprende adicionalmente el promotor del bacteriófago T7.
10. Un polinucleótido que codifica el multímero de acuerdo con una cualquiera de las reivindicaciones 1-6.
11. Un procedimiento para preparar un péptido GLP-2, que comprende las etapas de obtener un multímero de acuerdo con una cualquiera de las reivindicaciones 1 a 6, tratar el multímero con ácido y con enzima para escindir el conector residente allí, y a continuación aislar las unidades de péptido GLP-2 resultantes.
12. El procedimiento de acuerdo con la reivindicación 11, donde el multímero se escinde en primer lugar con ácido, el multímero escindido resultante es aislado y después escindido con enzima, y a continuación se aíslan las unidades de péptido GLP-2 resultantes que tienen extremos auténticos.
13. El procedimiento de acuerdo con la reivindicación 12, donde la etapa de escisión con ácido se realiza en el momento de extraer el multímero del péptido GLP-2 del anfitrión celular que produce dicho multímero.
14. El procedimiento de acuerdo con la reivindicación 11, donde la etapa de tratamiento del multímero con ácido y con enzima se realiza sin separación de los productos de reacción antes del tratamiento con enzima.
Patentes similares o relacionadas:
Sistema de expresión bacteriano cistrónico doble, del 25 de Marzo de 2020, de LUPIN LIMITED: Un procedimiento para la producción de un anticuerpo o un fragmento del mismo que comprende las etapas de: (i) transformar una célula hospedadora bacteriana […]
Partículas de transducción no replicativas y sistemas indicadores basados en partículas de transducción, del 15 de Enero de 2020, de Geneweave Biosciences Inc: Un sistema de empaquetamiento de células bacterianas para empaquetar una molécula de ácido nucleico indicadora en una partícula de transducción no replicativa (NRTP) para su introducción […]
Método de construcción de biblioteca de péptidos y vectores relacionados, del 1 de Enero de 2020, de Hunan Zonsen Peplib Biotech Co., Ltd: Método integrado de construcción de una biblioteca de péptidos completa que contiene todos los péptidos posibles para el tamaño específico, comprendiendo el método: (i) […]
 Producción recombinante de péptidos, del 25 de Septiembre de 2019, de BASF SE: Proteina precursora que comprende una secuencia repetitiva escindible de elementos de peptido (Pep) deseados y elementos de peptido auxiliar […]
Producción recombinante de péptidos, del 25 de Septiembre de 2019, de BASF SE: Proteina precursora que comprende una secuencia repetitiva escindible de elementos de peptido (Pep) deseados y elementos de peptido auxiliar […]
Transporte de proteínas basado en bacterias, del 14 de Agosto de 2019, de Universität Basel: Un vector que comprende, en la dirección 5' a 3': un promotor; una primera secuencia de ADN que codifica una señal de transporte procedente […]
Sistema de expresión y secreción, del 26 de Junio de 2019, de F. HOFFMANN-LA ROCHE AG: Una molécula de ácido nucleico que codifica un primer polipéptido y un segundo polipéptido, enlazada de forma funcional a una secuencia señal que codifica […]
 Producción de anticuerpos híbridos que contienen regiones variables humanas y regiones constantes de roedor, del 26 de Junio de 2019, de REGENERON PHARMACEUTICALS, INC.: Un procedimiento para modificar genéticamente un locus génico endógeno de la región variable de cadena pesada de inmunoglobulina en una célula madre embrionaria (ES) de […]
Producción de anticuerpos híbridos que contienen regiones variables humanas y regiones constantes de roedor, del 26 de Junio de 2019, de REGENERON PHARMACEUTICALS, INC.: Un procedimiento para modificar genéticamente un locus génico endógeno de la región variable de cadena pesada de inmunoglobulina en una célula madre embrionaria (ES) de […]
Síntesis microbiana de aldehídos y alcoholes correspondientes, del 17 de Junio de 2019, de Easel Biotechnologies, LLC: Un método para producir un alcohol, que comprende: cultivar una pluralidad de células microbianas en un medio de fermentación, en donde las […]