PROCESO PARA LA PREPARACION DE AMINAS QUIRALES OPTICAMENTE ACTIVAS.
Un proceso para la preparación de una amina quiral ópticamente activa y piruvato como subproducto alfa-cetona que comprende:
a) proporcionar un aceptor amino y alanina como donante amino, b) hacer reaccionar el aceptor amino y el donante amino con una transaminasa selectiva de (R) o (S), c) obtener la amina quiral ópticamente activa deseada y piruvato como subproducto alfa-cetona y d) eliminar el piruvato de la mezcla de reacción con una descarboxilasa
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/001222.
Solicitante: LONZA AG.
Nacionalidad solicitante: Suiza.
Dirección: LONZASTRASSE,3930 VISP.
Inventor/es: BORNSCHEUER, UWE, HOHNE, MATTHIAS, ROBINS, KAREN.
Fecha de Publicación: .
Fecha Concesión Europea: 26 de Mayo de 2010.
Clasificación Internacional de Patentes:
- C12P13/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › Preparación de compuestos orgánicos que contienen nitrógeno.
Clasificación PCT:
- C12P13/00 C12P […] › Preparación de compuestos orgánicos que contienen nitrógeno.
- C12P17/10 C12P […] › C12P 17/00 Preparación de compuestos heterocíclicos que contienen O, N, S, Se o Te como únicos heteroátomos del ciclo (C12P 13/04 - C12P 13/24 tienen prioridad). › nitrógeno como único heteroátomo del ciclo.
Fragmento de la descripción:
Proceso para la preparación de aminas quirales ópticamente activas.
La presente invención está relacionada con un proceso para la preparación de aminas quirales ópticamente activas.
Las aminas quirales tienen un papel importante en la industria farmacéutica, agroquímica y química. Frecuentemente se utilizan como intermediarios o sintones para la preparación de varias sustancias fisiológicamente activas, por ejemplo farmacéuticamente activas, como derivados de la cefalosporina o pirrolidina. En un gran número de las diferentes aplicaciones de las aminas quirales, sólo una forma ópticamente activa concreta, el enantiómero (R) o el (S) posee la actividad fisiológica deseada. Por lo tanto, existe la clara necesidad de proporcionar procesos para la preparación de aminas quirales en forma ópticamente activa.
Estas necesidades se cubren parcialmente preparando aminas quirales mediante cristalización de sales diastereoméricas mediante la adición de ácidos carboxílicas quirales (Breuer et al., Angewandte Chemie (2004) 116, 806-843). Otros métodos químicos utilizan la síntesis enantioselectiva mediante la reducción de precursores proquirales con dobles enlaces C=N.
Además, es conocida la escisión estereoselectiva de racematos utilizando varias enzimas, como proteasas, amidasas o lipasas (Bornscheuer y Kazlauskas, Hydrolases in Organic Synthesis (2005), Wiley-VCH Weinheim). También es conocido que las transaminasas específicas, es decir a-transaminasas, lo que incluye las aminotransferasas de a-aminoácidos, son adecuadas para la preparación de aminoácidos ópticamente puros (Bartsch et al., Appl. Environm. Microbiol. (1996) 62, 3794-3799, Cho et al., Biotechnol. Bioeng. (2003) 83, 226-234, JP 011 53084 A2 (1998), JP 633 04986 A2 (1988), PE 0 248 357 A2 y Ziehr et al., Biotechnol. Bioeng. (1987) 29, 482-487).
Shin y Kim (Biotechnology and Bioengineering, 1999, 65 (2), 206-211) describen un proceso para la síntesis asimétrica de aminas quirales con una ?-transaminasa (Vibrio fluvialis JS17).
Hwang y Kim (Enzyme and Microbial Technology, 2004, 34, 429-436) describen un proceso para producir aminas quirales ópticamente activas mediante la reacción de un aceptor amino y un donante amino en presencia de una ?-transaminasa.
Cho et al. (Biotechnology and Bioengineering, 2003, 81 (7), 783-789) describen una síntesis simultanea de un (S)-aminoácido enantioméricamente puro y (R)-aminas utilizando reacciones transaminasa acopladas.
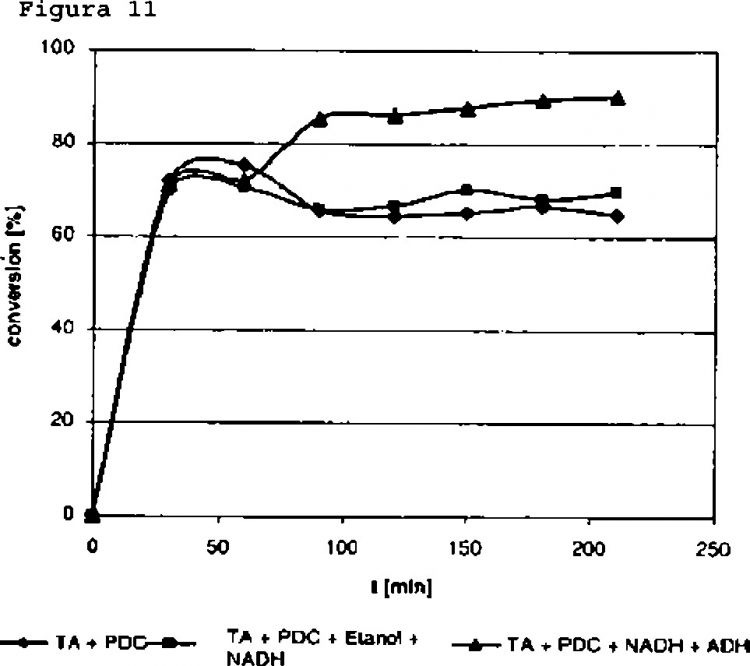
Sin embargo, estos procesos anteriores poseen varias desventajas. Aunque los procesos enzimáticos habitualmente utilizan unas condiciones moderadas favorables, al contrario que los métodos clásicos, y consiguen una estereoselectividad razonable, estos utilizan regularmente enzimas, cuya especificidad de substrato, enantioselectividad y/o tasas de conversión no son suficientemente elevadas para aplicarse a procesos industriales. Además, una de las desventajas más importantes de utilizar transaminasas para la preparación de aminas ópticamente activas la representa el fenómeno frecuentemente observado de inhibición del sustrato y el producto. Por lo tanto es uno de los objetivos de la presente invención proporcionar un proceso mejorado para preparar aminas quirales ópticamente activas, en particular un proceso con una especificidad de sustrato mejorada, una enantioselectividad mejorada y en particular que permite una conversión de los eductos de hasta el 100%.
La presente invención soluciona los problemas técnicos subyacente a la presente invención al proporcionar un proceso para la preparación de una amina quiral ópticamente activa y piruvato como subproducto a-cetona que comprende a) proporcionar un aceptor amino y alanina como donante amino, b) hacer reaccionar el aceptor amino y el donante amino con una transaminasa selectiva de (R) o (S), c) obtener la amina quiral ópticamente activa deseada y piruvato como un subproducto a-cetona y d) eliminar el piruvato de la mezcla de reacción con una descarboxilasa. De acuerdo con una realización preferible de la presente invención, en un paso subsiguiente adicional opcional del proceso, la amina quiral ópticamente activa obtenida en los pasos c) y d) se aísla y purifica a partir de la mezcla de reacción obtenida en los pasos c) y d).
La reacción de la presente invención sigue el principio del siguiente esquema:
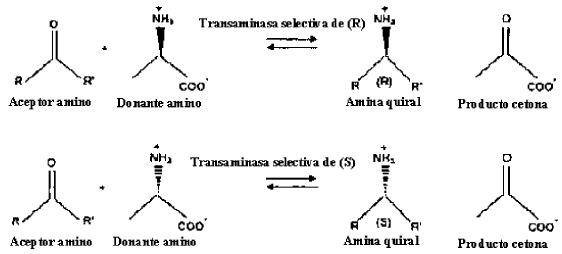
Por lo tanto, la presente invención proporciona un proceso para la síntesis asimétrica de aminas quirales mediante la utilización de al menos una transaminasa para la transaminación de un grupo amino a partir de alanina como donante amino a un aceptor amino, formándose así el producto deseado. Dependiendo de la preferencia de enantiómero de la transaminasa específica utilizada, se obtiene una amina quiral ópticamente activa de la configuración óptica deseada, es decir el enantiómero (R) o (S). Por lo tanto, utilizar en una realización de la presente invención una transaminasa selectiva de (S) para la síntesis asimétrica genera el enantiómero (S) deseado de la amina quiral mientras utilizar en otra realización de la presente invención una transaminasa selectiva de (R) genera el enantiómero (R) deseado. Además de las aminas activas ópticamente deseadas, la reacción resulta en piruvato como un subproducto a-cetona a partir del donante amino utilizado y posiblemente del aceptor amino y donante amino no convertidos.
En el contexto de la presente invención, una transaminasa es una enzima dependiente de piridoxalfosfato que cataliza la transferencia de grupos amino. Las transaminasas se clasifican como E.C. 2.6.1.X. En una realización particularmente preferible de la presente invención, la transaminasa es una transaminasa selectiva de (R) o (S), en particular en una realización preferible es una ?-transaminasa.
En el contexto de la presente invención una ?-transaminasa es una enzima preferiblemente con el código de clasificación E.C.2.6.1.18. Estas aminotransaminasas se caracterizan porque utilizan principalmente aminas como sustratos. Estas enzimas también se caracterizan por mostrar una constante de equilibrio de las reacciones catalizadas por ?-transaminasas que es superior a 1. Las ?-transaminasas que pueden utilizarse de acuerdo con la presente invención se describen por ejemplo en Iwasaki et al., Biotechnol. Lett. (2003) 25, 1843-1846, Shin et al., Biotechnol. Bioeng. (1997) 55, 348-358, Shin y Kim, Book of Abstracts, 217th ACS National Meeting, Anaheim, Calif., March 21-25, (1999) 180, Shin y Kim, Biosc. Biotechnol. Biochem. (2001) 65, 1782-1788 y Shin y Kim, Biotechnol. Bioeng. (1998) 60, 534-540.
Por lo tanto, en una realización preferible de la presente invención, la transaminasa selectiva de (R) o (S), en particular la ?-transaminasa selectiva de (R) o (S) utilizada en el presente proceso es una transaminasa selectiva de (R) o (S), en particular una ?-transaminasa selectiva de (R) o (S) obtenida de Vibrio fluvialis, en particular a partir de la cepa JS17. En una realización más preferible, la transaminasa selectiva de (R) o (S) es de Alcaligenes denitrificans, en particular de la cepa Y2k-2. En una realización más preferible, la transaminasa selectiva de (R) o (S) es de Klebsiella pneumoniae, en particular de la cepa YS2F. En una realización más preferible, la transaminasa selectiva de (R) o (S) es de Bacillus thuringiensis, en particular de la cepa JS64. Para la nomenclatura de las cepas véase Shin y Kim, 1998, mencionado anteriormente. Por supuesto, la presente invención también incluye bajo el término transaminasa selectiva de (R) o (S), y en particular ?-transaminasa selectiva de (R) o (S), un extracto de un organismo, como un microorganismo o una célula, que contiene una transaminasa selectiva de (R) o (S), en particular una ?-transaminasa selectiva de (R) o (S), o una célula o microorganismo vivo o muerto que comprende por sí mismo una transaminasa selectiva de (R) o (S), en particular una ?-transaminasa selectiva de (R) o (S). Tal microorganismo o célula o extracto o enzima transaminasa selectiva de (R) o (S) puede utilizarse en forma inmovilizada o no inmovilizada. La transaminasa selectiva de (R) o (S), en particular la ?-transaminasa selectiva de (R) o (S), puede ser también una transaminasa selectiva de (R) o (S) obtenida de forma recombinante, o de aparición natural o modificada genéticamente, en particular una ?-transaminasa selectiva de (R) o (S), que está codificada parcialmente o completamente...
Reivindicaciones:
1. Un proceso para la preparación de una amina quiral ópticamente activa y piruvato como subproducto alfa-cetona que comprende: a) proporcionar un aceptor amino y alanina como donante amino, b) hacer reaccionar el aceptor amino y el donante amino con una transaminasa selectiva de (R) o (S), c) obtener la amina quiral ópticamente activa deseada y piruvato como subproducto alfa-cetona y d) eliminar el piruvato de la mezcla de reacción con una descarboxilasa.
2. El proceso de acuerdo con la reivindicación 1, en el que la descarboxilasa es una descarboxilasa de piruvato (PDC).
3. El proceso de acuerdo con la reivindicación 2, en el que el acetaldehído formado por acción de la PDC se elimina.
4. El proceso de acuerdo con la reivindicación 3, en el que el acetaldehído se elimina mediante su reacción con al menos una enzima.
5. El proceso de acuerdo con la reivindicación 4, en el que la enzima es una alcohol deshidrogenasa.
6. El proceso de acuerdo con la reivindicación 3, en el que el acetaldehído se elimina alimentando con nitrógeno gaseoso la mezcla de reacción.
7. El proceso de acuerdo con la reivindicación 3, en el que el acetaldehído se elimina aplicando una presión reducida a la mezcla de reacción.
8. El proceso de acuerdo con la reivindicación 3, en el que el acetaldehído se elimina mediante métodos químicos.
9. El proceso de acuerdo con cualquiera de las reivindicaciones precedentes, en el que el aceptor amino se selecciona de entre el grupo que consiste en ácido fenilpirúvico, una sal del mismo, ácido pirúvico, una sal del mismo, acetofenona, 2-cetoglutarato, 3-oxobutirato, 2-butanona, 3-oxopirrolidina (3-OP), 3-piridilmetilcetona (3-PMK), éster etílico del ácido 3-oxobutírico (3-OBEE), éster metílico del ácido 3-oxopentanoico (3-OPME), N-1-boc-3-oxopiperidinona, N-1-boc-3-oxopirrolidina (B30P), 3-oxo-piperidina, alquil-3-oxo-butonoatos, metoxiacetona y 1-oxotetralona.
10. El proceso de acuerdo con cualquiera de las reivindicaciones precedentes, en el que las aminas obtenidas son aminas monocíclicas o bicíclicas, en particular aminas cíclicas de 5 a 6 miembros o hidrocarburos heterocíclicos S-, O- o N-sustituidas o aminas aromáticas, en particular aminas aromáticas sustituidas con alquilo o alcoxi.
11. El proceso de acuerdo con cualquiera de las reivindicaciones precedentes, en el que las aminas obtenidas se seleccionan de entre el grupo que consiste en fenilalanina, alanina, 3-aminopiperidina, alquil-3-amino-buta-noatos, 3-aminopirrolidina (3-AP), 3-piridil-1-etilamina (3-PEA), N-1-boc-3-aminopirrolidina (B3AP), éster etílico del ácido 3-aminobutírico (3-ABEE), éster metílico del ácido 3-aminopentanoico (3-APME), a-metilbencilamina (a-MBA), 1-aminotetralina, a-metil-4-(3-piridil)-butanamina, glutamato, ß-aminobutirato, sec-butilamina, metoxiisopropilamina, derivados de 3-aminopirrolidina, 1-N-boc-3-aminopiperidina, cefalosporina y derivados de cefalosporina.
12. El proceso de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la ?-transaminasa es de Vibrio fluvialis, Alcaligenes denitrificans, Klebsiella pneumoniae o Bacillus thuringiensis.
13. El proceso de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la amina quiral ópticamente activa obtenida en los pasos c) o d) se elimina de la mezcla de reacción.
14. El proceso de acuerdo con cualquiera de las reivindicaciones precedentes, en el que el proceso se realiza en una mezcla de reacción con un pH de 5,0 a 9,5.
15. El proceso de acuerdo con cualquiera de las reivindicaciones precedentes, en el que el proceso se realiza durante un tiempo de reacción de 40 a 70 minutos.
16. El proceso de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la reacción se realiza en presencia de al menos una descarboxilasa de piruvato y al menos una alcohol deshidrogenasa.
17. El proceso de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la reacción se realiza en presencia de al menos una descarboxilasa de piruvato, al menos una alcohol deshidrogenasa y adicionalmente en presencia de nitrógeno gaseoso (N2).
18. Un proceso para la preparación de un compuesto fisiológicamente activo seleccionado de entre el grupo de los derivados de 3-aminopirrolidona, cefalosporina, derivados de cefalosporina, ácidos borónicos heterocíclicos, L-dihidroxifenilalanina (LDopa), a-metildopa, D-fenilglicina, ß-hidroxifenilglicina, fosfinotricina, derivados pirimido y derivados pirrolidona, en el que se utiliza el proceso de cualquiera de las reivindicaciones de 1 a 17.
Patentes similares o relacionadas:
Procedimiento de preparación de aminas a partir de compuestos de carbonilo mediante reacción de transaminasa bajo precipitación de sal, del 10 de Junio de 2020, de Enzymicals AG: Procedimiento de preparación de un compuesto de sal amino que comprende: i) proporcionar un compuesto de carbonilo de fórmula general (I) **(Ver fórmula)** […]
Producción de anilina a través de antranilato, del 13 de Mayo de 2020, de Covestro Intellectual Property GmbH & Co. KG: Un procedimiento para la producción de anilina, que comprende las etapas de: a) proporcionar o-aminobenzoato, en el que dicho o-aminobenzoato comprende […]
Procedimiento de purificación de 1,5-diaminopentano, del 6 de Mayo de 2020, de CJ CHEILJEDANG CORP.: Un procedimiento de refinación de 1,5-diaminopentano, comprendiendo el procedimiento: concentrar un caldo de fermentación que incluye un carbonato de 1,5-diaminopentano; […]
Proceso para la preparación de una amina quiral ópticamente activa, del 27 de Noviembre de 2019, de LONZA AG: Un proceso para la preparación de una amina quiral ópticamente activa que comprende: a) proporcionar un aceptor de amino y un dador de amino, b) hacer reaccionar el […]
Producción microbiana de aminas grasas, del 20 de Noviembre de 2019, de Genomatica, Inc: Una célula bacteriana recombinante para la producción de una amina grasa, que comprende: (i) uno o más genes expresados que co 5 difican una […]
Composiciones y métodos para preparar (s)-norcoclaurina y (s)-norlaudanosolina e intermedios de síntesis de las mismas, del 23 de Octubre de 2019, de Willow Biosciences Inc: Un método de preparación de (S)-norcoclaurina o (S)-norlaudanosolina que comprende: (a) proporcionar al menos un precursor de la vía de la […]
Procedimiento para producir líquido que contiene azúcar, del 16 de Octubre de 2019, de TORAY INDUSTRIES, INC.: Procedimiento para producir un líquido que contiene azúcar utilizando una biomasa que contiene celulosa como materia prima, comprendiendo dicho procedimiento: hidrolizar […]
Microorganismos y métodos para la biosíntesis de adipato, hexametilendiamina y ácido 6-aminocaproico, del 17 de Julio de 2019, de Genomatica, Inc: Un organismo microbiano de origen no natural con una vía de hexametilendiamina que comprende al menos un ácido nucleico exógeno que codifica […]