Procedimiento para la reducción de la carga vírica y microbiana de extractos que contienen sólidos obtenidos del páncreas de animales.
Procedimiento para la reducción de la carga vírica y microbiana de extractos biológicos que contienen sólidos,
que comprende las etapas
(a) facilitación del extracto biológico que contiene sólidos que comprende al menos un principio activo biológicamente activo seleccionado de enzimas, proteínas y péptidos o una mezcla de tales principios activos; y
(b) sometimiento del extracto facilitado en la etapa (a) a un tratamiento a alta presión a una presión en el intervalo de 300 a 600 MPa (de 3000 a 6000 bar);
correspondiéndose la actividad biológica del extracto biológico que contiene sólidos después del tratamiento a alta presión al menos al 50 % de la actividad biológica del extracto biológico que contiene sólidos antes del tratamiento a alta presión,
caracterizado
por que se ha obtenido el extracto biológico que contiene sólidos del páncreas de animales y
por que el extracto biológico que contiene sólidos se facilita como suspensión que comprende una fase líquida y partículas de sólidos dispersas en la misma, estando la mezcla de principios activos biológicamente activos en una parte disuelta en la fase líquida y en otra parte unida a las partículas de sólidos.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2009/006216.
Solicitante: Nordmark Arzneimittel GmbH & Co.KG.
Nacionalidad solicitante: Alemania.
Dirección: Pinnauallee 4 25436 Uetersen ALEMANIA.
Inventor/es: MOEST, THOMAS, DR., Kurfürst,Manfred Dr, Rämsch,Christian Dr, Schräder,Thomas Dr.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61L2/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › Procedimientos o aparatos para desinfectar o esterilizar materiales u objetos distintos a los productos alimenticios y a las lentes de contacto; Sus accesorios (pulverizadores de desinfectantes A61M; esterilización de envases o del contenido del envase asociado a su contenedor B65B 55/00; tratamiento del agua, agua residual o de alcantarilla C02F; desinfección del papel D21H 21/36; dispositivos de desinfección para retretes E03D; artículos que incluyen accesorios para la desinfección, ver las subclases apropiadas para estos artículos, p. ej. H04R 1/12).
- C07K14/435 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de animales; de humanos.
- C12N9/94 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Pancreatina.
PDF original: ES-2532637_T3.pdf



Fragmento de la descripción:
Procedimiento para la reducción de la carga vírica y microbiana de extractos que contienen sólidos obtenidos del páncreas de animales
Campo de aplicación
La invención se refiere a un procedimiento para la reducción de la carga vírica y microbiana de extractos biológicos que contienen sólidos, a un extracto biológico que contiene sólidos preparado mediante este procedimiento así como a usos de un extracto biológico que contiene sólidos de este tipo.
Estado de la técnica
Los extractos que se obtienen de material de partida biológico pueden presentar una alta carga vírica. Los virus son ácidos nucleicos que están rodeados por una envuelta proteica. A los virus envueltos se le añade además una envuelta lipídica externa. Ya que los virus no se pueden replicar de forma autónoma, dependen de huéspedes. Por consiguiente aparecen en prácticamente todos los seres vivos de la Tierra. Un número pequeño de los virus conocidos son patógenos para el ser humano, ya que poseen una alta especificidad de huésped. Para descartar de antemano una puesta en riesgo de los consumidores, los extractos que están destinados al consumo humano o que se emplean como principio activo en fármacos fundamentalmente deben presentar la menor carga vírica posible o ninguna carga vírica. No siempre el procedimiento de producción en sí conduce a una inactivación o retirada significativa de los virus existentes, de tal manera que, en particular durante la preparación de principios activos farmacéuticos, se tienen que integrar en el procedimiento etapas adicionales de reducción de la concentración o inactivación.
El documento WO-A-27/14896 desvela el tratamiento térmico de un extracto de pancreatina para la reducción de la carga vírica.
Para la reducción de la concentración o la inactivación de virus y microorganismos son conocidos numerosos procedimientos. Además de la retirada mecánica mediante, por ejemplo, cromatografía o filtración, estas contaminaciones se pueden inactivar selectivamente mediante la adición de compuestos químicos. Pero el último procedimiento es problemático en el sentido de que se tienen que volver a retirar por completo estos compuestos para que no causen efectos tóxicos en el producto final. Los procedimientos físicos tales como, por ejemplo, tratamiento térmico o irradiación también son procedimientos habituales para la inactivación de virus o microorganismos.
Un desafío en particular es la inactivación o la retirada de virus de extractos biológicos complejos, cuya sustancia eficaz son mezclas de enzimas, sin destruir o cambiar a este respecto la actividad enzimática de las proteínas.
Es de interés económico particular el principio activo farmacéutico pancreatina que se obtiene como extracto del páncreas de cerdo y que se aplica en forma seca como agente terapéutico oral, tal como se describe en el documento DE 3248588 A1.
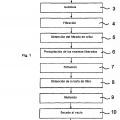
Un procedimiento típico para la preparación de pancreatina se describe a continuación con referencia a la Fig. 1. Las glándulas pancreáticas 1 procedentes de cerdos domésticos en primer lugar se trituran 2 y se someten a una autolisis 3. Mediante filtración 4 del producto intermedio obtenido de este modo se obtiene el filtrado de criba 5. Las enzimas que se encuentran en el filtrado de criba a continuación se precipitan 6, la mezcla se filtra 7 y se obtiene la torta de filtro 8. Finalmente, la torta de filtro obtenida se muele 9, se seca al vacío 1 y se vuelve a moler, por lo que se obtiene la pancreatina. Las etapas del procedimiento indicadas con las referencias 2 a 1 conducen respectivamente a productos intermedios que se denominan en lo sucesivo pasos intermedios.
Las sustancias eficaces en la pancreatina son, entre otras, distintas enzimas que degradan polímeros tales como lipasas, amilasas y proteasas. Una condición para la eficacia del agente terapéutico es que estén presentes todas las enzimas en una determinada proporción y en una forma activa en el principio activo. Una particularidad de la pancreatina es que las enzimas contenidas están presentes parcialmente en solución y parcialmente unidas a partículas y, por tanto, se trata de una suspensión.
Las investigaciones con respecto a la carga vírica de pancreatina han mostrado que los virus envueltos, pero no los no envueltos, se inactivan significativamente mediante el procedimiento actual de producción. Básicamente, los principios activos farmacéuticos no deben contener virus infecciosos. Ya que los procedimientos actuales de producción al parecer no están en disposición de eliminar una contaminación potencialmente existente de virus no envueltos con un margen suficiente de seguridad, se tienen que implementar etapas adicionales reductoras de virus.
Los procedimientos clásicos de inactivación de virus tales como, por ejemplo, calor seco o húmedo o procedimientos que disminuyen la concentración de virus tales como, por ejemplo, filtración o cromatografía, en la mayoría de los casos no se pueden aplicar en extractos de material de partida biológico y en particular en extractos de órganos sin cambio de la composición y/o elevadas pérdidas de producto. Un problema particular de estos extractos son, frecuentemente, los constituyentes no disueltos que les confieren una propiedad de tipo suspensión. Por ello se
produce el bloqueo de filtros o de columnas de cromatografía. Además, las sustancias eficaces con frecuencia están distribuidas en la fracción disuelta al igual que en la particulada y, por lo tanto, se retiran parcialmente mediante procedimientos de separación mecánicos.
Son conocidos otros procedimientos para la inactivación de virus, bacterias y hongos en materiales biológicos. Por ejemplo, el documento WO 2/56824 A2 describe la inactivación de patógenos en materiales biológicos mediante la aplicación de una alta presión. La invención se refiere al tratamiento de plasma sanguíneo, es decir, una solución de sustancias biológicamente activas en agua. Bradley D. W. y col. describen en "Pressure cycling technology: a novel approach to virus inactivation in plasma" (Transfusión, 4, 2, 193) también un procedimiento para el tratamiento de plasma sanguíneo.
El tratamiento a alta presión de alimentos se ha descrito de diversas maneras. Por ejemplo, se pueden tratar mariscos con alta presión para inactivar norovirus o virus de la hepatitis A (Kingsley y col., Inactivation of a Norovirus by High-Pressure Processing, Appl. Environ. Microbiol. 27, 581; Calci y col., High-Pressure Inactivation of Hepatitis A Virus within Oysters, Appl. Environ. Microbiol. 25, 339). El tratamiento debe conservar las propiedades organolépticas del alimento. La actividad biológica de enzimas u otros principios activos después del tratamiento a alta presión no se ha examinado. Además, en ambos casos se han examinado sólidos.
Sin embargo, también es sabido que no se puede predecir sin más si mediante tratamiento a alta presión se logra en realidad una inactivación de determinados virus (Grave S. F. y col., Inactivation of Foodborne Virases of Significance by High Pressure and other Processes, J. Food Prot. 26, 667). En función de si se trata de muestras líquidas o muestras sólidas, a causa de la distinta compresibilidad de las muestras se tienen que seleccionar diferentes condiciones del procedimiento.
Además, el tratamiento a alta presión puede conducir a un cambio de los alimentos. Por ejemplo, los frutos adoptan un color marrón cuando se someten a un tratamiento de este tipo. Este cambio cromático se debe a una reacción enzimática, lo que deja deducir un cambio de la actividad biológica de estas enzimas.
Existe una dificultad particular en muestras biológicas que no están presentes en una forma sustancialmente homogénea. En el caso de un extracto que contiene sólidos en forma de una suspensión se encuentran partes de los principios activos biológicamente activos en la fase líquida, otras partes en las partículas de sólidos dispersadas. Una inactivación de viras en las partes de sólidos, por tanto, puede estar asociada a una destrucción de los principios activos que se encuentran en la fase líquida, ya que la compresibilidad de la fase líquida es mayor que la de las partículas de sólidos.
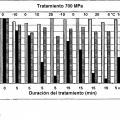
La pancreatina o los pasos intermedios que se producen durante la preparación representan a causa de su carga vírica natural y su carácter de suspensión extractos biológicos que contiene sólidos ilustrativos. En experimentos de adición puntual clásicos añaden a la sustancia correspondiente puntualmente cepas de laboratorio distintas y se determina el título antes y después del tratamiento.
Además existe una necesidad de procedimientos en los que se reduzcan las cargas víricas... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la reducción de la carga vírica y microbiana de extractos biológicos que contienen sólidos, que comprende las etapas
(a) facilitación del extracto biológico que contiene sólidos que comprende al menos un principio activo biológicamente activo seleccionado de enzimas, proteínas y péptidos o una mezcla de tales principios activos; y
(b) sometimiento del extracto facilitado en la etapa (a) a un tratamiento a alta presión a una presión en el intervalo de 3 a 6 MPa (de 3 a 6 bar);
correspondiéndose la actividad biológica del extracto biológico que contiene sólidos después del tratamiento a alta presión al menos al 5 % de la actividad biológica del extracto biológico que contiene sólidos antes del tratamiento a alta presión, caracterizado
por que se ha obtenido el extracto biológico que contiene sólidos del páncreas de animales y por que el extracto biológico que contiene sólidos se facilita como suspensión que comprende una fase liquida y partículas de sólidos dispersas en la misma, estando la mezcla de principios activos biológicamente activos en una parte disuelta en la fase liquida y en otra parte unida a las partículas de sólidos.
2. Procedimiento de acuerdo con la reivindicación 1, caracterizado por que el extracto que contiene sólidos es un extracto del páncreas del cerdo.
3. Procedimiento de acuerdo con una de las reivindicaciones anteriores 1 o 2, caracterizado por que el tratamiento a alta presión se lleva a cabo a una presión constante o con presiones por impulsos.
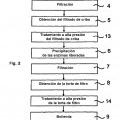
4. Procedimiento de acuerdo con una de las reivindicaciones anteriores 1 a 3, caracterizado por que el extracto biológico que contiene sólidos antes del tratamiento a alta presión se somete a una etapa de filtración, por lo que se obtienen un filtrado y una torta de filtro, sometiéndose la torta de filtro al tratamiento a alta presión.
5. Procedimiento de acuerdo con la reivindicación 4, caracterizado por que la torta de filtro presenta una parte de sólidos de al menos el 4 % en peso en relación con el peso de la torta de filtro.
6. Procedimiento de acuerdo con una de las reivindicaciones anteriores para la producción de pancreatina, que comprende las etapas:
(I) trituración de glándulas pancreáticas de cerdos domésticos;
(¡i) a continuación se someten las glándulas pancreáticas trituradas a una autolisis;
(i¡¡) el producto intermedio obtenido de este modo se criba y se obtiene el filtrado de criba;
(iv) precipitación de las enzimas que se encuentran en el filtrado de criba;
(v) la mezcla se filtra y se obtiene la torta de filtro;
(vi) finalmente se muele la torta de filtro;
(vii) después de la molienda se seca al vacío y
(viii) se muele nuevamente, por lo que se obtiene la pancreatina,
caracterizado por que la torta de filtro obtenida en la etapa (v) se somete al tratamiento a alta presión.
7. Procedimiento de acuerdo con una de las reivindicaciones anteriores 1 a 6, en el que el tiempo de acción del tratamiento a alta presión asciende a de 1 a 6 min.
8. Procedimiento de acuerdo con una de las reivindicaciones anteriores 1 a 7, en el que el tratamiento a alta presión se lleva a cabo a temperaturas en el intervalo de -2 °C a 3 °C.
9. Procedimiento de acuerdo con una de las reivindicaciones anteriores 1 a 8, en el que el tratamiento a alta presión se lleva a cabo a temperaturas en el intervalo de -1 °C a 2 °C.
1. Procedimiento de acuerdo con una de las reivindicaciones anteriores 1 a 9, caracterizado porque la actividad biológica del extracto biológico que contiene sólidos después del tratamiento a alta presión se corresponde al menos al 9 % de la actividad biológica del extracto biológico que contiene sólidos antes del tratamiento a alta presión.
11. Procedimiento de acuerdo con una de las reivindicaciones anteriores 1 a 1, caracterizado porque durante el tratamiento a alta presión del extracto biológico que contiene sólidos no se añaden sustancias químicas.
Patentes similares o relacionadas:
 Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
Moléculas de ácido nucleico de Nucampholin para controlar plagas de insectos coleópteros, del 17 de Junio de 2020, de FRAUNHOFER-GESELLSCHAFT ZUR FORDERUNG DER ANGEWANDTEN FORSCHUNG E.V.: Una molécula de ácido nucleico aislada que comprende un polinucleótido que codifica una molécula de ácido ribonucleico de horquilla (hpARN) con una estructura […]
Material basado en polímero con secuencias peptídicas unidas mediante enlace covalente, degradables por vía enzimática, del 17 de Junio de 2020, de TissueGUARD GmbH: Material basado en polímero con secuencias peptídicas unidas mediante enlace covalente, degradables por vía enzimática, que presentan al menos un punto disociable […]
PÉPTIDO DE MITICINA Y SU USO EN REGENERACIÓN CELULAR, del 4 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente en la regeneración celular y/o […]
Péptido de miticina y su uso en regeneración celular, del 28 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Péptido de miticina y su uso en regeneración celular. La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente […]
Procedimiento de purificación de G-CSF, del 27 de Mayo de 2020, de MYLAN PHARMACEUTICALS, INC: Procedimiento de purificación de factor recombinante estimulador de colonias de granulocitos (G-CSF), que comprende al menos una cromatografía de intercambio […]
Enzimas con actividad ácido clorogénico esterasa y actividad feruloil esterasa, del 27 de Mayo de 2020, de SternEnzym GmbH & Co. KG: Una enzima con actividad ácido clorogénico esterasa y actividad feruloil esterasa que comprende una secuencia que tiene al menos 85 % de identidad de aminoácidos […]
Separación de proteínas objetivo insolubles, del 27 de Mayo de 2020, de AMSILK GMBH: Un método para aislar una proteína de seda objetivo insoluble de una suspensión de células huésped intactas o rotas que comprende las etapas de: a) proporcionar […]