Separación de ácido 4-aza-androst-1-en-17-oico a partir de ácido 4-aza-androstan-17-oico.
Proceso para la separación de ácido 4-aza-androstan-17-oico a partir de ácido 4-aza-androst-1-en-17-oico,
que comprende las etapas de tratar ácido 4-aza-androst-1-en-17-oico en bruto con ácido fórmico a una temperatura menor que 40 ºC y recuperar el ácido 4-aza-androst-1-en-17-oico purificado que contiene ácido 4-aza-androstan-17- oico en un tanto por ciento p/p de menos de 0,05%.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2009/053972.
Solicitante: PHF SA.
Nacionalidad solicitante: Suiza.
Dirección: Via Castagnola 21 6900 Lugano SUIZA.
Inventor/es: BONETTI,MAURO, DE ROSA,SABRINA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07J73/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno modificada por sustitución de uno o dos átomos de carbono por heteroátomos.
PDF original: ES-2468390_T3.pdf
Fragmento de la descripción:
Separaciïn de ïcido 4-aza-androst-1-en-17-oico a partir de ïcido 4-aza-androstan-17-oico
Campo de la invenciïn La presente invenciïn se refiere a un proceso de separaciïn de ïcido 4-aza-androst-1-en-17-oico a partir de ïcido 4aza-androstan-17-oico, que conduce a ïcido 4-aza-androst-1-en-17-oico que contiene menos de 0, 05% p/p de ïcido 4-aza-androstan-17-oico, con un rendimiento y productividad elevados.
Antecedentes de la tïcnica El dihidrodutasteride (fïrmula 1) 15 Fïrmula 1
es una de las impurezas que es difïcil de eliminar del dutasteride (fïrmula 2) 20 Fïrmula 2
La solicitud internacional de patente publicada como WO 2007120263 describe el modo de purificar dutasteride derivado de dihidrodutasteride, a partir de desmetildutasteride (fïrmula 3)
Fïrmula 3
y a partir de otras impurezas desconocidas que normalmente estïn presentes. Segïn esta solicitud de patente, las impurezas desconocidas de desmetildutasteride pueden ser eliminadas a travïs de tïcnicas de separaciïn comunes. En particular, las impurezas desconocidas pueden ser suprimidas a partir de una digestiïn de dutasteride sïlido en mezclas de acetonitrilo y ïcido clorhïdrico, mientras que el desmetildutasteride es eliminado a travïs de cristalizaciïn de dutasteride a partir de mezclas de tetrahidrofurano/agua. La purificaciïn para suprimir dihidrodutasteride se hace a travïs de mïtodos cromatogrïficos, que son difïciles de usar a gran escala. Las publicaciones Org. Proc. Res. Develop. Vol. 11 (5) pïg. 842-845 (2007-09-21) , Pharmazie Vol. 62 (10) pïg. 743-746 (2007) , el documento US-A-2005/059692 y la publicaciïn J. Chinese Pharm. Sci. Vol. 16 (3) pïg. 233-235 (2007-0101) describen tambiïn diversos mïtodos para la producciïn y purificaciïn de dutasteride, siendo efectuada la purificaciïn a partir de diversos disolventes orgïnicos.
No se publican ejemplos de separaciïn de dihidrodutasteride a partir de dutasteride a travïs de cristalizaciïn en la 5 bibliografïa.
La solicitud de patente publicada como WO 2007120263 describe tambiïn que el contenido de dihidrodutasteride en el producto de marca de la entidad originaria, Avodart, es de 0, 12% con respecto a dutasteride, cerca del lïmite ICH para impurezas no cualificadas. Esto significa que el dihidrodutasteride es tïpico del proceso de fabricaciïn de dutasteride.
Se describen diversos procesos de fabricaciïn para dutasteride en la bibliografïa y en muchas patentes. Se pueden dividir en dos clases.
La primera describe la reacciïn de amidaciïn de ïcido 4-aza-androst-1-en-17-oico (denominado en lo sucesivo intermedio 1) , activado sobre el grupo –COX carboxïlico con 2, 5-bis-trifluorometil-anilina:
1 (cuando X = OH)
En la misma clase de tïcnica anterior, la solicitud de patente publicada como W09507927 describe la activaciïn del resto carboxïlico con cloruro de tionilo, mientras que la solicitud de patente publicada como W02008101308 describe la activaciïn con carbonildiimidazol.
En la segunda clase de tïcnica anterior, el dihidrodutasteride es deshidrogenado:
Ejemplos de esta reacciïn se describen en diversas patentes.
Cuando el proceso de fabricaciïn pertenece a la segunda clase de tïcnica anterior, la presencia de dihidrodutasteride en el dutasteride final deriva del material de partida que no ha reaccionado.
Por otra parte, cuando el proceso de fabricaciïn pertenece a la primera clase de tïcnica anterior anteriormente descrita el dihidrodutasteride deriva de ïcido 4-aza-androstan-17-oico (en lo sucesivo indicado como intermedio 2 y denominado tambiïn “intermedio 1 hidrogenado”) , impureza de intermedio 1, que es un material de partida de la sïntesis, ya que el intermedio 1 procede de la deshidrogenaciïn del intermedio 1 hidrogenado.
Por lo tanto, hay una necesidad de un mïtodo sintïtico para obtener dutasteride con un contenido de dihidrodutasteride dentro de los lïmites ICH evitando el uso de tïcnicas de purificaciïn no aplicables a una producciïn a gran escala.
La separaciïn de dihidrodutasteride a partir de dutasteride usando las tïcnicas normales de separaciïn sïlido
lïquido no es posible porque el dutasteride y dihidrodutasteride conjuntamente proporcionan soluciones sïlidas. Ademïs, el dihidrodutasteride tiene un punto de fusiïn (256, 0 ïC) mayor que el dutasteride (247, 5 ïC) , por lo que una cristalizaciïn eventual aumenta el contenido de dihidrodutasteride en el producto aislado.
Relaciïn en moles dutasteride/dihidrodutasteride Punto de fusiïn, ïC
90:1 250, 2
61:39 250, 6
38:62 251, 7
18:82 253, 5
Por lo tanto, no es posible purificar dutasteride a partir de dihidrodutasteride por medio de cristalizaciïn cuando el dutasteride es sintetizado a partir de dihidrodutasteride a travïs de deshidrogenaciïn.
Si el dutasteride es sintetizado a travïs de una reacciïn de amidaciïn a partir del intermedio 1, la ïnica forma de preparar el producto final con un contenido de dihidrodutasteride dentro de los lïmites ICH es usar un material de partida, intermedio 1, con un bajo de nivel adecuado de intermedio 1 hidrogenado (intermedio 2) .
Descripciïn de la invenciïn La presente invenciïn se refiere a un proceso de separaciïn de intermedio 1 a partir de intermedio 2 (intermedio 1 hidrogenado) , que conduce a un intermedio 1 que contiene menos de 0, 05% p/p de intermedio 2 con rendimientos y productividad elevados.
El intermedio 1 que contiene intermedio 2 (intermedio 1 hidrogenado) proporciona despuïs del proceso anteriormente mencionado, dutasteride que contiene una cierta cantidad de dihidrodutasteride.
La purificaciïn a travïs de cristalizaciïn de una mezcla de intermedio 1 e intermedio 2 usando disolventes convencionales no es posible porque el intermedio 2 normalmente es menos soluble que el intermedio 1.
Disolvente Solubilidad de intermedio 1 a 25 ïC, % p/p Solubilidad de intermedio 2 a 25 ïC, % p/p
Metanol 0, 6 0, 16
Acetato de etilo 0, 02 0, 003
Tolueno < LOD < LOD
Cloruro de metileno 0, 04 0, 008
Acetona 0, 06 0, 008
DMF 2, 4 0, 40
MTBE 0, 009 0, 001
(LOD = Lïmite de detecciïn)
Sorprendentemente se encontrï que la solubilidad del intermedio 2 (intermedio 1 hidrogenado) en ïcido fïrmico es mayor que la del intermedio 1, haciendo asï posible la purificaciïn de intermedio 1 a partir de intermedio 2.
Este hecho es incluso mïs sorprendente porque otros disolventes de ïcidos carboxïlicos similares, como ïcido 30 acïtico y ïcido propiïnico, no comparten el comportamiento de solubilidad invertida mostrado por el ïcido fïrmico.
Disolvente Solubilidad de intermedio 1 a 25 ïC, % p/p Solubilidad de intermedio 1 hidrogenado a 25 ïC, % p/p
ïcido fïrmico 7, 7 20, 32
ïcido acïtico 8, 1 3, 69
ïcido propiïnico 6, 6 3, 10
Sin embargo, se encontrï que no se puede realizar una cristalizaciïn convencional en ïcido fïrmico, ya que la solubilizaciïn de intermedio 1 a concentraciones especïficas requiere temperaturas elevadas. En estas condiciones el ïcido fïrmico reacciona con el intermedio 1 segïn el siguiente esquema:
Sin embargo, se encontrï que trabajando a temperaturas de menos de 40 ïC, se puede realizar la purificaciïn deseada sin disolver y seguidamente volver a precipitar el intermedio 1, sino a travïs de una denominada “digestiïn” del producto. En estas condiciones, no se produce ninguna reacciïn con ïcido fïrmico, como se describiï anteriormente.
En la prïctica, el sïlido se pone en suspensiïn en ïcido fïrmico y se mantiene durante un cierto tiempo, 15 preferentemente bajo agitaciïn, hasta que se disuelve al impureza (intermedio 2) .
En una realizaciïn, se usa ïcido fïrmico en cantidades p/p que varïan en el intervalo de 3 a 4 veces la cantidad de intermedio 1 en bruto.
La temperatura de tratamiento se selecciona para que sea suficientemente baja para evitar cualquier reacciïn ïcido fïrmico en la base de intermedio 1, cuya temperatura de tratamiento serï menor que 40 ïC. En una realizaciïn adicional, la temperatura de tratamiento serï mayor que -10 ïC o menor que 0 ïC y menor que 35 ïC.
Esta operaciïn se puede hacer en una ïnica etapa de purificaciïn o en dos etapas. Cuando el tratamiento se realiza en una etapa, se puede realizar durante un periodo de tiempo por encima de 20 horas, preferentemente por encima de 25 horas y menos de 60 horas, preferentemente menos de 50 horas. Se aplican los mismos tiempos de tratamiento para la digestiïn global, cuando se realiza dos etapas.
Cuando el tratamiento se realiza en dos etapas,... [Seguir leyendo]
Reivindicaciones:
1. Proceso para la separaciïn de ïcido 4-aza-androstan-17-oico a partir de ïcido 4-aza-androst-1-en-17-oico, que comprende las etapas de tratar ïcido 4-aza-androst-1-en-17-oico en bruto con ïcido fïrmico a una temperatura menor que 40 ïC y recuperar el ïcido 4-aza-androst-1-en-17-oico purificado que contiene ïcido 4-aza-androstan-17ºico en un tanto por ciento p/p de menos de 0, 05%.
2. Proceso segïn la reivindicaciïn 1, en el que dicho tratamiento se hace bajo agitaciïn.
3. Proceso segïn la reivindicaciïn 1 o 2, en el que dicho tratamiento se hace a una temperatura de tratamiento mayor que -10 ïC o mayor que 0 ïC y menor que 35 ïC.
4. Proceso segïn una cualquiera de las reivindicaciones 1 a 3, en el que la duraciïn del tratamiento es de mïs de 4
horas. 15
5. Proceso segïn la reivindicaciïn 4, en el que la duraciïn del tratamiento estï por encima de 20 horas, o por encima de 25 horas y menos de 60 horas o menos de 50 horas.
6. Proceso segïn una cualquiera de las reivindicaciones 1 a 5, en el que el tratamiento con ïcido fïrmico se realiza 20 bajo agitaciïn por medio de un homogeneizador.
7. Proceso segïn la reivindicaciïn 6, en el que dicho homogeneizador funciona a una velocidad de rotaciïn de 4.000 a 6.000 rpm.
8. Proceso segïn la reivindicaciïn 6 ï 7, en el que el tiempo de tratamiento estï en el intervalo de 3 a 22 horas o de 4 a 18 horas.
9. Proceso segïn una cualquiera de las reivindicaciones 1 a 8, en el que el tratamiento se realiza en dos etapas.
10. Proceso segïn una cualquiera de las reivindicaciones 1 a 9, en el que el ïcido fïrmico es usado en cantidades p/p que varïan en el intervalo de 3 a 4 veces la cantidad de ïcido 4-aza-androst-1-en-17-oico en bruto.
11. Proceso para la sïntesis de dutasteride, que comprende la etapa de convertir ïcido 4-aza-androst-1-en-17-oico obtenido segïn el proceso de una cualquiera de las reivindicaciones 1 a 10 en dutasteride a travïs de la activaciïn 35 del grupo carboxïlico de dicho ïcido 4-aza-androst-1-en-17-oico y la subsiguiente anidaciïn.
12. Proceso segïn la reivindicaciïn 11, en el que dicho grupo carboxïlico activado se hace reaccionar con 2, 5bis (trifluorometil) anilina.
13. Composiciïn de ïcido 4-aza-androst-1-en-17-oico y ïcido 4-aza-androstan-17-oico en el que el tanto por ciento p/p de ïcido 4-aza-androstan-17-oico con respecto a la suma de ïcido 4-aza-androst-1-en-17-oico y ïcido 4-azaandrostan-17-oico es de menos de 0, 05%.
Patentes similares o relacionadas:
Ésteres de lactama esteroidea y derivados de ácido bis(2-cloroetil) aminofenoxi propanoico, del 13 de Mayo de 2019, de Galenica S.A: Un compuesto de fórmula (I) o una sal farmacéuticamente aceptable del mismo**Fórmula** en la que R1 se selecciona del grupo que consiste en**Fórmula** […]
METODO PARA LA INDUCCION DE RESISTENCIA A ENFERMEDADES EN PLANTAS, del 7 de Septiembre de 2012, de CENTRO DE INGENIERIA GENETICA Y BIOTECNOLOGIA: La presente invención describe un método para la estimulación de la defensa natural y la inducción de resistencia a enfermedades en plantas, mediante la activación simultánea […]
Derivados de oxa-esteroides como moduladores selectivos del receptor de progesterona, del 27 de Junio de 2012, de JANSSEN PHARMACEUTICA N.V.: Un compuesto de fórmula (I) **Fórmula** en la que R1 está seleccionado entre el grupo que consiste en alquilo C1-6, alquenilo C2-4, alquinilo C2-4, arilo, heteroarilo,aralquilo […]
Control de las características de sabor e indicador de la frescura de un zumo de frutas, del 30 de Mayo de 2012, de TROPICANA PRODUCTS, INC.: Un procedimiento para determinar la cantidad de estrés térmico que se ha infligido a un zumo de frutas,comprendiendo dicho procedimiento determinar la proporción […]
PROCEDIMIENTO PARA LA OBTENCION DE LA FORMA POLIMORFICA I DE FINASTERIDA, del 14 de Junio de 2010, de RAGACTIVES, S.L.: El procedimiento comprende ((i) disolver finasterida en un disolvente orgánico sustancialmente anhídrido, seleccionado entre acetato de n-butilo, acetato […]
PROCEDIMIENTO PARA LA DESHIDROGENACION DE COMPUESTOS AZAANDROSTANO., del 16 de Marzo de 2007, de RICHTER GEDEON VEGYESZETI GYAR R.T.: Procedimiento para la preparación de compuestos de fórmula I (I) en la que R1 es un grupo -NH-tert-butilo o 4-metilpiperidino, por bioconversión de los compuestos de fórmula […]
METILENO-4-AZASTEROIDES., del 1 de Diciembre de 2006, de JENAPHARM GMBH & CO. KG: 17-Metileno-4-azasteroides sustituidos con halógeno y pseudohalógeno de la fórmula general I (Ver fórmula) R20 y R20a representan por separado grupos fluoro, […]
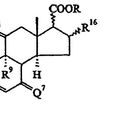 PROCEDIMIENTO PARA LA PREPARACION DE 4-AZA-ESTEROIDES, del 5 de Junio de 2009, de LONZA AG: Un procedimiento para la preparación de 4-azaesteroides de la fórmula** ver fórmula** en el que R 1 y R 2 se seleccionan independientemente del grupo que consiste en hidrógeno, […]
PROCEDIMIENTO PARA LA PREPARACION DE 4-AZA-ESTEROIDES, del 5 de Junio de 2009, de LONZA AG: Un procedimiento para la preparación de 4-azaesteroides de la fórmula** ver fórmula** en el que R 1 y R 2 se seleccionan independientemente del grupo que consiste en hidrógeno, […]