Procedimiento para la fabricación de un material metálico poroso para aplicaciones biomédicas y material obtenido por dicho procedimiento.
Procedimiento para la fabricación de un material metálico poroso para aplicaciones biomédicas y material obtenido por dicho procedimiento.
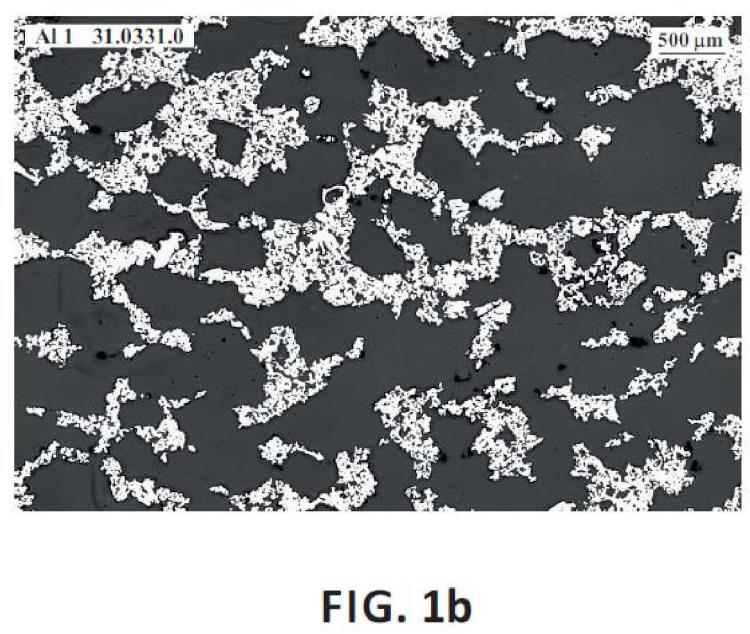
Procedimiento para la obtención de una pieza de titanio poroso caracterizado porque el polvo de titanio de partida es puro, el tamaño medio de las partículas es de 200 micrómetros, fluencia de 93s y densidad aparente de 1,0 g/cm3. Dicho polvo se mezcla, en una proporción de 34% de titanio en peso con NaCl con un tamaño de partícula de entre 300 y 600 micrómetros y al menos 50% en peso. Gracias a estos parámetros, el material resultante presenta una osteointegración, biocompatibilidad y resistencia óptimas para aplicaciones biomédicas.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201430408.
Solicitante: ALEACIONES DE METALES SINTERIZADOS, S.A.
Nacionalidad solicitante: España.
Inventor/es: Calero Martínez,José Antonio, GIL MUR,Francisco Javier.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61L27/06 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › Titanio o sus aleaciones.
- A61L27/56 A61L 27/00 […] › Materiales porosos o celulares.
- B22F3/11 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B22 FUNDICION; METALURGIA DE POLVOS METALICOS. › B22F TRABAJO DE POLVOS METALICOS; FABRICACION DE OBJETOS A PARTIR DE POLVOS METALICOS; FABRICACION DE POLVOS METALICOS (fabricación de aleaciones mediante metalurgia de polvos C22C ); APARATOS O DISPOSITIVOS ESPECIALMENTE ADAPTADOS PARA POLVOS METALICOS. › B22F 3/00 Fabricación de piezas a partir de polvos metálicos, caracterizada por el modo de compactado o sinterizado; Aparatos especialmente concebidos para esta fabricación. › Fabricación de piezas u objetos porosos.

Fragmento de la descripción:
Procedimiento para la fabricación de un material metálico poroso para aplicaciones biomédicas y material obtenido por dicho procedimiento 5
SECTOR DE LA TÉCNICA
La presente invención se refiere a un material metálico poroso para ciertas aplicaciones biomédicas. En particular, la invención comprende un procedimiento de fabricación y aleación de titanio con propiedades de osteointegración y adsorción mejoradas. 10
ESTADO DE LA TÉCNICA
Uno de los grandes problemas de la selección de materiales metálicos en aplicaciones biomédicas de artoplastias es la necesidad de conjugar dos características funcionales como son las de 15 osteointegración y la de semejanza de rigidez con el hueso humano, todo ello bajo la premisa inicial de constituir un material capaz de soportar las cargas dinámicas de uso.
El titanio tiene tres grandes beneficios: su gran bio-compatibilidad, su reducido módulo de rigidez (110GPa frente a los 210GPa de los aceros sanitarios típicos) y su compatibilidad con técnicas de 20 diagnosis y evaluación como TAC o RMN. Todo ello hace que el titanio o sus aleaciones sean los materiales metálicos más adecuados para la fabricación de cualquier prótesis o implante que deba ser colocado en el interior del cuerpo humano.
A la hora de conformar el material metálico para la fabricación de estas prótesis se utiliza el 25 material de forja mecanizado a la forma diseñada por los especialistas, manteniéndose las propiedades mecánicas anteriormente mencionadas.
Sin embargo resulta que estas propiedades, aun siendo mejores que las de cualquier acero o material de CrCo en el mercado, no son suficientes para mejorar dos aspectos básicos, la 30 reabsorción del hueso y la osteointegración. El primero de estos aspectos está íntimamente ligado con la disimilitud de los módulos de rigidez del hueso (de 0, 5 a 30GPa) y de la prótesis metálica. A medida que ambos valores se acercan, la prótesis actúa funcionalmente como un hueso y la reabsorción del mismo se ve reducida, mejorando la vida del implante y por lo tanto la calidad de vida del paciente. La forma más sencilla de disminuir el módulo sin modificar el material es 35 aumentando la porosidad del sistema, y la tecnología que genera materiales porosos por antonomasia es la tecnología pulvimetalúrgica.
El segundo aspecto en el que se debe mejorar el material actual para prótesis es el de la osteointegración. Cada vez más se tiende a utilizar prótesis no cementadas para reducir el 40 impacto del propio anclaje no sólo en la cavidad perforada sino en la evaluación de riesgos por rotura del cemento fraguado. La utilización de prótesis no cementadas comporta el desarrollo de sistemas propios de anclaje y lo más extendido actualmente es la aplicación de recubrimientos de cerámicas o materiales metálicos biocompatibles por tecnologías de proyección térmica, o el depósito de microesferas por pegado artesanal y resinterización de las mismas Ambos tipos de 45 sistemas adolecen de varios inconvenientes. La proyección térmica genera una superficie rugosa, pero no hay intercomunicación real y en profundidad de esta rugosidad superficial, con lo que el tejido óseo únicamente se 'agarra' a las cavidades y crestas de la orografía generada. Por su parte el depósito de microesferas conlleva el riesgo intrínseco de la descohesión de algunas de estas microesferas con el consiguiente peligro para la salud del paciente, habida cuenta del bajo 50 número de puntos de soldadura que tienen dichas microesferas al sinterizar. Además en este último caso han sido numerosos los problemas de fracturas de prótesis en servicio producido por fatiga. La unión soldada de la esfera a la matriz genera cantos vivos que son puntos de exaltación de las tensiones.
El procesado de material de titanio y aleaciones por vía pulvimetalúrgia para la obtención de material poroso es conocido en el estado de la técnica. La utilización de agentes espaciadores que se eliminan en alguno de los procesos de la ruta productiva a seguir es la vía que ha llevado a mayores éxitos y que tiene visos de ser la que antes se industrialice.
La utilización del espaciador condiciona el tamaño del poro que se genera en la pieza una vez eliminado el espaciador. Sin embargo, la existencia del macroporo no implica necesariamente la existencia de canales de tamaños semejantes al macroporo para el crecimiento de capilares sanguíneos hacia el interior del material poroso.
El proceso pulvimetalúrgico permite compactar polvos de titanio y/o aleaciones de titanio con tamaño medio de grano desde los 300 micrometros a tamaños inferiores a las 25 micrometros. Este proceso seguido de una sinterización adecuada permite obtener materiales conformados de titanio con densidades que oscilan entre el 85% del macizo y el 98% del mismo, debido a la gran contracción observada en el sinterizado. Dada la estructura de grano fino, las propiedades 15 mecánicas cuando se sinterizan las piezas en condiciones de alto vacío oscilan en torno a los mismos dígitos que el material macizo.
La transmisión de las tensiones al hueso se realiza a través de la prótesis, por lo que ésta debería tener un módulo de elasticidad lo más parecido al hueso para la adecuada transferencia de cargas 20 al mismo y evitar el denominado apantallamiento de tensiones mecánicas que provoca la reabsorción ósea por falta de tensión aplicada al hueso. Por tanto, poco importa el módulo de elasticidad de la superficie si el conjunto de la prótesis no tiene un modulo parecido al hueso..Si se trabaja con polvo fino, la transmisión de la carga durante la compactación uniaxial pulvimetalúrgica genera gradientes de densidad que durante la sinterización en alto vacío supone distorsiones de 25 la forma inicial prensada. Esto representa un gran inconveniente porque implica un procesado de mecanización a forma final que no es posible hacer tras el estadio de sinterización porque la porosidad superficial se cierra e impide la osteointegración. La existencia de distorsiones en la sinterización y sobretodo la existencia de una â?pielâ? de polvo laminado en la superficie lateral de la pieza, por la fricción existente durante la extracción del molde, conduce a la decisión de mecanizar 30 en verde para abrir la porosidad y buscar las dimensiones más adecuadas para la consecución de las formas y medidas finales tras el sinterizado. Para mecanizar en verde es necesario cierta resistencia del material, para lo cual, en algunas referencias y patentes (por ejemplo US7674426B2) se describe el uso de una compactación isostática en frío. Todo ello encarece el sistema y además, debido a que estos procesos se realizan con polvo fino de titanio o aleaciones 35 de titanio, la interconexión final entre dichos poros no supera las 10 micrometros, por lo que la vascularización y el crecimiento óseo eficiente en el interior del sistema poroso queda en entredicho.
Cuando se implanta un material en el organismo se produce una reacción inmunológica a cuerpo 40 extraño que provoca que el implante sea envuelto en tejido fibroso y quede encapsulado y aislado del tejido circundante. En ciertas aplicaciones este aislamiento no interesa, porque no permitiría la unión del hueso con el implante y éste no realizaría las funciones para las que ha sido diseñado. Para impedirlo, es necesario convertir la superficie del implante en bioactiva, es decir, que sea capaz de unirse con el tejido óseo adyacente, o bien recubrir la superficie con material más afín al 45 hueso como la hidroxiapatita. Esta hidroxiapatita suele tener un carácter amorfo o de baja cristalinidad lo que supone unas velocidades de disolución en medio sanguíneo muy rápidas, generando problemas de inestabilidad de prótesis que acaban con operaciones de recolocación de las mismas, así como una menor o nula osteointegración.
OBJETO DE LA INVENCIÓN
Para resolver los problemas mencionados, el procedimiento de la invención propone el uso de un polvo de titanio con determinadas propiedades y su mezcla con una sal de tamaño y en proporción también determinada. Más en concreto, la invención propone un procedimiento para la obtención de una pieza de titanio poroso caracterizado porque el polvo de titanio de partida es puro, el tamaño medio de las partículas es de 200 micrómetros, fluencia de 93s, densidad aparente de 1, 0g/cm3 y dicho polvo se mezcla, en una proporción de 34% de titanio en peso con NaCl, con un tamaño de partícula de entre 300 y 600 micrómetros y al menos 50% en peso. 5
Estas características dan como resultado una interconexión entre poros de más de 150 micrómetros y, conjuntamente con la naturaleza biocompatible del material a base titanio, hacen que el producto sea muy adecuado...
Reivindicaciones:
1. Procedimiento para la obtención de una pieza de titanio poroso caracterizado porque el polvo de titanio de partida es puro, el tamaño medio de las partículas es de 200 micrómetros, la fluencia de 93s, la densidad aparente de 1, 0g/cm3 y dicho polvo se mezcla, en una proporción de 34% de 5 titanio en peso, con NaCl, con un tamaño de partícula de entre 300 y 600 micrómetros y al menos 50% en peso.
2. Procedimiento según la reivindicación 1 caracterizado porque comprende además los siguiente pasos: 10
i) añadir un ligante en una proporción de al menos el 15% ;
ii) compactar el material resultante entr.
20. 400MPa;
iii) eliminar el ligante y la sal mediante un proceso térmico seguido de continuos enjuagues en agua bidestilada 15
iv) sinterizar a una temperatura de entre 1200º C y 1400º C y a una presión inferior a 4 10-4 mbar
v) mecanizar superficialmente la pieza.
3. Procedimiento según la reivindicación 2 caracterizado porque tras el paso v se introduce la 20 pieza en una solución básica de hidróxido de sodio (NaOH) 5M.
4. Procedimiento según cualquiera de las reivindicaciones 2-3 caracterizado porque el ligante es etilenglicol.
5. Procedimiento según cualquiera de las reivindicaciones 2-4 caracterizado porque el paso i) se realiza en un mezclador bicónico y el paso iii) se realiza mediante la introducción de la mezcla húmeda en una matriz y posterior prensado uniaxial.
6. Procedimiento según la reivindicación 5 caracterizado porque el prensado uniaxial se realiza en 30 una prensa hidráulica.
7. Material metálico poroso fabricado según cualquiera de las reivindicaciones anteriores.
Patentes similares o relacionadas:
Procedimiento de fabricación de un material metálico poroso para aplicaciones biomédicas, del 17 de Junio de 2020, de ALEACIONES DE METALES SINTERIZADOS, S.A: Procedimiento de obtención de una pieza de titanio poroso, caracterizado porque el polvo de titanio de partida es de pureza de calidad 2, con un tamaño de […]
Proceso para preparar un cuerpo que tiene una topografía osteointegrativa formada en su superficie, del 26 de Febrero de 2020, de STRAUMANN HOLDING AG: Procedimiento para preparar un cuerpo que tiene una topografía osteointegrativa formada en su superficie, comprendiendo el proceso las etapas de a) proporcionar un […]
MÉTODO DE TRATAMIENTO SUPERFICIAL DE UN IMPLANTE DENTAL O COMPONENTE PROTÉSICO, Y UN IMPLANTE DENTAL O COMPONENTE PROTÉSICO PROVISTO DE UNA SUPERFICIE NANOPOROSA, del 26 de Diciembre de 2019, de BIOTECHNOLOGY INSTITUTE, I MAS D, S.L: Método de tratamiento superficial de un implante dental o de un componente protésico fabricado de titanio o de una aleación de titanio, que permite obtener una superficie […]
MÉTODO DE TRATAMIENTO SUPERFICIAL DE UN IMPLANTE DENTAL O COMPONENTE PROTÉSICO, Y UN IMPLANTE DENTAL O COMPONENTE PROTÉSICO PROVISTO DE UNA SUPERFICIE NANOPOROSA, del 19 de Diciembre de 2019, de BIOTECHNOLOGY INSTITUTE, I MAS D, S.L: Método de tratamiento superficial de un implante dental o de un componente protésico fabricado de titanio o de una aleación de titanio, que permite obtener una superficie […]
Implante biocompatible, del 20 de Noviembre de 2019, de NUMAT MEDTECH, S.L: Un implante biocompatible que comprende uno o varios metales, aleaciones metálicas, óxidos metálicos o una combinación de estos elementos, en el que se forma un enlace […]
Recubrimiento superficial multifuncional de implantes, del 16 de Octubre de 2019, de University of Massachusetts Medical School: Una composición antiincrustación y bactericida que comprende un polímero zwitteriónico que comprende restos antibacterianos en donde el polímero zwitteriónico es un copolímero […]
Método para producir un implante metálico, del 14 de Agosto de 2019, de Helmholtz-Zentrum Geesthacht Zentrum für Material- und Küstenforschung GmbH: Un método para producir cuerpos metálicos conformados útiles como implantes para cirugía ortopédica u odontología, que comprende los pasos de (a2) proporcionar un cuerpo […]
Aleaciones con memoria de forma de módulo elástico autoadaptable y ultra bajo, del 12 de Junio de 2019, de THE TEXAS A & M UNIVERSITY SYSTEM: Un procedimiento de fabricación de una aleación con memoria de forma que comprende: (a) fundir titanio (Ti) y niobio (Nb) para formar una aleación, en el que la aleación […]