Método para la preparación de compuestos 2-halo-2''-desoxiadenosina a partir de 2''-desoxiguanosina.
Un método para producir 2-cloro-2'-desoxiadenosina que comprende las etapas de:
(a) convertir el grupo 6-oxo de un compuesto que tiene la fórmula **Fórmula**
en un grupo saliente en 6 que tiene suficiente reactividad para una reacción de desplazamiento de SNAr, en la que Res un grupo protector;
(b) reemplazar el grupo 2-amino con un grupo 2-cloro en una reacción de diazotización/clorodesdiazoniación;
(c) reemplazar el grupo saliente en 6 con un grupo 6-amino; y
(d) separar los grupos protectores R, para producir la 2-cloro-2'-desoxiadenosina.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/030386.
Solicitante: BRIGHAM YOUNG UNIVERSITY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: A-285, ASB, P.O. BOX 21231 PROVO, UT 84602-1231 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ROBINS, MORRIS J., JANEBA,ZLATKO, FRANCOM,PAULA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07H19/167 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 19/00 Compuestos que contienen un heterociclo que comparten un heteroátomo del ciclo con un radical sacárido; Nucleósidos; Mononucleótidos; Sus anhidro-derivados. › con un ribosilo como radical sacárido.
- C07H19/173 C07H 19/00 […] › con un desoxi-2-ribosilo como radical sacárido.
PDF original: ES-2405825_T3.pdf
Fragmento de la descripción:
Método para la preparación de compuestos 2-halo-2'-desoxiadenosina a partir de 2’-desoxiguanosina Campo de la invención La presente invención se dirige a procedimientos para preparar 2-halo-6-aminopurinas, y más particularmente a un 5 procedimiento para preparar la 2-cloro-2'-desoxiadenosina.
Antecedentes de la invención La toxicidad linfoselectiva de la 2-cloro-2'-desoxiadenosina (CldAdo, cladribina) y su potencial como agente quimioterapéutico contra los neoplasmas linfoides han sido descritos por Carson et al.1 Este potente análogo de la 2'-desoxiadenosina (dAdo) , resistente a las desaminasas es normalmente el fármaco de elección para la leucemia 10 de células peludas.2, 3 También tiene una actividad importante frente a la leucemia linfocítica crónica, 4, 5 linfoma indolente no Hodgkin, 6 y macroglobulinemia de Waldenström.7 Están en desarrollo investigaciones sobre el tratamiento con cladribina de la esclerosis mútiple, 8 de la glomerulonefritis asociada al lupus eritematoso sistémico, 9 y otros trastornos reumatoides e inmunitarios. La cladribina es un profármaco nucleósido, que es fosforilado por la desoxicitidina-cinasa hasta CldAMP, y después secuencialmente hasta CldADP y CldATP activo.1a, 10a La cladribina también es un buen sustrato para la 2'-desoxiguanosina (dGuo) -cinasa mitocondrial, 10 y la inducción de la muerte celular programada mediante efectos directos sobre las mitocondrias ha sido implicada en su potente actividad frente a los tumores malignos linfoides indolentes (vía apoptosis) así como en la proliferación celular.11, 12
Se han publicado varias metodologías para la producción de la cladribina. Venner publicó la síntesis de Fischer-Helferich de los 2'-desoxinucleósidos naturales en 1960, 13 y empleó la 2-cloro-2'-desoxiadenosina como un intermedio para la 2'-desoxi (guanosina y la inosina) . Ikehara y Tada sintetizaron también la dAdo con la CldAdo como un intermedio [obtenido por desulfurización de la 8, 2'-anhidro-9- (º-D-arabinofuranosil) -2-cloro-8-tioadenina].14
La síntesis de la CldAdo como un compuesto objetivo se ha aprovechado de la mayor reactividad de los grupos salientes en C6 con respecto a los grupos en C2 del anillo de purina en las reacciones de desplazamiento SNAr. Robins and Robins15 emplearon el acoplamiento por fusión de la 2, 6-dicloropurina con 1, 3, 5-tri-O-acetil-2-desoxi-a
D-ribofuranosa. El anómero 9- (3, 5-di-O-acetil-2-desoxi-a-D-eritro-pentofuranosil) -2, 6-dicloropurina se obtuvo por cristalización fraccionada. La amonolisis selectiva en C6 y la desprotección que la sigue dio la 6-amino-2-cloro-9- (2desoxi-a-D-eritro-pentofuranosil) purina. Se preparó el º-anómero farmacológicamente activo (cladribina) mediante un acoplamiento análogo, separación cromatográfica de los anómeros, y amonolisis.16
La glucosilación estereoselectiva de las sales de sodio de las halopurinas y análogos con cloruro de 2-desoxi-3, 5-di
O-p-toluoil-a-D-eritro-pentofuranosilo dio los anómeros º-nucleósidos mediante la inversión predominante de Walden, 17, 18 y la amonolisis/desprotección dio la CldAdo.19 Aunque la glucosilación de la sal de sodio normalmente dio una buena estereoselectividad anomérica, normalmente se formaron menores cantidades de a-anómeros y >10 % de regioisómeros N7.20, 21 Esto requiere separaciones y produce menores rendimientos del producto N9 deseado. Carson et al.1 había descrito una transferencia enzimática del azúcar 2-desoxi procedente de la timidina a la 2
cloroadenina (ClAde) . Holy y colaboradores observaron que las células de una cepa de Escherichia coli realizaban una transferencia de glucosilo de la 2'-desoxiuridina a la 2-cloro-6-[ (dimetilaminometileno) amino]purina para dar un derivado de la CldAdo.22 Muy recientemente Barai, Mikhailopulo, y colaboradores23 han descrito una síntesis por transferencia de glucosilo mediada por E. coli de 2, 6-diamino-9- (3-desoxi-º-D-eritro-pentofuranosil) purina, 24 y su desaminación enzimática hasta 3'-desoxiguanosina.24 Han descrito la transferencia de glucosilo desde la 2'
desoxiguanosina hasta ClAde, y reivindican un rendimiento del 81 % de CldAdo (basado en ClAde) .23 Sin embargo, se empleó una relación 3:1 de dGuo/ClAde de modo que el rendimiento de CldAdo fue <27 % basado en dGuo.
Sampath et al. han presentado recientemente (Patente de Estados Unidos Nº 6.596.858 B2) un método para preparar compuestos de 2-cloro-2'-desoxiadenosina, utilizando la 2-amino-2'-desoxiadenosina como compuesto de partida, pero empezando con una reacción inicial de diazotización/cloro-desdiazoniación sobre el nucleósido no 45 protegido para reemplazar el grupo 2-amino con un grupo 2-cloro. Este método, sin embargo, crea varias impurezas, lo que requiere procedimientos extensos de purificación, y produce un rendimiento global de sólo un 27 %.
Por consiguiente, existe una necesidad importante de producir la CldAdo utilizando métodos que produzcan un rendimiento más alto, que sean más rentables, y que produzcan una forma más purificada.
Sumario de la invención 50 La presente invención es un método para producir la 2-cloro-2'-desoxiadenosina (CldAdo) que comprende las etapas de: (a) convertir el grupo 6-oxo de un compuesto que tiene la fórmula (1) en la que R es un grupo protector, en un grupo 6-saliente que tiene suficiente reactividad para una reacción de desplazamiento de SNAr; (b) reemplazar el grupo 2-amino con un grupo 2-cloro en una reacción de diazotización/cloro-desdiazoniación; (c) reemplazar el grupo saliente en 6 con un grupo 6-amino; y (d) separar los grupos protectores R, para producir la 2-cloro-2'
desoxiadenosina.
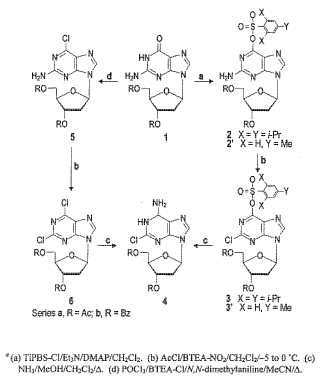
Descripción de las figuras La Figura 1 presenta la síntesis química de 2-cloro-2'-desoxiadenosina a partir de formas protegidas de la 2'desoxiguanosina natural.
La Figura 2 presenta la reacción de conversión por diazotización/halo-desdiazoniación desde un nucleósido de 25 aminopurina a un nucleósido de 2-halopurina.
Descripción de las realizaciones preferidas de la invención De acuerdo con la presente invención, la síntesis de la regio-2-cloro-2'-desoxiadenosina y de la 2-cloro-2'desoxiadenosina estereoquímicamente pura (Cladrabina, o CldAdo) , que evita la separación de mezclas con procedimientos de fusión y de glucosilación de la sal de sodio, se lleva a cabo por la transformación del nucleósido 10 natural de 2'-desoxiadenosina (dGuo) como el compuesto de partida.24 Los métodos para producir la CldAdo a partir de la 2'-desoxiadenosina (dGuo) según la presente invención, empiezan con las formas protegidas de dGuo, que incluyen, pero sin limitarse a ellos, los derivados acilo, sililo, amida y otros derivados útiles en el campo de la química de los nucleósidos/nucleótidos/ácidos nucleicos y estrategias de protección. Los métodos para obtener formas protegidas de dGuo son bien conocidos en la técnica.25, 26, 27, 28, 29, 30 Los productos de partida preferidos para la síntesis eficiente de la CldAdo se definen por la siguiente estructura química:
en la que R es cualquier grupo protector adecuado, y preferiblemente R es Ac o Bz.
Para obtener los compuestos CldAdo deseados, se tratan los derivados protegidos de dGuo con combinaciones de compuestos químicos que efectúan la funcionalización en la posición C6 para dar grupos que puedan ser 20 reemplazados, seguido por la transformación de la función 2-amino en un grupo 2-cloro, seguido por el reemplazamiento del grupo 6-funcional para dar un grupo 6-amino (o un 6-sustituyente que se puede convertir en un grupo 6-amino, seguido por la conversión en el grupo 6-amino) , y la desprotección concomitante o subsiguiente del derivado de 6-amino-2-cloropurina resultante para dar la CldAdo. Por ejemplo, a partir de dGuo, se sintetiza la CldAdo (4) (Figura 1) convirtiendo la función 6-oxo en los grupos salientes apropiados 6- (oxi sustituido) que se pueden reemplazar sin protección del resto 2-amino, transformación de la función 2-amino en un grupo funcional 2cloro mediante diazotización/cloro-desdiazoniación de la función 2-amino, y amonolisis selectiva en C6 de los derivados de 2-cloro-6- (sustituida) purina, seguido de la desprotección del azúcar. Esta ruta proporciona de forma ventajosa la retención tanto de la pureza estereoquímica º-anomérica como de la pureza isomérica de N9.
La funcionalización del grupo 6-oxo va acompañada de la conversión, sin protección del resto 2-amino, del grupo 6
oxo en un grupo saliente 6- (oxi sustituido) que tiene mayor reactividad que el grupo 2-cloro en una reacción de desplazamiento de SNAr. Dos métodos preferidos para la funcionalización en el grupo oxi de C6 incluyen la alquil- o aril-sulfonilación del grupo oxi en C6 y la clorodesoxigenación... [Seguir leyendo]
Reivindicaciones:
1. Un método para producir 2-cloro-2'-desoxiadenosina que comprende las etapas de:
(a) convertir el grupo 6-oxo de un compuesto que tiene la fórmula en un grupo saliente en 6 que tiene suficiente reactividad para una reacción de desplazamiento de SNAr, en la que R es un grupo protector;
(b) reemplazar el grupo 2-amino con un grupo 2-cloro en una reacción de diazotización/clorodesdiazoniación;
(c) reemplazar el grupo saliente en 6 con un grupo 6-amino; y 10 (d) separar los grupos protectores R, para producir la 2-cloro-2'-desoxiadenosina.
2. El método de la reivindicación 1, en el que el grupo saliente en 6 se selecciona de un grupo 6- (oxi sustituido) y un grupo 6-cloro.
3. El método de la reivindicación 1, en el que el grupo saliente en 6 se convierte en un grupo 6- (oxi sustituido) .
5. El método de la reivindicación 2, en el que el grupo 6-oxo se convierte en un grupo 6-cloro.
6. El método de una cualquiera de las reivindicaciones 1 a 5, en donde los grupos protectores se seleccionan de acilo y sililo.
Serie Figura1
(a) TiPBS-Cl/Et3N/DMAP/CH2Cl2. (b) AcCl/BTEA-NO2/CH2Cl2-5 a 0 ºC.
(c) NH3/MeOH/CH2Cl2/.. (d) POCl3/BTEA-CL/N, N-dimetilanilina/MeCN/..
a ó b ó c (8)
d (9)
Figura 2
(a) TMS-Cl/BTEA-NO2/CH2Cl2 (83 %) ; (b) TMS-Cl/BTEA-NO2/NaNO2/CH2Cl2 (86 %) ;
(c) AcCl/BTEA-NO2 /CH2Cl2/0-5 ºC (84 %) ; (d) TMS-Br/TBN/CH2Br2 (85 %)
Patentes similares o relacionadas:
Compuesto de tioéter para la protección del grupo 2''-hidroxi en nucleósidos que van a ser utilizados en la síntesis de oligonucleótidos, del 6 de Mayo de 2020, de Bonac Corporation: Un éter representado por la siguiente fórmula química : **(Ver fórmula)** en dicha fórmula química , R4 es un grupo alquilo de cadena lineal o ramificada […]
Derivados de nucleósidos sustituidos útiles como agentes anticancerosos, del 15 de Abril de 2020, de PFIZER INC.: Un compuesto de fórmula (II): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: R1 se selecciona entre el grupo […]
Análogos de S-adenosil-L-cisteína como cofactores para metiltransferasas, del 11 de Diciembre de 2019, de KATHOLIEKE UNIVERSITEIT LEUVEN: Un compuesto representado por la fórmula (I) **(Ver fórmula)** en donde R1 es COOH o COO-; X es un anión orgánico o inorgánico que lleva una o más […]
Compuestos de doble acción que se dirigen al receptor A2A de adenosina y al transportador de adenosina para la prevención y el tratamiento de enfermedades neurodegenerativas, del 11 de Octubre de 2017, de ACADEMIA SINICA: Una composición que comprende una cantidad eficaz de un compuesto de fórmula:**Fórmula** en donde n es 1 a 3, el heterociclo (sustituido) […]
Nuevos análogos de nucleósidos y oligonucleótidos, del 6 de Septiembre de 2017, de DAIICHI SANKYO COMPANY, LIMITED: Un compuesto de fórmula : en qué: R1 y R2 son iguales o diferentes y representan un átomo de hidrógeno, un grupo hidroxilo protector, un grupo […]
Fosforamidatos de nucleósidos para producir ácidos nucleicos, del 31 de Mayo de 2017, de Bonac Corporation: Un compuesto de glucósido representado por la siguiente fórmula química , uno de sus enantiómeros, uno de sus tautómeros o estereoisómeros o una de […]
Procedimiento de obtención de 4-N-furfurilcitosina y/o sus derivados, composición antienvejecimiento y utilización de 4-N-furfurilcitosina y/o sus derivados en la fabricación de una composición antienvejecimiento, del 12 de Octubre de 2016, de INSTYTUT CHEMII BIOORGANICZNEJ PAN: Composición antienvejecimiento, caracterizada por que contiene 4-N-furfurilcitosina y/o sus derivados, de la fórmula general**Fórmula** en la que: […]
Proceso para preparar un agonista de receptor de adenosina A2A y sus polimorfos, del 22 de Junio de 2016, de GILEAD SCIENCES, INC.: Un método para la preparación a gran escala de (1-{9-[(4S,2R,3R,5R)-3,4-dihidroxi-5-(hidroximetil)oxolan-2-il]-6- aminopurin-2-il}pirazol-4-il)-N-metilcarboxamida:**Fórmula** […]