DIFERENCIACIÓN DE CÉLULAS ESTROMALES ADIPOSAS EN OSTEOBLASTOS Y SUS USOS.
Un método para diferenciar células estromales adiposas en osteoblastos,
que comprende: cultivar dichas células en una composición que comprende un medio capaz de sustentar el crecimiento de fibroblastos y cantidades que inducen la diferenciación de β-glicerofosfato y ácido ascórbico y/o ascórbico-2-fosfato
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US1998/025449.
Solicitante: ARTECEL SCIENCES, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: HQ GLOBAL WORKPLACES 4819 EMPEROR BOULEVARD DURHAM, NC 27703 ESTADOS UNIDOS DE AMERICA.
Inventor/es: HALVORSEN,YUAN-DI,C.
Fecha de Publicación: .
Fecha Solicitud PCT: 1 de Diciembre de 1998.
Fecha Concesión Europea: 18 de Agosto de 2010.
Clasificación Internacional de Patentes:
- C12N5/06B18
Clasificación PCT:
- A61K35/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sustancias procedentes de mamíferos; Composiciones que comprenden tejidos o células indeterminadas; Composiciones que comprenden células madre no embrionarias; Células modificadas genéticamente (vacunas o preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00).
- C12N5/07 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células o tejidos animales.
- C12N5/10 C12N 5/00 […] › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Clasificación antigua:
- A61K35/12 A61K 35/00 […] › Sustancias procedentes de mamíferos; Composiciones que comprenden tejidos o células indeterminadas; Composiciones que comprenden células madre no embrionarias; Células modificadas genéticamente (vacunas o preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00).
- C12N5/06
- C12N5/10 C12N 5/00 […] › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia, Chipre.
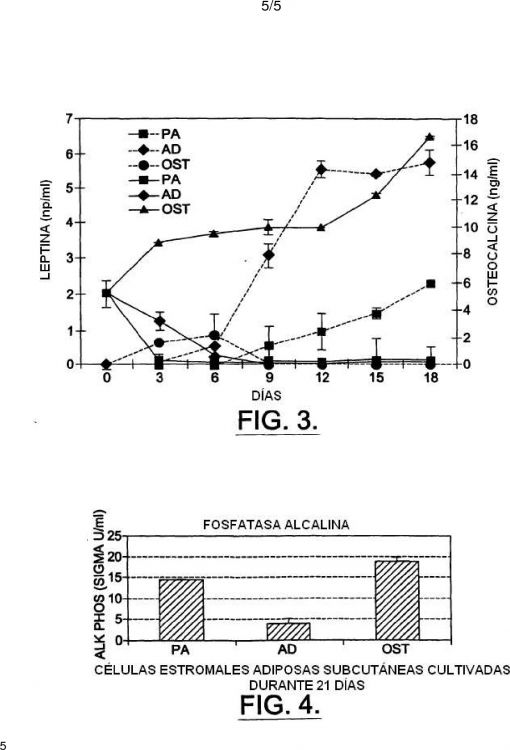
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
Esta invención se refiere a métodos y composiciones para la diferenciación de células estromales de tejido adiposo en osteoblastos, y a los usos de éstos.
ANTECEDENTES DE LA INVENCIÓN
La osteoporosis es responsable de aproximadamente 1,5 millones de fracturas cada año en los Estados Unidos, de las que aproximadamente 300.000 son fracturas de cadera. Cincuenta a 75% de los pacientes con fracturas de cadera son incapaces de vivir independientemente, lo que resulta en unos costes médicos incrementados. La osteoporosis se caracteriza por una pérdida de la densidad ósea mayor de la normal al envejecer la población. Esta enfermedad ocurre con una alta frecuencia (>30% de mujeres con edad superior a 60) en las culturas Occidental y Asiática, y su predominio está aumentando al aumentar la longevidad. Aunque se desconoce la causa exacta de estos trastornos de reparación ósea, está claro que el proceso dinámico de la remodelación ósea está alterado en un proceso caracterizado por una disminución de la actividad osteoblástica (células productoras de hueso) y un incremento de la actividad osteoclástica (células que degradan el hueso) (Parfitt (1992) Triangle 31:99-110; Parfitt (1992) En Bone, volumen 1, B.K. Hall, ed. Teleford Press and CRC Press, Boca Raton, FL, p. 351-429).
El uso de injertos de hueso es una práctica convencional en ortopedia, neurocirugía y odontología, así como en la cirugía plástica/de reconstrucción y la frecuencia de esta utilización ha ido creciendo en las últimas dos décadas. Con la excepción de la sangre, el hueso es el tejido más frecuentemente transplantado con una estimación de 500.000 injertos de hueso usados en EEUU anualmente. Los usos ortopédicos comunes de los injertos de hueso incluyen la gestión de no uniones y fractura de hueso largo aguda, reconstrucción de articulaciones y para facilitar la fusión de segmentos vertebrales de movimiento para tratar varios trastornos espinales (Lane (1987) Ortho Clin N Amer 18:213-225).
Actualmente, el material de injerto más aceptable clínicamente es el hueso autólogo. Los denominados autoinjertos se obtienen habitualmente de un sitio operativo secundario. Existen cuestiones significativas asociadas con los autoinjertos. Éstas incluyen ausencia de un suministro adecuado para heridas o defectos grandes. En los individuos ancianos con osteoporosis u osteopenia el uso de un autoinjerto es problemático. La morbilidad secundaria asociada con la operación de recogida es alta. Estas complicaciones incluyen infecciones, inestabilidad pélvica (el hueso se recoge habitualmente de la cresta ilíaca), hematoma y fractura pélvica (Laurie et al. (1984) Plas Rec Surg 73:933-938; Summers et al. (1989) J Bone Joint Surg 71B:677-680; Younger et al. (1989) J Orthop Trauma. 3:192-195; Kurz et al. (1989) Spine 14:1324-1331). Además, el dolor crónico en el sitio de la donación es la segunda complicación más frecuentemente indicada (Turner et al. (1992) JAMA 268:907-911). Finalmente, la capacidad de moldear el autoinjerto al sitio del defecto/herida está limitada debido a la naturaleza rígida del material.
Las investigaciones recientes se han centrado en el uso de varias matrices, bien inorgánicas tales como hidroxiapatito (Flatley et al. (1983) Clin Orthop Rel Res 179:246252; Shima et al. (1979) J Neurosurg 51:533-538; Whitehill et al. (1985) Spine 10:32-41; Herron et al. (1989) Spine 14:496-500; Cook et al. (1986) Spine 11:305-309) u orgánicas tales como matriz ósea desmineralizada (DBM) (revisado en Ashay et al. (1995) Am J Orthop 24:752-761; cuyos contenidos se incorporan en la presente memoria por referencia). Se piensa que estas matrices son osteoconductoras (facilitan la invasión de las células formadoras de hueso en una matriz inerte) u osteoinductoras (inducen la transformación de las células precursoras reclutadas a osteoblastos). Se han observado varios resultados clínicos exitosos con algunos de estos productos aprobados para usarse clínicamente por la Food and Drug Administration. A pesar de estos éxitos, permanecen varias cuestiones respecto a la utilidad de estas matrices. La primera es la respuesta variable del sujeto a DBM. Además estas matrices tardan mucho más tiempo que el transplante de hueso autólogo en desarrollar una integridad estructural significativa y aguantar carga eficazmente.
Una alternativa al transplante y al uso de matrices simples es la mezcla de médula ósea o células estromales de médula ósea con DBM. Idealmente, las células y DBM se obtendrán del mismo sujeto aunque ya se ha usado clínicamente DBM alogénica con un éxito inicial (Mulliken et al. (1981) Ann Surg 194:366-372; Kaban et al. (1982) J Oral Maxillofac Surg 40:623-626). Los métodos de transplante usando células de médula ósea autóloga con DBM alogénica han rendido buenos resultados (Connolly (1995) Clin Orthop 313:8-18). Sin embargo, las cuestiones que pueden afectar el uso amplio de estas técnicas incluyen el potencial de contaminación por materiales no propios, la aceptabilidad
del paciente para donar médula ósea, y las complicaciones potenciales que surgen de las aspiraciones de médula ósea y la depleción de médula ósea de la fuente. Varios grupos han mostrado que las células estromales de médula ósea y las líneas celulares derivadas de éstas son capaces de diferenciarse en células bioquímicamente y morfológicamente similares a los osteoblastos (Dorheim et al. (1993) J Cell Physiol 154:317-328; Grigoriadis et al. (1988) J Cell Biol 106:2139-2151; Benayahu et al. (1991) Calcif Tiss Int. 49:202-207; cuyos contenidos se incorporan por referencia). En la mayor parte de los casos, las células semejantes a fibroblastos se aislaron de médula ósea humana o animal y se plaquearon en material de cultivo de tejidos estándar. Generalmente, se usa una formulación de medio estándar, tal como Medio Eagle Modificado por Dulbecco (DMEM) más suero fetal de ternera 10-20% y antibióticos, para seleccionar el enriquecimiento de estas células (Ashton et al. (1980) Clin Orthop 151:294307; Sonis et al. (1983) J Oral Med 3:117-120). Las células se estimularon para que se diferenciaran en osteoblastos cambiando el medio a uno que contiene 5-20% de suero fetal de ternera, 2-20 mM º-glicerofosfato y 20-75 µM ácido ascórbico o ascórbico-2fosfato (Asahina et al. (1996) Exp Cell Res 222:38-47; Yamaguchi et al. (1991) Calcif Tissue Int 49:221-225). Después de 14-21 días en cultivo, muchos de estos tipos celulares y líneas celulares mineralizarán matrices en el material de cultivo como se manifiesta por la tinción positiva de von Kossa. Otros indicadores fenotípicos del linaje osteoblasto incluyen actividad fosfatasa alcalina secretada elevada; la presencia de osteocalcina secretada en el medio; y la expresión incrementada de varios genes que se piensa que se expresan específicamente en los osteoblastos, incluyendo osteocalcina, osteopontina y sialoproteína ósea (Stein et al. (1990) FASEB J 4:3111-3123; Dorheim et al. (1993) J Cell Physiol 154:317-328; Asahina et al. (1996) Exp Cell Res 222:38-47;
25 Yamaguchi et al. (1991) Calcif Tissue Int 49:221-225). Ha habido varios estudios detallados realizados en varios laboratorios que demuestran que las células estromales de médula ósea transplantadas pueden formar hueso ectópico (Gundle et al. (1995) Bone 16:597-603; Haynesworth et al. (1992) Bone 13:81-89; Boynton et al. (1996) Bone 18:321-329). Por ejemplo, se han transplantado fibroblastos estromales de médula ósea humana y murina en ratones SCID inmunodeficientes (Krebsbach et al. (1997) Transplantation 63:1059-1069; Kuznetsov et al. (1997) J Bone Min Res 12:1335-1347). Usando anticuerpos y marcadores histoquímicos, se demostró que las células estromales de médula ósea del donante justificaban los osteoblastos recién desarrollados en sitios de formación de hueso ectópico en presencia de una matriz inductora. Las células murinas formaban hueso en presencia de partículas de hidroxiapatito/fosfato de tricalcio (HA/TCP), gelatina, poli-L-lisina y colágeno. Por el contrario, las células estromales humanas formaban hueso sólo en presencia de HA/TCP. No se requirió BMP exógeno en estos estudios.
La formación del hueso no está limitada al esqueleto. Por ejemplo, la introducción de matriz ósea cerámica o desmineralizada en sitios intramusculares, capsulares subrenales o subcutáneos resultará en la formación de hueso si el área expresa simultáneamente proteína morfogenética ósea (Urist (1965) Science 150:893-899). Estos resultados sugieren que las células presentes en estos tejidos tienen alguna capacidad para formar células...
Reivindicaciones:
1. Un método para diferenciar células estromales adiposas en osteoblastos, que comprende: cultivar dichas células en una composición que comprende un medio capaz de sustentar el crecimiento de fibroblastos y cantidades que inducen la diferenciación de
º-glicerofosfato y ácido ascórbico y/o ascórbico-2-fosfato.
2. Un método según la reivindicación 1 en el que dichas cantidades son 2-20 mM
º-glicerofosfato y 20-75 µM ácido ascórbico y/o ascórbico-2-fosfato; preferiblemente 5-1 mM º-glicerofosfato y aproximadamente 40-60 µM ácido ascórbico y/o ascórbico-2fosfato; más preferiblemente aproximadamente 10 mM º-glicerofosfato y aproximadamente 50 µM ácido ascórbico y/o ascórbico-2-fosfato.
3. Un método según la reivindicación 1 en el que dicho medio es DMEM, ºMEM o BME.
4. Un método según la reivindicación 1 en el que dicho medio comprende además 5-20% suero fetal de ternera; o una o más proteínas morfogenéticas óseas.
5. Un método según la reivindicación 1 en el que dichas células son células de mamífero.
6. Un método según la reivindicación 5 en el que dichas células son células humanas.
7. Una composición que comprende células estromales adiposas, un medio capaz de sustentar el crecimiento de fibroblastos y cantidades de º-glicerofosfato y ácido ascórbico y/o ascórbico-2-fosfato suficientes para inducir la diferenciación de dichas células estromales en osteoblastos.
8. Una composición según la reivindicación 7 en la que dichas cantidades son como se han definido en la reivindicación 2 ó 4.
9. Una composición según la reivindicación 8 en la que dichas células estromales son células estromales humanas.
Patentes similares o relacionadas:
PROCEDIMIENTO PARA LA PROLIFERACIÓN DE CÉLULAS, del 16 de Enero de 2012, de BIOIBERICA, S.A.: Procedimiento in vitro para la proliferación de condrocitos, que comprende la etapa de poner en contacto dichos condrocitos con un aminoazúcar seleccionado de entre el grupo que […]
COMPOSICIÓN DE FORMACIÓN OSEA COMPUESTA DE MEZCLA DE OSTEOBLASTO Y BIOMATRIZ Y SU PROCEDIMIENTO DE FABRICACIÓN, del 21 de Junio de 2011, de SEWON CELLONTECH CO., LTD: Una composición para la formación ósea preparada mediante el procedimiento para la preparación de una composición para la formación ósea usando una […]
 REGENERACION E INCREMENTO DE HUESO UTILIZANDO CELULAS MADRE MESENQUIMALES, del 2 de Diciembre de 2009, de OSIRIS THERAPEUTICS, INC.: SE PRESENTAN COMPOSICIONES Y METODOS PARA ACRECENTAR LA FORMACION DE HUESOS A BASE DE ADMINISTRAR CELULAS MADRE MESENQUIMATOSAS HUMANAS AISLADAS (HMSCS) CON UN MATERIAL […]
REGENERACION E INCREMENTO DE HUESO UTILIZANDO CELULAS MADRE MESENQUIMALES, del 2 de Diciembre de 2009, de OSIRIS THERAPEUTICS, INC.: SE PRESENTAN COMPOSICIONES Y METODOS PARA ACRECENTAR LA FORMACION DE HUESOS A BASE DE ADMINISTRAR CELULAS MADRE MESENQUIMATOSAS HUMANAS AISLADAS (HMSCS) CON UN MATERIAL […]
 POBLACIONES DE CELULAS PROGENITORAS, EXPANSION DE LAS MISMAS Y CRECIMIENTO DE TIPOS DE CELULAS NO HEMATOPOYETICAS Y TEJIDOS PROVENIENTES DE LAS MISMAS, del 13 de Noviembre de 2009, de BAKSH, DOLORES
DAVIES, JOHN E.
ZANDSTRA, PETER: Método para expandir células progenitoras no hematopoyéticas humanas, comprendiendo dicho método la etapa de someter una población de células […]
POBLACIONES DE CELULAS PROGENITORAS, EXPANSION DE LAS MISMAS Y CRECIMIENTO DE TIPOS DE CELULAS NO HEMATOPOYETICAS Y TEJIDOS PROVENIENTES DE LAS MISMAS, del 13 de Noviembre de 2009, de BAKSH, DOLORES
DAVIES, JOHN E.
ZANDSTRA, PETER: Método para expandir células progenitoras no hematopoyéticas humanas, comprendiendo dicho método la etapa de someter una población de células […]
Método y medios para purificar vectores retrovíricos, del 29 de Julio de 2020, de Autolus Limited: Una célula productora de retrovirus que expresa una proteína de marcaje en la superficie celular, de tal manera que los vectores retrovíricos producidos por la célula se […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Marcador de células endoteliales corneales, del 17 de Junio de 2020, de OSAKA UNIVERSITY: Método para producir una célula endotelial corneal, comprendiendo el método la etapa de clasificar, a partir de una población celular que comprende una célula […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]