PROCEDIMIENTO DE DETERMINACIÓN DE UNA ACTIVIDAD DE ENZIMA ENDOGLICOSIDASA (HEPARANASA).
Procedimiento para la determinación de actividad de enzima endoglicosidasa,
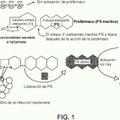
que comprende las etapas siguientes: i. poner un sustrato de endoglicosidasa en contacto con una muestra que contiene endoglicosidasa bajo condiciones suficientes para la degradación del sustrato por la endoglicosidasa. ii. separar los productos de degradación del sustrato no degradado o parcialmente degradado mediante la unión del sustrato no degradado o parcialmente degradado a una proteína de unión a heparán sulfato unida a una fase sólida, preferentemente, a la protamina proteína policatiónica. iii. medir la reducción de sustrato intacto relacionada con la actividad endoglicosidasa en la muestra. en el que el sustrato es marcado directa o indirectamente con un primer miembro de un par ligando/receptor, y la cantidad de sustrato intacto se determina midiendo una señal emitida por el sistema de detección, unido al segundo miembro del par ligando receptor
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/008905.
Solicitante: HAUBECK, HANS-DIETER.
Nacionalidad solicitante: Alemania.
Dirección: ERNST-LUDWIG-STRASSE 71 55435 GAU-ALGESHEIM ALEMANIA.
Inventor/es: HAUBECK, HANS-DIETER, DR.
Fecha de Publicación: .
Fecha Solicitud PCT: 13 de Octubre de 2007.
Fecha Concesión Europea: 11 de Agosto de 2010.
Clasificación Internacional de Patentes:
- C12Q1/34 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que interviene una hidrolasa.
Clasificación PCT:
- C12Q1/34 C12Q 1/00 […] › en los que interviene una hidrolasa.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
Fragmento de la descripción:
Campo y estado de la técnica
La presente invención se refiere a un procedimiento para la determinación de actividad de enzima endoglicosidasa, en particular, del tipo heparanasa, en una muestra, y en una realización preferente, a un procedimiento para la detección de compuestos capaces de modular la actividad de una endoglicosidasa y, en particular, de una endoglicosidasa que tiene actividad del tipo heparanasa.
Las endoglicosidasas son enzimas capaces de catalizar reacciones de escisión dentro de cadenas glicosídicas.
La heparanasa es una enzima capaz de escindir polímeros que comprenden unidades glicosaminoglicano (GAG), tales como, por ejemplo, glicosaminoglicanos heparán sulfato (GSGAG o HS).
Los proteoglicanos heparán sulfato (HS-PG) son macromoléculas complejas asociadas con la superficie celular de la matriz extracelular (ECM) de una amplia variedad de tejidos y células de origen humano y no humano (David G. FASEB J. 7: 1023-1030, 1993; Bernfield M. et al., Ann. Rev. Cell Biol. 8: 365-393, 1992; Bernfield M. et al., Ann. Rev. Biochem. 68: 729777, 1999; David G. et al., Matrix Biol. 17:461-463, 1998; Kjellen L. et al. Annu. Rev. Biochem.
60: 443-475, 1991; Esko J. et al., Clin. Invest. 108:169-173, 2001; Kuschert G.S. et al., Biochemistry 38:12959-12968, 1999).
La estructura principal de HS-PG consiste en una proteína núcleo, a la cual están fijadas covalentemente una o varias cadenas heparán sulfato. Las cadenas polisacáridas lineales consisten generalmente en subunidades disacáridas repetidas compuestas de ácido L-idurónico (o como alternativa, ácido glucurónico) y glucosamina. Estos disacáridos son sustituidos en un grado variable con grupos sulfato enlazados con N u O y residuos acetilo enlazados con N. El patrón de sustitución, resultante de la actividad de varias enzimas (por ejemplo, C5-epimerasa, 2-O-sulfotransferasa, 6-O-sulfotransferasa, 3-O-sulfotransferasa, Ndeacetilasa / N-sulfotransferasa, etc.), conduce, al menos en parte de una manera no aleatoria, a la formación de una estructura de dominio dentro de la cadena HS que permite la interacción específica con un gran número de ligandos, tales como factores de crecimiento, quimiocinas, etc. (Esko J. et al., Annu.Rev. Biochem. 71: 435-471, 2002; Handel T.M., Annu. Rev. Biochem. 74:385-410, 2005; Lindahl U. et.al., J. Biol. Chem. 259:12368-12376, 1984). Las cadenas HS pueden exhibir una gran diversidad, debido al número variable de unidades disacáridas y a su secuencia (resultante de las diferentes sustituciones que conducen a una estructura de dominio), que puede diferir de una cadena a otra. La heparina tiene la misma estructura disacárida básica que HS, pero difiere de HS en que está más altamente sulfatada y contiene más ácido idurónico de variante isomérica (David G. FASEB J. 7:1023-1030, 1993; Bernfield M. et al., Ann. Rev. Cell Biol. 8: 365-393, 1992; Bernfield M. et al., Ann. Rev. Biochem. 68: 729777, 1999; David G. et al., Matrix Biol. 17:461-463, 1998; Kjellen L. et al., Annu. Rev. Biochem.
60: 443-475, 1991; Esko J. et al., Clin. Invest. 108:169-173, 2001; Kuschert G.S. et al., Biochemistry 38:12959-12968, 1999, Esko J. et al., Annu. Rev. Biochem. 71: 435-471, 2002; Handel T.M. et al., Annu. Rev. Biochem. 74:385-410, 2005).
La ECM de los diversos tejidos está compuesta de una variedad de proteínas matriz, por ejemplo, diferentes tipos de colágenos, etc., y diferentes proteoglicanos, que resultan en una arquitectura de tejido compleja.
La membrana base (lámina basal) está compuesta de una red compleja de diferentes tipos de laminina, nidogen y colágeno de tipo IV, que interactúan con las cadenas HS altamente cargadas de diferentes proteoglicanos heparán sulfato integrados en esta red (Paulsson M. Crit. Rev. Biochem. Mol. Biol. 27: 93-107, 1992; Timpl R., et al. Matrix Biol. 14: 275-281, 1994; Timpl R. Curr. Opin. Cell. Biol. 8:618-624, 1996; Groffen A.J., Nephrol. Dial. Transplant. 14, 2119-2129, 1999; Yurchenko P.D., FASEB J. 4: 1577-1590,1990; Colognato H. et al. J. Cell Biol. 145, 619-31, 1999).
HS-PG participa en muchas funciones biológicas, incluyendo organogénesis y control del crecimiento, adhesión celular y migración, señalamiento, inflamación, cicatrización de heridas, angiogénesis, invasión tumoral y metástasis (David G. FASEB J. 7: 1023-1030, 1993; Bernfield
M. et al., Ann. Rev. Cell Biol. 8: 365-393, 1992; Bernfield M. et al., Ann. Rev. Biochem. 68: 729777, 1999; David G. et al., Matrix Biol. 17:461-463, 1998; Kjellen L. et al., Annu. Rev. Biochem.
60: 443-475, 1991; Esko J. et al., Clin. Invest. 108:169-173, 2001; Kuschert G.S. et al., Biochemistry 38:12959-12968, 1999, Esko J. et al., Annu. Rev. Biochem. 71: 435-471, 2002; Handel T.M. et al., Annu. Rev. Biochem. 74:385-410, 2005, Lindahl U. et.al., J. Biol. Chem. 259:12368-12376,1984).
La escisión de GAG por endoglicosidasas, por ejemplo enzimas que tienen actividad del tipo heparanasa, participa en la degradación local y en el remodelado de la ECM en todos los procesos descritos anteriormente [0008]. Un importante mecanismo de estos procesos es la liberación de citocinas enlazadas a HS, quimiocinas, factores de crecimiento, etc., por escisión de cadenas GAG, especialmente del tipo HS (Roberts R. et al., Nature 332, 376-378, 1988; Saksela O. et al., J. Cell Biol. 107, 743-751, 1988).
La heparanasa, por ejemplo, producida por plaquetas, células inflamatorias o células tumorales, puede contribuir a la degradación local de la membrana base y facilitar, de esta manera, la migración celular y el paso a través de la pared de los vasos sanguíneos (Roberts
R. et al., Nature 332, 376-378, 1988; Saksela O. et al., J. Cell Biol. 107, 743-751, 1988). En este proceso puede haber también otras enzimas implicadas, tales como metaloproteinasas de matriz. Aunque normalmente este mecanismo permite que células inflamatorias, tales como neutrófilos, lleguen al sitio de inflamación dentro de un tejido, el mismo mecanismo es usado por las células tumorales para producir los focos metastáticos.
La escisión de GAG por endoglicosidasas no está restringida al paso de la membrana base, sino, por ejemplo, es un proceso principal de invasión tisular por células tumorales (Vlodavsky I. et al., J. Clin. Invest. 108:341-347, 2001; Parish C.R.et al., Biochim Biophys Acta 1471, 99-108, 2001; Vlodavsky I. et al., Cancer Biol. 12: 121-129, 2002).
Se ha informado de actividad heparanasa en diversos tipos de células y tejidos, incluyendo células hepáticas, placentarias, linfocitos T activados, linfocitos B, neutrófilos y monocitos, plaquetas, fibroblastos y células endoteliales de cordón umbilical (Vlodavsky I. et al., J. Clin. Invest. 108:341-347, 2001; Parish C.R.et al., Biochim Biophys Acta 1471, 99-108, 2001; Vlodavsky I. et al., Cancer Biol. 12: 121-129, 2002; Oldberg A. et al., Biochemistry 19: 5755-5762, 1980; Freeman C. et al., Biochem. J. 330:1341-1350, 1998).
La heparanasa ha sido aislada y purificada a partir de varias fuentes, tales como plaquetas humanas, por diferentes grupos de investigación (Vlodavsky I. et al., J. Clin. Invest. 108:341-347, 2001; Parish C.R.et al., Biochim Biophys Acta 1471, 99-108, 2001; Vlodavsky I. et al., Cancer Biol. 12: 121-129, 2002; Oldberg A. et al., Biochemistry 19: 5755-5762, 1980; Freeman C. et al., Biochem. J. 330:1341-1350, 1998).
La heparanasa ha sido clonada a partir de diversas fuentes por diferentes grupos de investigación (Vlodavsky I. et al. Nature Med. 5:793-802, 1999; Hulett M.D., Nature Med. 5: 803-809, 1999; Kussie P.H., Biochem. Biophys. Res. Commun. 261: 183-187, 1999; Toyoshima M.T., J. Biol. Chem. 274:24153-160, 1999). Por ejemplo, la heparanasa humana fue clonada a partir de placenta humana y una línea celular de hepatoma humano (Vlodavsky I. et al. Nature Med. 5:793-802, 1999). La identificación de una única heparanasa funcional es de la mayor importancia para el desarrollo de fármacos. (Vlodavsky I. et al., J. Clin. Invest. 108:341-347, 2001; Parish C.R.et al., Biochim Biophys Acta 1471, 99-108, 2001; Vlodavsky I. et al., Cancer Biol. 12: 121-129, 2002; Vlodavsky I. et al. Nature Med. 5: 793-802, 1999; Hulett M.D., Nature Med. 5: 803-809, 1999; Kussie P.H., Biochem. Biophys. Res. Commun. 261:183-187, 1999; Toyoshima M.T., J. Biol. Chem. 274: 24153-160, 1999; Zcharia E., FASEB J. 18: 211-221, 2005).
La caracterización de la enzima purificada y clonada ha demostrado que la heparanasa es sintetizada como un precursor inactivo de 65 kDa que es sometido a escisión proteolítica, proporcionando...
Reivindicaciones:
1. Procedimiento para la determinación de actividad de enzima endoglicosidasa, que comprende las etapas siguientes:
i. poner un sustrato de endoglicosidasa en contacto con una muestra que contiene endoglicosidasa bajo condiciones suficientes para la degradación del sustrato por la endoglicosidasa.
ii. separar los productos de degradación del sustrato no degradado o parcialmente degradado mediante la unión del sustrato no degradado o parcialmente degradado a una proteína de unión a heparán sulfato unida a una fase sólida, preferentemente, a la protamina proteína policatiónica.
iii. medir la reducción de sustrato intacto relacionada con la actividad endoglicosidasa en la muestra.
en el que el sustrato es marcado directa o indirectamente con un primer miembro de un par ligando/receptor, y la cantidad de sustrato intacto se determina midiendo una señal emitida por el sistema de detección, unido al segundo miembro del par ligando receptor.
2. Procedimiento según la reivindicación 1, caracterizado porque el primer miembro del par ligando/receptor es biotina y el segundo miembro del par ligando receptor es avidina
o estreptavidina acoplada a una enzima como parte del sistema de detección, o porque el par ligando/receptor es seleccionado de entre los pares hapteno / anticuerpo: DNP / anticuerpo anti-DNP; GST / anticuerpo anti-GST; 6HIS / anticuerpo anti-6HIS; c-myc / anticuerpo anti-c-myc; FLAG(R) / anticuerpo anti-FLAR(R); HA / anticuerpo anti-HA;
3. Procedimiento según las reivindicaciones 1 ó 2, en el que dicha muestra es un extracto de tejidos o células, sangre entera, suero, plasma, fluido cerebroespinal.
4. Procedimiento según cualquiera de las reivindicaciones 1 a 3, para la detección de un compuesto capaz de modular una actividad de enzima endoglicosidasa, que comprende además la etapa siguiente:
iv. comparar el cambio en la cantidad del sustrato unido medida en ausencia del compuesto de ensayo con la medida en presencia del compuesto de ensayo.
5. Procedimiento según cualquiera de las reivindicaciones 1 a 4, en el que la
endoglicosidasa es una enzima del tipo heparanasa, seleccionada de entre heparanasa recombinante, heparanasa purificada y heparanasa no purificada, preferentemente la enzima es proporcionada en al menos una forma parcialmente purificada.
6. Procedimiento según cualquiera de las reivindicaciones 1 a 5, en el que el sustrato es seleccionado de entre proteoglicanos heparán sulfato, heparán sulfatos asociados a matriz extracelular, heparina y heparán sulfatos o sus derivados respectivos.
7. Procedimiento según cualquiera de las reivindicaciones 1 a 6, en el que la proteína de unión a heparán sulfato es seleccionada de entre protamina u otros miembros de la familia de proteínas similares a protamina, ricas en arginina, de la familia de las histonas, y en el que estas proteínas de unión son proteínas naturales, purificadas a partir de esperma de diferentes especies, formas de bajo peso molecular de estas proteínas, derivadas por ejemplo mediante escisión proteolítica, péptidos o proteínas recombinantes.
8. Procedimiento según la reivindicación 6 ó 7, en el que el sustrato está fijado covalentemente a un primer miembro del par ligando/receptor y el segundo miembro está acoplado a una enzima como parte de un sistema de detección.
9. Procedimiento según la reivindicación 8, en el que el segundo miembro del par ligando/receptor está marcado con un marcador fluorescente, quimioluminiscente o electroquimioluminiscente.
10. Procedimiento según la reivindicación 6 ó 7, en el que el sustrato está fijado covalentemente a un compuesto fluorescente, quimioluminiscente o electroquimioluminiscente y la señal de fluorescencia o luminiscencia del sustrato unido a la proteína de unión a heparán sulfato es medida directamente.
11. Procedimiento para la detección de un compuesto capaz de modular una actividad de enzima del tipo heparanasa según la reivindicación 4, en el que dicho compuesto es seleccionado de entre anticuerpos anti-heparanasa, productos naturales, productos sintéticos, productos de una biblioteca de compuestos obtenidos mediante química combinatoria, péptidos y proteínas.
12. Kit para llevar a cabo los procedimientos según cualquiera de las reivindicaciones 1 a 11, que comprende los componentes siguientes:
(a) Un sustrato que puede ser escindido por una enzima que tiene actividad heparanasa, en particular, HS-(GAG) o péptido-HS (GAG), marcado con un primer miembro de un par receptor/ligando.
(b) Heparanasa, preferentemente heparanasa recombinante, heparanasa purificada o
heparanasa no purificada.
(c) Un sistema de detección que comprende: el segundo miembro del par receptor/ligando, acoplado a una enzima, preferentemente avidina-peroxidasa o estreptavidina-peroxidasa; y un sustrato adecuado.
5 (d) Una proteína de unión a heparán sulfato, unida a una fase sólida.
13. Kit para la medición de actividad heparanasa según la reivindicación 12, que comprende: -heparán sulfato, preferentemente péptido-HS, marcado con biotina; -avidina o estreptavidina acoplada a peroxidasa, y un sustrato de peroxidasa; -una fase sólida recubierta con protamina, preferentemente una microplaca.
14. Kit para el ensayo de potenciales moduladores de actividad heparanasa según las 15 reivindicaciones 12 ó 13, que comprende:
- heparán sulfato, preferentemente péptido-HS, marcado con biotina; -avidina o estreptavidina acoplada a peroxidasa, y un sustrato de peroxidasa; -heparanasa seleccionada de entre heparanasa recombinante, heparanasa
20 purificada y heparanasa no purificada; -una fase sólida recubierta con protamina, preferentemente una microplaca.
-
Patentes similares o relacionadas:
Sistema y dispositivos de ensayo de actividad enzimática, del 1 de Julio de 2020, de Københavns Universitet (KU): Un dispositivo de actividad enzimática adecuado para la determinación de la actividad de degradación enzimática de los biopolímeros en una muestra líquida, […]
Método mejorado para la determinación de microorganismos, del 6 de Mayo de 2020, de STORA ENSO OYJ: Un método para determinar el contenido de microorganismos en un material que comprende celulosa en la industria de la pulpa y el papel que comprende las etapas de: […]
Procedimiento rápido de detección de enzimas y de microorganismos, del 20 de Noviembre de 2019, de Bio-Rad Europe GmbH: Procedimiento de detección in vitro de una enzima de un microorganismo a partir de una muestra biológica, estando la enzima que se va a detectar seleccionada entre el grupo […]
Método para predecir la respuesta al tratamiento farmacológico con chaperona de enfermedades, del 12 de Junio de 2019, de AMICUS THERAPEUTICS, INC: Un método para recopilar una tabla de tratamiento de referencia que indica la capacidad de respuesta de una o más mutaciones específicas de […]
Método para la prueba de disolución de composiciones sólidas que contienen enzimas digestivas, del 8 de Mayo de 2019, de Allergan Pharmaceuticals International Limited: Un proceso para medir una cantidad de enzimas digestivas liberadas de una composición sólida de pancrelipasa en un medio de disolución que comprende utilizar espectroscopía […]
Método para detectar condiciones bacteriolíticas en una muestra, del 17 de Abril de 2019, de UNIVERSITAT DE BARCELONA: Un método para detectar una condición bacteriolítica seleccionada del grupo que consiste en estrés físico, la presencia de bacteriófagos, la presencia […]
Inhibidores de glicosidasa, del 27 de Febrero de 2019, de MERCK PATENT GMBH: Un medicamento que comprende un compuesto de fórmula (I)**Fórmula** en la que X1 designa S u O; X2, W designan independientemente […]
 Métodos para usar sustratos enzimáticos marcados con bodipy, del 11 de Febrero de 2019, de THE GENERAL HOSPITAL CORPORATION: Un metodo para detectar la actividad de una enzima beta-lactamasa en una muestra, que comprende:
poner en contacto la muestra con una composicion […]
Métodos para usar sustratos enzimáticos marcados con bodipy, del 11 de Febrero de 2019, de THE GENERAL HOSPITAL CORPORATION: Un metodo para detectar la actividad de una enzima beta-lactamasa en una muestra, que comprende:
poner en contacto la muestra con una composicion […]