SISTEMA DE OBTENCION DE MUESTRAS DE INHIBIDORES DE FOSFATASAS.
Un aparato para obtener una muestra biológica, que comprende: un recipiente que tiene una parte de depósito para recibir la muestra;
y al menos un agente estabilizante de proteínas que comprende como mínimo un inhibidor de fosfatasas en el depósito del recipiente
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/039969.
Solicitante: BECTON, DICKINSON AND COMPANY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1 BECTON DRIVE FRANKLIN LAKES, NJ 07417-1880 ESTADOS UNIDOS DE AMERICA.
Inventor/es: HAYWOOD,BRUCE,C.
Fecha de Publicación: .
Fecha Solicitud PCT: 30 de Noviembre de 2004.
Fecha Concesión Europea: 5 de Mayo de 2010.
Clasificación PCT:
- B01L3/00 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01L APARATOS DE LABORATORIO PARA LA QUIMICA O LA FISICA, DE USO GENERAL (aparatos de uso médico o farmacéutico A61; aparatos para aplicaciones industriales o aparatos de laboratorio cuya estructura y funciones son comparables a las de aparatos industriales similares, ver las clases relativas a los aparatos industriales, en particular las subclases B01 y C12; aparatos de separación o de destilación B01D; dispositivos de mezcla o de agitación B01F; atomizadores B05B; tamices, cribas B07B; tapones, capuchones B65D; manipulación de líquidos en general B67; bombas de vacío F04; sifones F04F 10/00; grifos, válvulas F16K; tubos, empalmes para tubos F16L; aparatos especialmente adaptados al estudio y análisis de materiales G01, particularmente G01N; aparatos eléctricos u ópticos, ver las subclases apropiadas en las secciones G y H). › Recipientes o utensilios para laboratorios, p. ej. cristalería de laboratorio (botellas B65D; equipos para enzimología o microbiología C12M 1/00 ); Cuentagotas (recipientes para volumetría G01F).
- B01L3/14 B01L […] › B01L 3/00 Recipientes o utensilios para laboratorios, p. ej. cristalería de laboratorio (botellas B65D; equipos para enzimología o microbiología C12M 1/00 ); Cuentagotas (recipientes para volumetría G01F). › Tubos de ensayo.
- C12Q1/42 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › fosfatasa.
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre.
Fragmento de la descripción:
Sistema de obtención de muestras de inhibidores de fosfatasas.
Campo pe aplicación del invento
El presente invento está dirigido a un dispositivo para obtener y estabilizar una muestra biológica, en particular una muestra de sangre completa, directamente de un paciente. Más específicamente, el presente invento se refiere a envases de obtención de muestras que tienen un aditivo de estabilización contenido en los mismos para estabilizar las proteínas inmediatamente tras la obtención de una muestra biológica y para inhibir las modificaciones de las proteínas durante el almacenamiento de las mismas.
Antecedentes del invento
Recientemente se ha incrementado de forma significativa el estudio de la proteinómica. La proteinómica podría abarcar muchos significados, pero implica considerar las proteínas, ya sea individualmente o no, más típicamente, como pautas. Por ejemplo, los investigadores están interesados en los perfiles de proteínas que podrían ser reflectores de ciertos estados de enfermedad, por ejemplo, el perfil de un individuo sano frente al perfil de un individuo enfermo podrían presenta diferencias que pueden usarse como futuros indicadores de estados de enfermedad. Como es conocido en la técnica, la espectrometría de masas es una herramienta fundamental utilizada para analizar tales perfiles. Un problema a enfrentarse en dicho estudio de proteínas estriba en las muchas modificaciones por las que pasa una proteína a lo largo de su vida, que se denominan con carácter amplio modificaciones de post-transducción. Dado que el estado de una proteína varía con el tiempo, es difícil asegurar que un perfil de un individuo sea coherente a través del tiempo. Por tanto, un perfil que se crea que es indicativo de un estado de enfermedad podría ser válido solamente para condiciones específicas, y por tanto no repetible sobre una base suficiente para servir como una herramienta de diagnóstico. En consecuencia, sería conveniente disponer de dispositivos y/o procesos capaces de aplicarse a esta variabilidad.
Sumario del invento
El mecanismo más común de comunicación entre células implica la liberación de moléculas de señalización, tales como hormonas, neurotransmisores, y factores de crecimiento, de un tipo de célula que interactúe con - y active - proteínas receptoras específicas en la superficie de las células objetivo. El receptor activado genera luego una señal intracelular que por último se acopla a procesos específicos funcionales en las células para producir una respuesta fisiológica. Los estudios de los caminos de transducción de señal que acoplan la activación del receptor a estas respuestas fisiológicas representan una de las áreas de investigación más activa e importante en la biología moderna. Los estudios de transducción de señal son fundamentales para la investigación de enfermedades, descubrimiento y desarrollo de fármacos, y diagnósticos. La fijación reversible de fosfato a residuos de serina, treonina y tirosina de las proteínas celulares es un mecanismo de control que representa un papel importante en la mayoría - si no en todos - los caminos de transducción de señal. Dos tipos de enzimas controlan la extensión y dirección de fosforilación de una proteína celular particular:
Las quinasas de proteína añaden fosfato a las proteínas (fosforilación).
Las fosfatasas de proteínas extraen el fosfato (defosforilación).
Estos efectos de camino continúan para ser activos después que se han obtenido las muestras biológicas. Sin entender estas modificaciones de variables "ex vivo" (fuera del cuerpo vivo) la extracción de fosfato, en particular, puede confundir o perturbar los resultados. Las fosfatasas de proteínas se clasifican basándose en su especifidad de sustrato, su dependencia de iones metálicos, y su sensibilidad a los agentes inhibitorios. Una clase de productos químicos, los inhibidores de fosfatasas de proteína , se usa comúnmente para limitar la extracción de grupos fosfato (los inhibidores de fosfatos de proteína se usan también para tratar enfermedades).
Existen centenares de inhibidores disponibles a través de los proveedores de productos químicos, y alguno incluso suministra combinaciones de inhibidores con cualquier cantidad desde dos a cinco inhibidores premezclados. Es un hecho desafortunado, que por el momento en que la mayoría de estos inhibidores se aplican, gran parte de la actividad que se esté estudiando es "innatural" o un artefacto ex vivo. Para ciertos estudios, es importante ser capaz de comprender el estado de las células de una manera que muy próximamente sea representativa de la fisiología ex vivo. Por esta razón, es valioso regular la defosforilación lo más cerca que sea posible del "instante cero" de la excisión o extracción del espéci- men.
El invento incluye una gama diversa de dispositivos de obtención de muestras que contienen uno o más inhibidores precargados de fosfatasas de proteínas de tal manera que, cuando el espécimen contacta con el dispositivo de obtención de muestras, entre inmediatamente en contacto con el inhibidor y se regule la actividad de la defosforilación.
Breve descripción de los dibujos
La Figura 1 es una vista en perspectiva de un tubo típico de obtención de muestras de sangre.
La Figura 2 es una vista en perspectiva de una placa de ensayos.
La Figura 3a es una vista en perspectiva de un conjunto de obtención de muestras, mientras que la Figura 3b es una vista en corte del conjunto de obtención de muestras.
La Figura 4 es una vista en corte longitudinal de una jeringuilla.
La Figura 5 es una vista en corte longitudinal de otra realización de una jeringuilla.
La Figura 6a es una vista lateral de un conjunto de catéter, mientras que la Figura 6b es una vista lateral parcial del catéter.
La Figura 7 es una vista en perspectiva de una pipeta.
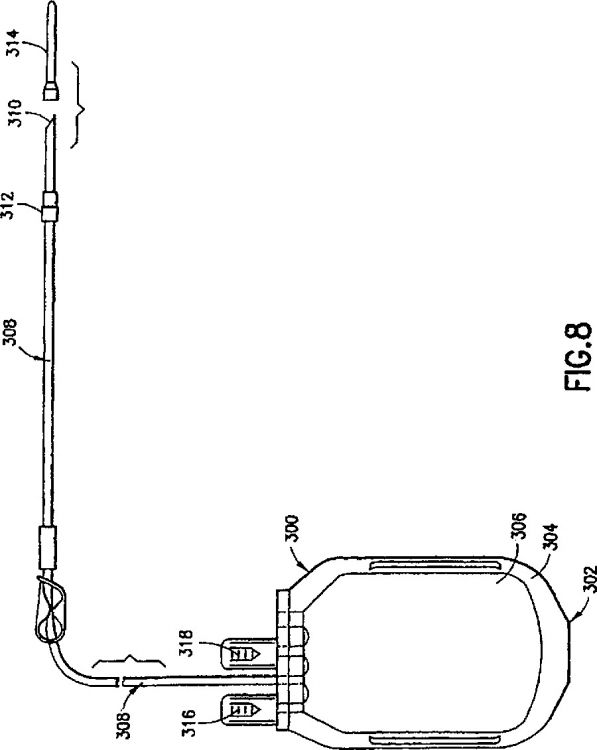
La Figura 8 es una vista en perspectiva que ilustra una bolsa de obtención de muestras de sangre.
Descripción detallada del invento
Aunque este invento se satisface mediante realizaciones en muchas modalidades diferentes, en la presente memoria se describirán con detalle realizaciones preferidas del mismo, en el entendimiento de que la presente descripción tiene que considerarse como a título de ejemplo de los principios del invento, y no está destinada a limitarlo a las realizaciones ilustradas y descritas. Los expertos en la técnica podrían realizar numerosas variaciones sin apartarse del espíritu del invento. El alcance del invento se medirá por las reivindicaciones que se adjuntan como apéndice.
El presente invento está dirigido a dispositivos para estabilizar proteínas en una muestra biológica para habilitar mejor el análisis de fase posterior. Más particularmente, el presente invento está dirigido a dispositivos para inhibir la cascada de defosforilación en una muestra biológica durante el almacenamiento. De acuerdo con el presente invento, el dispositivo comprende un recipiente que contiene una cantidad de agente estabilizante que comprende un inhibidor de fosfatasas para mezclar con una muestra biológica inmediatamente tras la obtención de la muestra.
Aunque es posible usar el presente invento con cualquier muestra biológica que contenga proteínas, preferiblemente la muestra biológica es cualquier cuerpo fluido extraído de un paciente. Con máxima preferencia, la muestra biológica es sangre completa o un componente de la misma. Ejemplos de otras muestras biológicas incluyen composiciones que contengan células tales como concentrados de células de eritrocitos, concentrados de trombocitos, concentrados de leucocitos, plasma, suero, orina, aspirados medulares, líquido cefalorraquídeo, tejido, células, heces, saliva y secreciones orales, secreciones nasales, fluido linfático y elementos similares.
El sistema de obtención de muestras del presente invento puede abarcar cualquier dispositivo de obtención de muestras incluyendo, sin carácter limitativo, tubos tales como tubos de ensayo y tubos centrífugos; dispositivos de recogida de sangre de sistema cerrado, tales como bolsas de recogida; jeringuillas, en especial jeringuillas pre-llenas; catéteres, tales como vías centrales; pocillos de microvaloración y otras placas muitipocillos; matrices; tubos; vasijas de laboratorio tales como matraces, matraces giratorios, botellas con ruedas, viales, portaobjetos de microscopio, conjuntos de portaobjetos de microscopio,...
Reivindicaciones:
1. Un aparato para obtener una muestra biológica, que comprende:
un recipiente que tiene una parte de depósito para recibir la muestra; y
al menos un agente estabilizante de proteínas que comprende como mínimo un inhibidor de fosfatasas en el depósito del recipiente.
2. El aparato de la reivindicación 1, en el que el recipiente se selecciona del grupo que consiste en tubos, dispositivos de obtención de muestras de sangre de circuito cerrado, bolsas de obtención de muestras, jeringuillas, jeringuillas pre-llenas, catéteres, pocillos de microvaloración, dispositivos de obtención de muestras con múltiples pocillos, matraces, matraces giratorios, botellas con ruedas, viales, pipetas, puntas de pipeta y recipientes de obtención de muestras de tejido y otras muestra biológicas.
3. El aparato de la reivindicación 1, en el que el recipiente es un tubo que tiene un primer extremo y un segundo extremo.
4. El aparato de la reivindicación 3, que comprende además un miembro de separación dispuesto en el recipiente.
5. El aparato de la reivindicación 4, en el que el miembro de separación es un elemento mecánico de separación.
6. El aparato de la reivindicación 5, en el que el elemento mecánico de separación está recubierto al menos en parte con el como mínimo un agente estabilizante.
7. El aparato de la reivindicación 5, en el que el elemento mecánico de separación es sustancialmente inerte con respecto al agente estabilizante.
8. El aparato de la reivindicación 4, en el que el miembro de separación es un gel.
9. El aparato de la reivindicación 8, en el que el miembro gel de separación está separado físicamente del agente estabilizante.
10. El aparato de la reivindicación 1, en el que el agente estabilizante de proteínas está en una forma seleccionada del grupo consistente en una solución, una suspensión u otro líquido, una pildorita, una tableta, una cápsula, un material desecado por aspersión, un material desecado por congelación, un polvo, una partícula, un gel, cristales o un material liofilizado.
11. El aparato de la reivindicación 10, en el que el agente estabilizante de proteínas está liofilizado.
12. El aparato de la reivindicación 1, en el que el al menos un inhibidor de fosfatasas, inhibe al menos una fosfatasa seleccionada del grupo que consiste en fosfatasa de serina, fosfatasa de treonina, y fosfatasa de tirosina.
13. El aparato de la reivindicación 1, en el que el agente estabilizante comprende además al menos un inhibidor de proteasas.
14. El aparato de la reivindicación 1, en el que el agente estabilizante comprende un cocktail de inhibidores de fosfatasas.
15. El aparato de la reivindicación 1, en el que el agente estabilizante comprende más de dos inhibidores de fosfatasas.
16. El aparato de la reivindicación 1, que comprende además un medio portador.
17. El aparato de la reivindicación 1, que comprende además un medio estabilizante.
18. El aparato de la reivindicación 17, en el que el medio estabilizante es trehalosa.
19. El aparato de la reivindicación 1, que comprende además al menos un antioxidante.
20. El aparato de la reivindicación 1, que comprende además como mínimo un agente reductor.
21. El aparato de la reivindicación 1, que comprende además un agente tampón.
22. El aparato de la reivindicación 3, en el que el primer extremo es un extremo abierto, el segundo extremo es un extremo cerrado, y que comprende además un medio de cierre para obturar el primer extremo abierto.
23. El aparato de la reivindicación 3, en el que en el tubo se ha hecho un vacío parcial.
24. El aparato de la reivindicación 3, en el que el primer extremo es un extremo abierto, el segundo extremo es un extremo abierto, y que comprende además un primer medio de cierre para obturar el primer extremo abierto y un segundo medio de cierre para obturar el segundo extremo abierto.
25. El aparato de la reivindicación 3, en el que el agente estabilizante de proteínas está liofilizado.
26. El aparato de la reivindicación 25, en el que el agente estabilizante de proteínas comprende más de dos inhibidores de fosfatasas.
27. El aparato de la reivindicación 25, en el que el tubo comprende además un anticoagulante.
28. El aparato de la reivindicación 27, en el que el anticoagulante se ha desecado por aspersión en al menos una parte de una pared interior.
29. El aparato de la reivindicación 27, en el que el anticoagulante comprende una sal de ácido etilendiaminotetraacético (en adelante EDTA).
30. El aparato de la reivindicación 27, en el que el anticoagulante comprende heparina.
Patentes similares o relacionadas:
Métodos para medir actividad enzimática, útiles para determinar la viabilidad celular en muestras no purificadas, del 24 de Julio de 2019, de Momentum Bioscience Limited: Un kit de ensayo para uso en un método para la detección de la actividad de la polimerasa como un indicador de la presencia de un microrganismo […]
Ensayo, del 25 de Marzo de 2019, de Dupont Nutrition Biosciences ApS: Un dispositivo de ensayo para detectar la enzima activa en una muestra, comprendiendo dicho dispositivo: (a) una región de colocación en la que puede […]
Clonación de alérgeno de abeja melífera, del 11 de Abril de 2018, de PLS-DESIGN GMBH: Ácido nucleico que codifica un polipéptido capaz de unirse a IgE de sujetos alérgicos al veneno de un insecto del orden Hymenoptera, en el que el […]
Inactivadores de sitio activo, del 13 de Diciembre de 2017, de UNIVERSITY OF GEORGIA RESEARCH FOUNDATION, INC.: Un método para identificar un inhibidor de enzima de corte peptídico que comprende: a. realizar un ensayo de sustrato de baja kcat poniendo en contacto […]
Métodos de medición de la actividad enzimática útiles para determinar la viabilidad celular en muestras no purificadas, del 4 de Octubre de 2017, de Momentum Bioscience Limited: Un método para detectar la presencia de un microorganismo en una muestra, donde se detecta la actividad de la polimerasa como indicador de la presencia de dicho microorganismo […]
Método y kit para medición de superalta sensibilidad de proteína y ácido nucleico, y nuevo sustrato enzimático, del 28 de Diciembre de 2016, de Miura, Toshiaki: Un metodo para someter a ensayo la actividad enzimatica usando un complejo anticuerpo-enzima, en el que se usa fosfatasa alcalina como la enzima […]
Mejora de inhibidores de fosfatasa conteniendo vanadio con polioles, del 29 de Junio de 2016, de F. HOFFMANN-LA ROCHE AG: Una composición líquida que comprende un disolvente acuoso, una enzima con actividad de fosfatasa, ortovanadato, manitol y ditiotreitol, caracterizada porque la concentración […]
Medio de detección de Streptococcus agalatiae utilizando la actividad esterasa, del 2 de Julio de 2014, de BIOMERIEUX: Medio de reacción que comprende (i) un sustrato enzimático de esterasa que el Streptococcus agalactiae no es capaz de utilizar en menos de 18h después de la inoculación, […]