PROCEDIMIENTO DE PURIFICACION DE VANCOMICINA.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/069414.
Solicitante: AXELLIA PHARMACEUTICALS APS.
Nacionalidad solicitante: Dinamarca.
Dirección: DALSLANDSGADE 11,2300 COPENHAGEN S.
Inventor/es: DE TOMMASO,VINCENZO.
Fecha de Publicación: .
Fecha Concesión Europea: 17 de Febrero de 2010.
Clasificación Internacional de Patentes:
- C07K9/00F2
Clasificación PCT:
- C07K1/34 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › por filtración, ultrafiltración u ósmosis inversa.
- C07K9/00 C07K […] › Péptidos de hasta 20 aminoácidos, que contienen radicales sacáridos y una secuencia totalmente determinada; Sus derivados.
Descripción:
Procedimiento de purificación de vancomicina.
La presente invención se refiere a un procedimiento para la purificación de antibióticos macrólidos. Más particularmente, se refiere a un procedimiento para la purificación de antibióticos macrólidos que da como resultado un polvo blanco. El polvo se mantiene blanco también tras cierto tiempo de almacenamiento.
Los antibióticos macrólidos presentan unas estructuras químicas de lactona macrocíclica, que son anillos de lactona de 12 a 22 átomos de carbono, a los cuales pueden unirse azúcares. Son bacteriostáticos y se ligan a los ribosomas de las bacterias para impedir la producción de proteínas.
Los antibióticos macrólidos comprenden vancomicina, teicoplanina, eritromicina, azitromicina, claritromicina, roxitromicina, josamicina, ristocetina, actinoidina, avoparcina, actaplanina, teicomicina y telitromicina.
La presente invención trata sobre la purificación de la vancomicina.
En la patente US nº 5.853.720, se da a conocer un procedimiento para la purificación de vancomicina, en el que, en la etapa de purificación, se utiliza cromatografía de preparación en columna de gel de sílice.
En el documento EP 132 117, se da a conocer un procedimiento para la purificación de antibióticos de la clase de la vancomicina en el que se emplea la cromatografía de afinidad, y en el que el antibiótico se liga a una matriz mediante la formación de un complejo de adsorción.
Estos procedimientos basados en la cromatografía producen un antibiótico de pureza incrementada, pero no producen un polvo de un color blanco satisfactorio. En el caso de la vancomicina, tras la purificación cromatográfica, el color inicial es rosa claro, pero tras cierto tiempo se convierte en parduzco, contraviniendo pues los requisitos de la Farmacopea Europea.
Se ha comprobado que sometiendo la vancomicina a ultrafiltración es posible eliminar las impurezas que causan una alta absorción a 450 nm.
La ultrafiltración es un procedimiento para la separación de moléculas de diferente tamaño. El peso molecular de la molécula desempeña, en realidad, el papel más importante en la ultrafiltración, aunque otros factores secundarios, tales como la forma y la carga eléctrica de la molécula, pueden desempeñar algún papel. En el mercado, se dispone de diferentes membranas de ultrafiltración, definidas por el peso molecular de las moléculas que son retenidas por la membrana. Las membranas que son útiles en la presente invención presentan un valor de retención inferior a 30.000 Da.
El procedimiento de la presente invención se realiza disolviendo el antibiótico vancomicina, por ejemplo el clorhidrato de vancomicina disponible en el mercado, en agua y sometiendo la solución a ultrafiltración con una membrana que presenta una retención nominal inferior a 30.000 Da, preferentemente igual o inferior a 15.000 Da y más preferentemente igual o inferior a 10.000 Da. Preferentemente, la membrana de ultrafiltración presenta una retención nominal superior a 6.000 Da. La solución purificada se concentra preferentemente mediante ósmosis inversa y a continuación se liofiliza en condiciones optimizadas de presión y temperatura hasta obtener un polvo blanco. Cuando se desea obtener un polvo estéril, es preferible hacer pasar la solución, tras concentración con ósmosis inversa, a través de un filtro de 0,22 micras y recoger el filtrado en un recipiente estéril (Clase A según las normas BPF europeas).
El tipo de membrana depende del antibiótico. En el caso de la vancomicina, mediante una membrana con un valor de retención de 30.000 Da, la vancomicina atraviesa la membrana, mientras que las impurezas permanecen en el retentado. Por el contrario, la purificación de la teicoplanina resulta eficaz cuando se usa una membrana de 10.000 Da. En este caso, las impurezas se hallan en el permeado y la teicoplanina en el retentado. De esta manera, para cada antibiótico es posible optimizar el tipo de membrana que permite obtener una separación óptima entre las impurezas y el antibiótico macrólido.
Cuando el antibiótico es vancomicina, el mismo está caracterizado porque presenta una absorción a 450 nm inferior a 0,100 y preferentemente inferior a 0,080.
El antibiótico macrólido se disuelve en agua y la concentración del antibiótico en la solución inicial está comprendida entre el 0,1 y el 30% en peso, preferentemente entre el 1 y el 20% en peso y más preferentemente entre el 3 y el 18% en peso.
Ejemplos
El clorhidrato de vancomicina utilizado en los ejemplos es un producto comercializado por Alpharma.
Las medidas de absorbancia a 450 nm se realizan de conformidad con la Monografía de la Vancomicina de la Farmacopea Europea.
Ejemplo 1 de purificación de clorhidrato de vancomicina
Se disuelven 65 g de clorhidrato de vancomicina comercializado por Alpharma en 500 ml de agua destilada. Tras la disolución completa del polvo, la solución se somete a ultrafiltración con una membrana de 10.000 Da, manteniendo una caída de presión de 1 bar entre el permeado y el retentado, mientras que la caída de presión transmembranal es de 2,5 bar. El permeado se concentra por medio de ósmosis inversa, se hace pasar a través de un filtro de 0,22 micras y se recoge en un recipiente de Clase A según las BPF europeas.
Ejemplo 2 de purificación de clorhidrato de vancomicina
Se disuelven 30 g de clorhidrato de vancomicina comercializado por Alpharma en 500 ml de agua destilada. Tras la disolución completa, la solución se somete a ultrafiltración con una membrana de 10.000 Da, manteniendo una caída de presión de 1 bar entre el permeado y el retentado, mientras que la caída de presión transmembranal es de 2,5 bar. El permeado se concentra por medio de ósmosis inversa, se hace pasar a través de un filtro de 0,22 micras y se recoge en un recipiente de Clase A según las normas BPF europeas.

Reivindicaciones:
1. Procedimiento para la purificación de la vancomicina realizado disolviendo el antibiótico macrólido en agua y sometiendo la solución a ultrafiltración con una membrana que presenta una retención nominal inferior a 30.000 Da.
2. Procedimiento según la reivindicación 1, en el que la membrana presenta una retención nominal igual o inferior a 10.000 Da.
3. Procedimiento según las reivindicaciones 1 y 2, en el que, tras la ultrafiltración, la solución purificada se concentra opcionalmente mediante ósmosis inversa y a continuación se liofiliza en condiciones optimizadas de presión y temperatura hasta obtener un polvo blanco.
4. Procedimiento según las reivindicaciones 1 a 3, en el que el polvo resultante presenta una absorción a 450 nm inferior a 0,100.
5. Procedimiento según las reivindicaciones 1 a 3, en el que el polvo resultante presenta una absorción a 450 nm inferior a 0,080.
Patentes similares o relacionadas:
 ANTIBIÓTICOS GLICOPEPTÍDICOS SUBSTANCIALMENTE PUROS AC-98-1, AC-98-2, AC-98-3, AC-98-4 Y AC-98-5, del 17 de Marzo de 2011, de WYETH HOLDINGS CORPORATION: Una composición farmacéutica que comprende un compuesto sustancialmente puro que tiene la estructura o una sal farmacéuticamente aceptable del mismo, en combinación […]
ANTIBIÓTICOS GLICOPEPTÍDICOS SUBSTANCIALMENTE PUROS AC-98-1, AC-98-2, AC-98-3, AC-98-4 Y AC-98-5, del 17 de Marzo de 2011, de WYETH HOLDINGS CORPORATION: Una composición farmacéutica que comprende un compuesto sustancialmente puro que tiene la estructura o una sal farmacéuticamente aceptable del mismo, en combinación […]
ANTIBIOTICOS GLUCOPEPTIDICOS, del 20 de Diciembre de 2010, de WYETH HOLDINGS CORPORATION: Un procedimiento de producción un compuesto de fórmula (I): o una sal farmacéuticamente aceptable del mismo; en la que: R 1 se selecciona entre: R 1a es H o halógeno; […]
ANTIBIOTICOS GLUCOPEPTIDICOS, del 11 de Junio de 2010, de WYETH HOLDINGS CORPORATION: Un compuesto de fórmula:
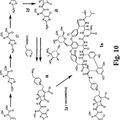 ANTIBIOTICOS DE GLUCOPEPTIDO-CEFALOSPORINA RETICULADOS, del 18 de Marzo de 2010, de THERAVANCE, INC.: Compuesto de fórmula I:
ANTIBIOTICOS DE GLUCOPEPTIDO-CEFALOSPORINA RETICULADOS, del 18 de Marzo de 2010, de THERAVANCE, INC.: Compuesto de fórmula I:
Compuestos de unión a la MAP cinasa p38, del 6 de Noviembre de 2019, de Blueberry Therapeutics Limited: Un compuesto de unión de la MAP cinasa p38α que comprende la secuencia de aminoácidos HKSRALLIFQKIMWLRRQ (SEQ ID NO: 1) o que comprende […]
Procedimiento de separación y purificación para el clorhidrato de vancomicina de alta pureza, del 7 de Agosto de 2019, de Zhejiang Medicine Co., Ltd. Xinchang Pharmaceutical Factory: Procedimiento de separación y purificación para clorhidrato de vancomicina con alta pureza, que comprende las siguientes etapas: obtener una solución de clorhidrato […]
Peptidoglicanos sintéticos que se unen al ácido hialurónico, preparación y métodos de uso, del 8 de Abril de 2019, de Symic IP, LLC: Un peptidoglicano sintético de unión a ácido hialurónico que comprende al menos un péptido sintético conjugado con un glicano en el que el péptido sintético comprende […]
Conjugados de azúcar-dipéptido como moléculas aromatizantes, del 19 de Marzo de 2019, de NESTEC S.A.: Compuesto de la fórmula general I,**Fórmula** en la cual R1 es hidrógeno, un grupo alquilo C1, C2, C3 o C4, o una sal de dicho compuesto.