METODO PARA OSCURECER EL RECONOCIMIENTO INMUNE.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US99/15465.
Solicitante: ENCELLE, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1800 N. GREENE STREET,GREENVILLE, NC 27858.
Inventor/es: KLANN,RICHARD,CHRIS, USALA,ANTON-LEWIS.
Fecha de Publicación: .
Fecha Concesión Europea: 25 de Noviembre de 2009.
Clasificación Internacional de Patentes:
- A61K9/00M5D
- A61L15/32 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 15/00 Aspectos químicos de vendas, apósitos o compresas absorbentes o utilización de materiales para su fabricación (para vendas líquidas A61L 26/00; apósitos radiactivos A61M 36/14). › Proteínas, polipéptidos; Sus productos de degradación o sus derivados, p. ej. albúmina, colágeno, fibrina, gelatina.
- A61L15/44 A61L 15/00 […] › Medicamentos.
- A61L27/22E
- A61L27/26 A61L […] › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › Mezclas de materiales macromoleculares.
- A61L27/38 A61L 27/00 […] › Células animales (para utilizar en piel artificial A61L 27/60).
- A61L27/52 A61L 27/00 […] › Hidrogeles o hidrocoloides.
- A61L27/54 A61L 27/00 […] › Materiales biológicamente activos, p. ej. sustancias terapéuticas.
Clasificación PCT:
- A61L33/00 A61L […] › Tratamiento antitrombogénico de artículos quirúrgicos, p. ej. de suturas, catéteres, prótesis o de artículos para la manipulación o el acondicionamiento de la sangre; Materiales para llevar a cabo dicho tratamiento.
Clasificación antigua:
- A61L33/00 A61L […] › Tratamiento antitrombogénico de artículos quirúrgicos, p. ej. de suturas, catéteres, prótesis o de artículos para la manipulación o el acondicionamiento de la sangre; Materiales para llevar a cabo dicho tratamiento.
Fragmento de la descripción:
Método para oscurecer el reconocimiento inmune.
Campo de la invención
La presente invención está dirigida a una matriz de hidrogel para la utilización en el oscurecimiento del reconocimiento inmune en un mamífero. Más particularmente, la presente invención está dirigida a una matriz de hidrogel para su uso en el encapsulamiento de un tejido.
Antecedentes de la invención
El cuerpo se defiende así mismo de los agentes infecciosos a través de una respuesta inmune. Hablando en sentido amplio, el cuerpo tiene muchas capas de defensas, incluyendo barreras físicas tales como la piel, sustancias químicas protectoras, los fluidos sanguíneo y de los tejidos y las reacciones fisiológicas de los tejidos a las heridas o infecciones. La estrategia de defensa más efectiva, sin embargo, es llevada a cabo por células que han desarrollado habilidades especializadas para reconocer y eliminar sustancias potencialmente nocivas.
La respuesta de un cuerpo a una infección ocurre en la forma de inflamación. Una respuesta inflamatoria involucra el paso de fluidos, proteínas, células de la sangre a áreas y tejidos focales. El resultado es la liberación local de agentes que pueden combatir efectivamente las infecciones. El proceso involucra a células inflamatorias, productos de células inflamatorias, proteínas sanguíneas, y caminos de respuesta. La iniciación de una respuesta inflamatoria comienza por un incremento en el flujo de sangre a los tejidos infectados y por la separación de células que recubren los vasos o capilares sanguíneos, seguida por la emigración de células hacia el tejido involucrado.
La respuesta inmune involucra tanto respuestas inmunes humorales como celulares. Ambas respuestas son componentes esenciales de la defensa contra las bacterias, virus, parásitos y otros objetos extraños patogénicos. La inmunidad celular es mediada por una clase de células de glóbulos blancos llamadas linfocitos. Estas células se originan a partir de células madre en la médula ósea y migran hacia la glándula del timo. Mientras que están en el timo, sufren diferenciación antes de migrar hacia los órganos linfoides periféricos. Las células procesadas en el timo son denominadas linfocitos T o células T. las células T pueden destruir células infectadas por diversos tipos de virus o bacterias intracelulares. La inmunidad humoral, o la respuesta humoral, es mediada por anticuerpos. Los anticuerpos son moléculas de proteínas sintetizadas por otra clase de linfocitos llamados células B. Las células B también se originan a partir de células madre en la médula ósea, pero no entran al timo. Las células B se encuentran en todo los órganos linfoides periféricos, y los anticuerpos que ellas secretan son encontrados a través de todo el cuerpo. La respuesta inmune es una secuencia compleja intricadamente regulada de eventos que involucran estos tipos de células. Se disparan cuando un antígeno, o un objeto extraño, entre al cuerpo.
Entre los principales obstáculos en la investigación dirigidos al trasplante de isletas pancreáticas para el tratamiento de la diabetes está una incapacidad para producir una aceptación permisiva de los trasplantes de tejidos xenoinjertados en el mamífero huésped. Los métodos actuales de trasplante deben suprimir la respuesta inmune por parte del mamífero huésped que pueda llevar al rechazo de las células trasplantadas y a la pérdida de la función de las isletas. Muchas modalidades de trasplante requieren que el huésped consuma agentes inmunosupresores generales para evitar que una respuesta inmune del huésped destruya el tejido trasplantado. Sin embargo, tales agentes inmunosupresores son deseables porque reducen la respuesta inmune del huésped en general, y así pueden llevar a una salud pobre. Así, hay una necesidad en la técnica para un método simple no invasivo para introducir un trasplante en un huésped sin requerir agentes inmunosupresores generales.
La WO 97/20569 divulga un dispositivo implantable para la liberación efectiva de entidades terapéuticamente deseables que incluyen hormonas, donde una matriz que contiene una unidad estructural celular que produce una entidad terapéuticamente deseable es encapsulada con un material polimérico no inmunogénico de poliparaxilileno u otra unidad estructural basada en estructuras aromáticas que tiene una porción membrana con una porosidad efectiva para bloquear el paso a través de la misma de agentes inmunogénicos a la vez que permite el paso a través de la misma de nutrientes de dicha unidad estructural celular y de la entidad producida por la misma.
La EP-A-0564786 divulga un método para procesar y preservar una matriz de tejido con base en colágeno no celular para trasplantes.
Resumen de la invención
La presente invención proporciona una matriz de hidrogel que comprende gelatina, dextrano y una cantidad efectiva de aminoácidos polares para su uso en el oscurecimiento de proteínas de la superficie celular de un trasplante encapsulado en la matriz frente a anticuerpos de alta afinidad de un huésped mamífero para inducir una aceptación permisiva del trasplante por parte del mamífero huésped. El reconocimiento inmune de un trasplante es oscurecido encapsulando el tejido del trasplante dentro de una matriz de hidrogel que comprende aminoácidos altamente polares y fragmentos de gelatina, tales como fragmentos de colágeno desnaturalizado, que tienen grupos polares expuestos. Los grupos polares expuestos de los fragmentos de colágeno y los aminoácidos polares posibilitan que la matriz se enlace a las proteínas de la superficie celular, oscureciendo por lo tanto las proteínas de la superficie celular, particularmente de anticuerpos específicos de alta afinidad del organismo huésped. Puesto que los anticuerpos de alta afinidad son incapaces de reconocer la estructura proteínica del tejido extraño, los anticuerpos son incapaces de estimular la respuesta inmune y destruir el trasplante. La presente invención es aún efectiva en el oscurecimiento del reconocimiento inmune de trasplantes xenoinjertados, tal como se alcanza la aceptación permisiva del trasplante xenográfico por parte del organismo huésped.
En particular, el método aquí descrito incluye proveer tejido para su uso adecuado en un trasplante, donde el tejido comprende células que contienen proteínas en la superficie celular. El tejido es encapsulado en la matriz de hidrogel para formar un trasplante, donde la matriz se enlaza a las proteínas de la superficie celular del tejido encapsulado. Después de esto, el trasplante así formado puede ser implantado en un sitio de trasplante en un mamífero. Por ejemplo, el trasplante puede ser implantado intramuscularmente, subcutáneamente, dentro de órganos, intravascularmente, o en la cavidad peritoneal.
En algunas realizaciones, el sitio del trasplante puede ser preparado antes de la implantación del trasplante antes descrito aplicando un medio regulador al sitio del trasplante, donde el medio regulador comprende al menos un inhibidor de óxido nítrico, tal como L-cisteína y aminoguanidina. Por ejemplo, la etapa de aplicación puede comprender inyectar aproximadamente 10 hasta aproximadamente 300 cc del medio regulador en el sitio del trasplante antes de la implantación. Periódicamente, después de la implantación del trasplante, pueden hacerse aplicaciones adicionales del medio regulador al sitio del trasplante.
Breve descripción de los dibujos
Habiendo así descrito la invención en términos generales, se hará referencia ahora a los dibujos acompañantes, donde:
La figura 1 es una gráfica de barras que ilustra los niveles de glucosa en ayuno y la dosis total de insulina para un perro después de una inyección intraperitoneal de un tejido pancreático porcino;
La figura 2 es una gráfica de barras que ilustra los niveles de glucosa en ayuno y una dosis total de insulina para un perro después de la inyección intramuscular de un tejido pancreático porcino; y
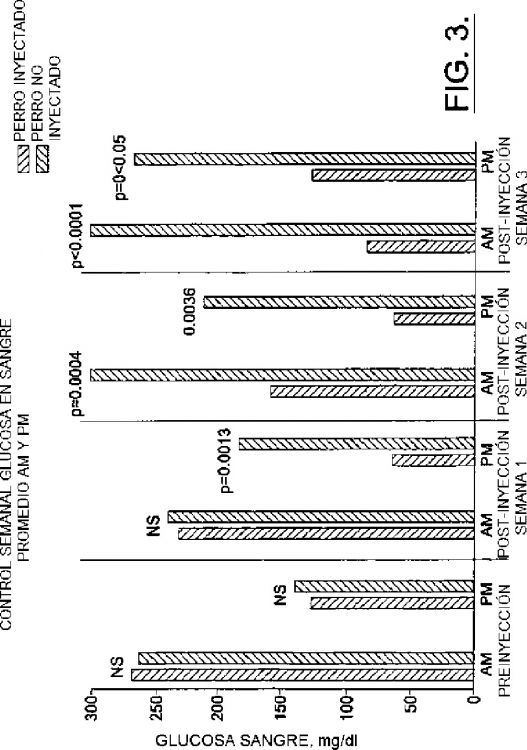
La figura 3 es una gráfica de barras que muestra la relación entre los niveles de glucosa en la sangre de dos perros.
Descripción detallada de la invención
La invención comprende una matriz de hidrogel útil para hacer y utilizar trasplantes. Se describen composiciones y métodos para mantener la viabilidad y la función celular dentro de un trasplante por largos periodos de tiempo. Específicamente, la invención proporciona una matriz de hidrogel para su uso en el oscurecimiento del reconocimiento inmune de un trasplante e inducir la aceptación permisiva del trasplante por un mamífero huésped. La...
Reivindicaciones:
1. Una matriz de hidrogel que comprende gelatina, dextrano y una cantidad efectiva de aminoácidos polares para su uso en el oscurecimiento de proteínas de la superficie celular de un trasplante encapsulado en la matriz de anticuerpos de alta afinidad del mamífero huésped para inducir aceptación permisiva del trasplante por parte del mamífero huésped.
2. Una matriz de hidrogel de acuerdo con la reivindicación 1donde la matriz va a ser aplicada al sitio de trasplante antes de la implantación del trasplante, y el trasplante va a ser encapsulado rodeando el trasplante con la matriz.
3. Una matriz de hidrogel de acuerdo con la reivindicación 1 donde el trasplante encapsulado en la matriz va a ser implantado sin el uso de un dispositivo portador protector adicional.
4. Una matriz de hidrogel de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde el trasplante es apropiado para implantación por inyección, en el huésped mamífero.
5. Una matriz de hidrogel de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde el sitio de trasplante en el mamífero huésped es intramuscular, subcutáneo, intraórganos, intravascular o en la cavidad peritoneal.
6. Una matriz de hidrogel de acuerdo con una cualquiera de las reivindicaciones precedentes, donde el trasplante comprende tejido, comprendiendo el tejido células que tienen proteínas de superficie celular.
7. Una matriz de hidrogel de acuerdo con la reivindicación 6, donde el tejido es encapsulado dentro de la matriz de hidrogel de manera tal que la matriz de hidrogel se enlaza a las proteínas de la superficie celular del tejido.
8. Una matriz de hidrogel de acuerdo con la reivindicación 6 o 7 donde el tejido comprende células seleccionadas de células de pulmón, células de hígado, células de riñón, células de timo, células de tiroides, células de corazón, células de cerebro, células isletas pancreáticas, células acinares pancreáticas y mezclas de las mismas.
9. Una matriz de hidrogel de acuerdo con una cualquiera de las reivindicaciones 6 a 8, donde el tejido es derivado de una especie diferente del mamífero huésped.
10. Una matriz de hidrogel de acuerdo con una cualquiera de las reivindicaciones precedentes, donde la gelatina comprende fragmentos de colágeno desnaturalizado, proveyendo los fragmentos de colágeno desnaturalizado grupos polares expuestos.
11. Una matriz de hidrogel de acuerdo con la reivindicación 10, donde la gelatina comprende de 0.01 a 40 mM de colágeno desnaturalizado.
12. Una matriz de hidrogel de acuerdo con una cualquiera de las reivindicaciones precedentes, donde los aminoácidos polares son seleccionados de arginina, lisina, histidina, ácido glutámico y ácido aspártico.
13. Una matriz de hidrogel de acuerdo con la reivindicación 12, donde los aminoácidos polares son seleccionados de arginina., ácido glutámico, lisina y mezclas de los mismos.
14. Una matriz de hidrogel de acuerdo con cualquiera de las reivindicaciones precedentes donde la cantidad efectiva de aminoácidos polares comprende de 3 a 150 mM de aminoácidos polares.
15. Una matriz de hidrogel de acuerdo con la reivindicación 14, donde la cantidad efectiva de aminoácidos polares comprende de 10 a 65 mM de aminoácidos polares.
16. Una matriz de hidrogel de acuerdo con una cualquiera de las reivindicaciones precedentes donde la cantidad efectiva de aminoácidos polares comprende:
de 2 a 60 mM de ácido L-glutámico; de 0.5 a 30 mM de L-lisina; y
de 1 a 40 mM de L-arginina.
17. Una matriz de hidrogel de acuerdo con la reivindicación 16, donde la cantidad efectiva de aminoácidos polares, comprende:
de 5 a 40 mM de ácido L-glutámico;
de 1 a 15 mM de L-lisina; y
de 1 a 30 mM de L-arginina.
18. Una matriz de hidrogel de acuerdo con una cualquiera de las reivindicaciones precedentes, la cual comprende adicionalmente de 5 a 500 µM de un inhibidor de óxido nítrico.
19. Una matriz de hidrogel de acuerdo con la reivindicación 18, donde el inhibidor de óxido nítrico es L-cisteína.
20. Una matriz de hidrogel de acuerdo con la reivindicación 18, donde el inhibidor de óxido nítrico comprende un análogo de L-arginina.
21. Una matriz de hidrogel de acuerdo con la reivindicación 20, donde el análogo de L-arginina comprende aminoguanidina.
22. Una matriz de hidrogel de acuerdo con una cualquiera de las reivindicaciones precedentes, donde un medio regulador que comprende al menos un inhibidor de óxido nítrico se va a aplicar al sitio de trasplante en el mamífero antes, o tanto antes como después, de implantar el trasplante.
23. Una matriz de hidrogel de acuerdo con la reivindicación 22, donde al menos un inhibidor de óxido nítrico del medio regulador comprende de 50 a 300 µM de L-cisteína y de 15 a 250 µM de un análogo de la L-arginina.
24. Una matriz de hidrogel de acuerdo con la reivindicación 22 o 23, donde de 0.01 a 0.3 L (10 a 300 cc) del medio regulador van a ser aplicados en el sitio del trasplante.
25. Una matriz de hidrogel de acuerdo con cualquiera de las reivindicaciones 22 a 24, donde el medio regulador va a ser aplicado al sitio de trasplante aproximadamente una vez al día desde los días 1 a 7 después de la implantación del trasplante.
Patentes similares o relacionadas:
Películas de proteína de múltiples capas, métodos de preparación y dispositivos de suministro de fármacos e implantes biomédicos que emplean las películas, del 15 de Julio de 2020, de AddBIO AB: Un implante biomédico que comprende un sustrato de implante y una película de proteína de múltiples capas en al menos una porción de la superficie del sustrato de implante, […]
Dispositivo médico que tiene un revestimiento que comprende ACCS, del 15 de Julio de 2020, de Noveome Biotherapeutics, Inc: Un dispositivo médico implantable que tiene un revestimiento en su superficie, útil para la implantación quirúrgica en el cuerpo de un sujeto, […]
Matriz de soporte de injerto para reparación de cartílago y procedimiento de obtención de la misma, del 1 de Julio de 2020, de ETH ZURICH: Un procedimiento de proporción de una matriz de soporte de injerto para reparación de cartílagos, particularmente en un paciente humano, que comprende las etapas de: […]
Composición de fármaco y revestimiento asociado, del 1 de Julio de 2020, de W.L. GORE & ASSOCIATES, INC.: Un producto sanitario para administrar un agente terapéutico a un tejido, y el producto tiene una capa de revestimiento aplicada en una superficie del producto, y la capa […]
Métodos y dispositivos para trasplante celular, del 10 de Junio de 2020, de Sernova Corporation: Un dispositivo para implantar células en un cuerpo huésped, que comprende: un andamio poroso que comprende al menos una cámara que tiene un extremo proximal y un extremo […]
Composiciones y métodos para el tratamiento de huecos óseos y fracturas abiertas, del 22 de Abril de 2020, de Polypid Ltd: Una composición farmacéutica que comprende partículas de relleno óseo recubiertas y no recubiertas en una proporción entre aproximadamente 1:3 […]
Procedimientos de preparación de un hidrogel esterilizado de modo terminal que proviene de matriz extracelular, del 22 de Abril de 2020, de UNIVERSITY OF PITTSBURGH OF THE COMMONWEALTH SYSTEM OF HIGHER EDUCATION: Un procedimiento de preparación de un material digerido de matriz extracelular esterilizado de modo terminal capaz de gelificar, que comprende: (i) solubilizar la matriz […]
Estructuras para trasplante celular, del 15 de Abril de 2020, de PRESIDENT AND FELLOWS OF HARVARD COLLEGE: Un dispositivo que comprende una composición de estructura que presenta macroporos abiertos e interconectados, y que es capaz de controlar en el tiempo […]