METODO MEJORADO PARA LA PRODUCCION Y PURIFICACION DE VECTORES ADENOVIRALES.
Procedimiento para preparar adenovirus recombinante, comprendiendo el procedimiento:
(a) preparar un cultivo de células productoras en un medio seleccionado;
(b) infectar las células productoras en el cultivo con adenovirus recombinante, en el que las células productoras se infectan entre la fase semilogarítmica de crecimiento y fase estacionaria de crecimiento; y
(c) recoger adenovirus recombinantes del cultivo celular
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US99/26966.
Solicitante: INTROGEN THERAPEUTICS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: SUITE 1850, 301 CONGRESS AVENUE,AUSTIN, TX 78701.
Inventor/es: ZHANG,SHUYUAN, THWIN,CAPUCINE, CHO,TOOHYON, WU,ZHENG, GALLAGHER,SHAWN.
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A61K35/76 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Virus; Partículas subvirales; Bacteriófagos.
- C07K14/47A32
- C12N15/861 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Vectores adenovirales.
- C12N7/02 C12N […] › C12N 7/00 Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00). › Aislamiento o purificación.
- C12N7/02C
Clasificación PCT:
Clasificación antigua:
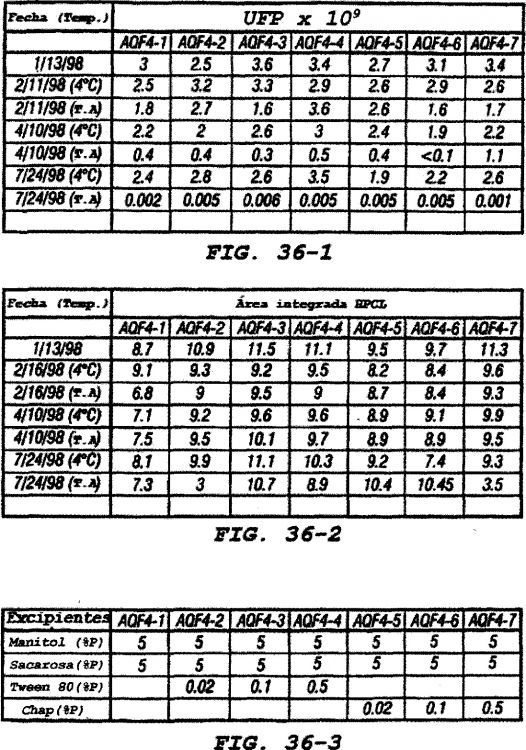
Fragmento de la descripción:
Método mejorado para la producción y purificación de vectores adenovirales.
1. Campo de la invención
La presente invención se refiere en general a los campos de cultivo celular y producción de virus. Más particularmente, se refiere a métodos mejorados para el cultivo de células de mamífero, la infección de esas células con adenovirus y la producción de partículas de adenovirus infecciosas a partir de las mismas.
2. Descripción de técnica relacionada
Actualmente están evaluándose en la práctica clínica vectores adenovirales, que llevan transgenes que pueden transcribirse y traducirse para expresar proteínas terapéuticas, para el tratamiento de una variedad de indicaciones de cáncer, incluyendo canceres de pulmón y de cabeza y cuello. A medida que avanzan los ensayos clínicos, la demanda de vectores adenovirales de calidad clínica está aumentando drásticamente. La demanda anual proyectada para un ensayo clínico de 300 pacientes puede alcanzar aproximadamente 1,08 x 1016 partículas virales.
Tradicionalmente, los adenovirus se producen en matraces de cultivo tisular, "factorías celulares" o RB disponibles comercialmente. Las células infectadas por virus se recogen y se someten a múltiple congelaciones-descongelaciones para liberar los virus de las células en forma de lisado celular sin procesar. El lisado celular sin procesar (CCL) producido se purifica entonces mediante múltiples etapas de ultracentrifugación en gradiente de CsCl. La producción de virus notificada normalmente a partir de 100 factorías celulares de una sola bandeja es de aproximadamente 1 x 104 partículas virales. Claramente, resulta inviable producir la cantidad requerida de virus usando este procedimiento tradicional. Deben desarrollarse nuevos procedimientos de purificación y producción escalables y que puedan validarse para satisfacer la demanda creciente.
El rendimiento de purificación de la ultracentrifugación en gradiente de CsCl es tan limitado que no puede satisfacer la demanda de vectores adenovirales para aplicaciones de terapia génica. Por tanto, con el fin de lograr la producción de vectores adenovirales a gran escala, deben desarrollarse métodos de purificación distintos de la ultracentrifugación en gradiente de CsCl. Las notificaciones sobre la purificación cromatográfica de los virus son muy limitadas, a pesar de la extensa aplicación de cromatografía para la purificación de proteínas recombinantes. Se han evaluado la cromatografía por exclusión de tamaño, de intercambio iónico y de afinidad para la purificación de retrovirus, virus de la encefalitis transmitido por garrapatas, y los virus de plantas con grados variables de éxito (Crooks, et al., 1990; Aboud, et al., 1982; McGrath et al., 1978, Smith y Lee, 1978; O'Neil y Balkovic, 1993). Se han realizado incluso menos investigaciones sobre la purificación cromatográfica de adenovirus. Esta falta de actividad de investigación puede ser parcialmente atribuible a la existencia del método de purificación por ultracentrifugación en gradiente de CsCl, eficaz, aunque no escalable, para adenovirus.
Huyghe et al. (1996) han notificado la purificación de vectores adenovirales usando cromatografía de intercambio iónico conjuntamente con cromatografía de afinidad de quelación de metales. Se notificó una pureza de virus similar a la de la ultracentrifugación en gradiente de CsCl. Desafortunadamente, sólo se recuperó el 23% de los virus tras el procedimiento de purificación en doble columna. Los factores del procedimiento que contribuyen a esta baja recuperación de virus son la etapa de congelación/descongelación utilizada por los autores para lisar células con el fin de liberar el virus de las células y el procedimiento de purificación en dos columnas.
El documento WO 98/22588 da a conocer un método mejorado para la producción y purificación de vectores adenovirales.
Claramente, existe una demanda de un método eficaz y escalable de producción de vectores adenovirales que dará como resultado una alta producción del producto para satisfacer la demanda creciente de tales productos. Recientemente, Blanche et al en el documento WO 98/00524 describen métodos de producción adenoviral que son útiles como técnica descriptiva. La publicación PCT n.º WO 98/00524 se cita específicamente en el presente documento por su descripción de técnicas para la producción y purificación de adenovirus recombinantes.
Sumario de la invención
La presente invención describe un nuevo procedimiento a gran escala para la producción y purificación de adenovirus. Este nuevo procedimiento de producción no sólo ofrece escalabilidad y capacidad de validación sino también una pureza de virus comparable con la lograda usando ultracentrifugación en gradiente de CsCl.
La presente invención se refiere a un procedimiento para preparar cantidades a gran escala de adenovirus. De hecho, se cree que pueden producirse cantidades muy grandes de partículas de adenovirus usando los procedimientos de la presente invención, cantidades de hasta aproximadamente 1 x 1018 partículas, y preferiblemente al menos aproximadamente 5 x 1014 partículas. Esto es sumamente deseable, ya que actualmente no existen técnicas disponibles para producir las cantidades muy grandes, comerciales de partículas de adenovirus requeridas para aplicaciones clínicas al alto nivel de pureza necesario.
En una realización, el procedimiento generalmente implica preparar un cultivo de células productoras sembrando células productoras en un medio de cultivo, infectar las células en el cultivo después que hayan alcanzado un crecimiento en fase semilogarítmica con un adenovirus seleccionado (por ejemplo, un adenovirus recombinante), y recoger las partículas de adenovirus del cultivo celular. Esto es porque los inventores sorprendentemente han descubierto que la producción máxima de virus se logra en las células productoras cuando se infectan en la parte final del crecimiento en fase logarítmica y antes del crecimiento estacionario. Preferiblemente, las partículas de adenovirus así obtenidas se someten entonces a técnicas de purificación o bien conocidas en la técnica o bien expuestas en el presente documento.
En ciertas realizaciones preferidas de la presente invención, por tanto, las células productoras se infectan con adenovirus en entre aproximadamente la fase semilogarítmica y la fase estacionaria de crecimiento. La fase logarítmica de la curva de crecimiento es donde las células alcanzan su máxima tasa de división celular (es decir, crecimiento). El término fase semilogarítmica de crecimiento se refiere al punto medio de transición de una curva de crecimiento logarítmico. El crecimiento en fase estacionaria se refiere al tiempo en una curva de crecimiento (es decir, una meseta) en el que el crecimiento celular y la muerte celular han llegado al equilibrio.
En realizaciones incluso más preferidas, las células productoras se infectan con el adenovirus durante o después de la fase logarítmica tardía de crecimiento y antes de la fase estacionaria. La fase logarítmica tardía se define como el crecimiento celular que se aproxima al final del crecimiento logarítmico, y antes de alcanzar la fase estacionaria de crecimiento. La fase logarítmica tardía normalmente puede identificarse en una curva de crecimiento como un punto secundario o terciario de inflexión que se produce a medida que se ralentiza la fase de crecimiento logarítmico, que se aproxima al crecimiento estacionario.
En una realización preferida de la presente invención, las células productoras se siembran en el medio de cultivo celular usando un conjunto esencialmente homogéneo de células. Los inventores han descubierto sorprendentemente que el uso de un conjunto homogéneo de células para sembrar puede proporcionar una confluencia y una densidad celular muy mejoradas así como una mejor maduración del virus, lo que a su vez proporciona mayores cantidades de producción y pureza final del virus recuperado. En efecto, la siembra a través del uso de poblaciones celulares independientes en lugar de homogéneas, por ejemplo, a partir de dispositivos de cultivo celular individuales usados en la fase de expansión celular, puede dar como resultado una densidad celular irregular, y por tanto, niveles de confluencia irregulares en el momento de la infección. Se cree que el uso de un conjunto homogéneo de células para la siembra supera estos problemas.
En otra realización preferida de la presente invención, el medio de cultivo...
Reivindicaciones:
1. Procedimiento para preparar adenovirus recombinante, comprendiendo el procedimiento:
2. Procedimiento según la reivindicación 1, en el que se infectan las células productoras con el adenovirus entre la fase logarítmica tardía de crecimiento y la fase estacionaria de crecimiento.
3. Procedimiento según la reivindicación 1, en el que se siembran las células productoras usando un conjunto esencialmente homogéneo de células.
4. Procedimiento según la reivindicación 1, en el que el cultivo de las células productoras incluye perfusión.
5. Procedimiento según la reivindicación 4, en el que las células productoras se perfunden a una tasa que mantendrá un nivel de glucosa de entre 0,5 y 3,0 g de glucosa/litro, en particular entre 0,7 y 2,0 g de glucosa/litro, y más en particular entre 1 a 1,5 g de glucosa/litro.
6. Procedimiento según la reivindicación 1, en el que las células productoras se siembran en el medio de cultivo y se permite que se adhieran a una superficie de cultivo durante entre 3 horas y 24 horas antes de iniciar la recirculación de los medios.
7. Procedimiento según la reivindicación 1, en el que la etapa de infección adenoviral incluye la recirculación del medio de cultivo.
8. Procedimiento según la reivindicación 1, en el que se siembra el cultivo con entre 0,5 x 104 y 3 x 104 células/cm2, en particular entre 7,5 x 103 y 2,0 x 104 células/cm2, y más en particular entre 9 x 103 y 1,5 x 104 células/cm2.
9. Procedimiento según la reivindicación 1, en el que se somete el adenovirus recogido a purificación y se coloca en una composición farmacéuticamente aceptable.
10. Procedimiento según la reivindicación 9, en el que el adenovirus se purifica mediante etapas que incluyen cromatografía.
11. Procedimiento según la reivindicación 10, en el que la etapa de cromatografía implica someter el adenovirus a más de una separación cromatográfica, o en el que la etapa de cromatografía implica someter el adenovirus a sólo una separación cromatográfica, en particular en el que la separación cromatográfica incluye cromatografía de intercambio iónico.
12. Procedimiento según la reivindicación 1, en el que dicho adenovirus recombinante es un adenovirus de replicación deficiente que codifica para un gen terapéutico ligado operativamente a un promotor
13. Procedimiento según la reivindicación 12, en el que dicho adenovirus de replicación deficiente carece de al menos una parte de la región E1, en particular en el que dichas células productoras complementan la parte de la región E1 que falta.
14. Procedimiento según la reivindicación 1, en el que dichas células productoras se seleccionan del grupo que consiste en células 293, PER.C6, 911 e IT293SF, en particular en el que dichas células productoras son células 293.
15. Procedimiento según la reivindicación 12, en el que dicho gen terapéutico se selecciona del grupo que consiste en ras antisentido, myc antisentido, raf antisentido, erb antisentido, src antisentido, fms antisentido, jun antisentido, trk antisentido, ret antisentido, gsp antisentido, hst antisentido, bcl antisentido, abl antisentido, Rb, CFTR, p16, p21, p27, p57, p73, C-CAM, APC, CTS-1, zac1, scFV ras, DCC, NF-1, NF-2, WT-1, MEN-I, MEN-II, BRCA1, VHL, MMAC1, FCC, MCC, BRCA2, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, GM-CSF, G-CSF, mda-7, timidina quinasa o p53, en particular en el que dicho gen terapéutico es un gen p53.
16. Procedimiento según la reivindicación 12, en el que dicho promotor es un promotor SV40-IE, VRS-LTR, de ß-actina, CMV-IE, tardío principal de adenovirus, de polioma F9-1 o de tirosinasa.
17. Procedimiento según la reivindicación 1, en el que el adenovirus se recoge mediante etapas que incluyen lisar las células productoras por medios distintos de congelación-descongelación, en particular en el que las células productoras se lisan por medio de una lisis con detergente, o en el que las células productoras se lisan por medio de lisis de adenovirus.
18. Procedimiento según la reivindicación 1, que comprende además purificar el adenovirus recogido para obtener una composición de adenovirus recombinante purificado que tiene uno o más de las siguientes propiedades:
Patentes similares o relacionadas:
Arenavirus trisegmentados como vectores de vacunas, del 22 de Julio de 2020, de UNIVERSITE DE GENEVE: Una partícula de arenavirus trisegmentada infecciosa y competente para la replicación que comprende un segmento L y dos segmentos S, en donde uno de los dos segmentos […]
Composiciones que comprenden cócteles de fagos antibacterianos y usos de las mismas para el tratamiento de infecciones bacterianas, del 24 de Junio de 2020, de Tecnifar-Indústria Técnica Farmacêutica, S.A: Una composicion que comprende: una primera y una segunda cepa purificada de bacteriofago, cada una de dichas cepas que tiene un genoma que comprende […]
Métodos y composiciones para la producción de virus vaccina, del 10 de Junio de 2020, de SillaJen Biotherapeutics, Inc: Un metodo para producir un virus vaccinia de la cepa Wyeth o Western Reserve que comprende: (a) infectar las celulas HeLa adheridas a una superficie […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
 Recubrimientos a nanoescala para la encapsulación de entidades biológicas, del 25 de Marzo de 2020, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un procedimiento para producir un dispositivo de suministro de carga útil bioactiva, que comprende:
formar una estructura intermedia mediante la unión de un material […]
Recubrimientos a nanoescala para la encapsulación de entidades biológicas, del 25 de Marzo de 2020, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un procedimiento para producir un dispositivo de suministro de carga útil bioactiva, que comprende:
formar una estructura intermedia mediante la unión de un material […]
Nuevo bacteriófago y composición que comprende el mismo, del 25 de Marzo de 2020, de CJ CHEILJEDANG CORPORATION: Un bacteriófago ΦCJ25 (KCCM11463P) que tiene una capacidad específica para matar Escherichia coli patógena aviar.
Nuevo bacteriófago y composición que comprende el mismo, del 25 de Marzo de 2020, de CJ CHEILJEDANG CORPORATION: Un bacteriófago ΦCJ26 (KCCM11464P) que tiene una capacidad específica para matar Salmonella. Una composición que comprende el bacteriófago ΦCJ26 (KCCM11464P) según […]
Nuevo bacteriófago y composición que comprende al mismo, del 25 de Marzo de 2020, de CJ CHEILJEDANG CORPORATION: Un bacteriófago ΦCJ24 (KCCM11462P) que tiene una capacidad específica para eliminar la Escherichia coli patogénica aviar.