FORMAS CRISTALINAS DE DULOXETINA COMO BASE LIBRE.
Duloxetina como base libre en forma cristalina
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2005/001825.
Solicitante: CIPLA LTD..
Nacionalidad solicitante: India.
Dirección: 289, BELASIS ROAD, MUMBAI CENTRAL,MUMBAI 400 008.
Inventor/es: KANKAN, RAJENDRA, NARAYANRAO, RAO, DHARMARAJ, RAMACHANDRA, SRINIVAS,PATHI L, RAVIKUMAR,PUPPALA.
Fecha de Publicación: .
Fecha Concesión Europea: 10 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C07D333/20 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 333/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen un átomo de azufre como único heteroátomo del ciclo. › por átomos de nitrógeno (radicales nitro, nitroso C07D 333/12).
Clasificación PCT:
- A61K31/381 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo ciclos de cinco eslabones.
- A61P25/24 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › Antidepresivos.
- C07D333/20 C07D 333/00 […] › por átomos de nitrógeno (radicales nitro, nitroso C07D 333/12).
Clasificación antigua:
- A61K31/381 A61K 31/00 […] › teniendo ciclos de cinco eslabones.
- A61P25/24 A61P 25/00 […] › Antidepresivos.
- C07D333/20 C07D 333/00 […] › por átomos de nitrógeno (radicales nitro, nitroso C07D 333/12).
Fragmento de la descripción:
Formas cristalinas de duloxetina como base libre.
La presente invención se refiere a duloxetina como base libre en forma cristalina y también a nuevas formas polimórficas de la misma.
La duloxetina, N-metil-3-(1-naftaleniloxi)-3-(2-tienil)propanamina, es un inhibidor doble de la recaptación de serotonina y norepinefrina. La (+)duloxetina tiene una utilidad terapéutica particular como anti-depresivo.
La duloxetina y la preparación de la misma se describen en las Patentes de Estados Unidos 5023269 y 4956388 y también en Tetrahedron Letters, 31, (49), 7101-04, 1990. Se han presentado también siete rutas de síntesis diferentes en Drugs of the Future 2000, 25 (9) 907-916. Estas síntesis han implicado una resolución de un intermedio clave o una reducción estereoespecífica de un grupo ceto a alcohol.
El aislamiento de la duloxetina como base libre en forma cristalina, sin embargo, no se ha conseguido por ninguno de los procesos descritos en la bibliografía y patentes indicadas.
Se proporciona ahora mediante la presente invención, sin embargo, duloxetina como base libre en forma cristalina.
La presente invención proporciona adicionalmente procesos para preparar tres formas polimórficas diferentes de duloxetina, designadas en este documento Formas A, B y C, respectivamente, y estas tres formas polimórficas representan otras realizaciones de la presente invención. Como se usa en este documento, el término "duloxetina" designa preferiblemente (+) duloxetina.
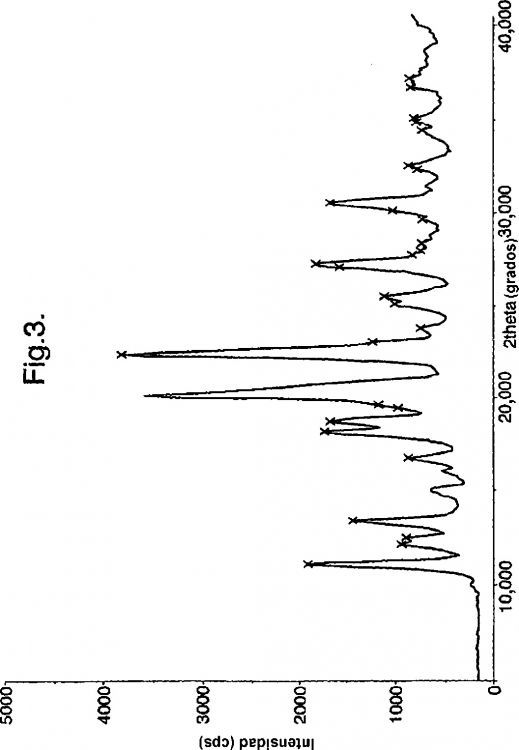
De acuerdo con la presente invención, se proporciona la Forma A de duloxetina cristalina como base libre, que tiene un patrón de difracción de rayos X, o sustancialmente el mismo patrón de difracción de rayos X, mostrado en la Figura 1. Más particularmente, la Forma A de duloxetina cristalina como base libre de acuerdo con la presente invención puede caracterizarse por tener un patrón de difracción de rayos X con picos característicos (2?): 9,70, 10,88, 13,03, 15,61, 19,19, 19,55, 19,88, 21,94, 22,16, 26,95 y 27,76º.
Otros datos caracterizantes de la Forma A de duloxetina cristalina como base libre de acuerdo con la presente invención según se obtienen por difracción de rayos X se muestran en la siguiente tabla 1.
(Tabla pasa a página siguiente)
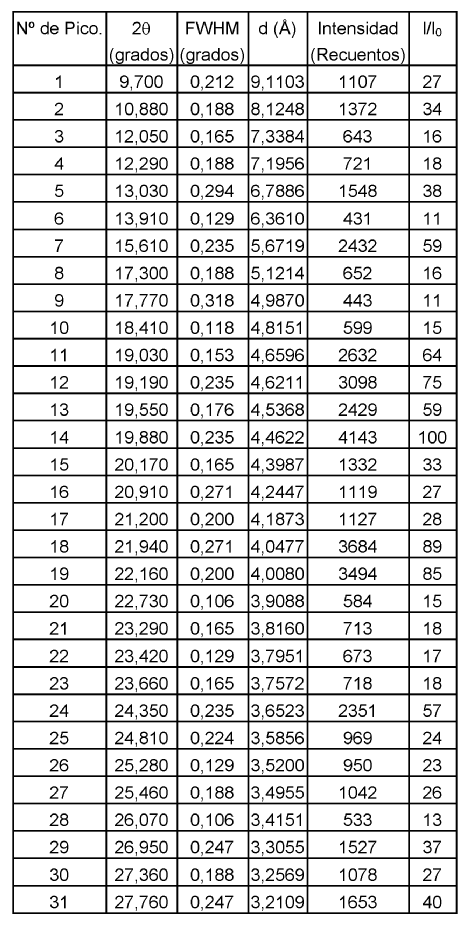
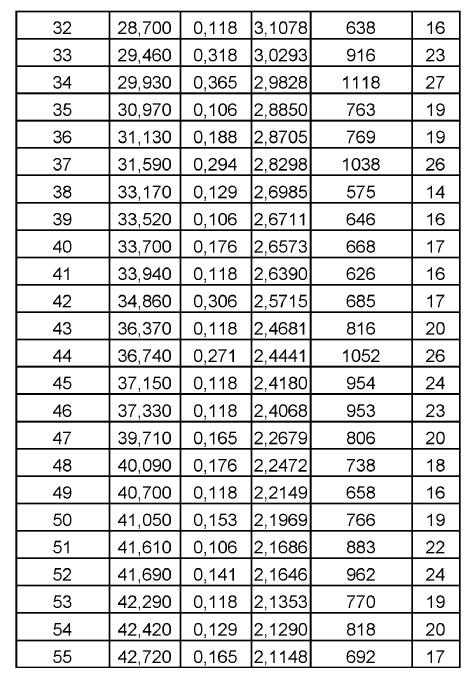
De acuerdo con la presente invención, se proporciona la Forma B de duloxetina cristalina como base libre, que tiene un patrón de difracción de rayos X, o el miso patrón de difracción de rayos X, mostrado en la Figura 2. Más particularmente, la forma B de duloxetina cristalina como base libre de acuerdo con la presente invención puede caracterizarse por tener un patrón de difracción de rayos X con picos característicos (2?): 4,98, 9,96, 11,18, 12,58, 15,32, 18,98, 20,04, 20,62, 22,32, 22,44,27,28 y 30,30º.
Otros datos caracterizantes para la forma B de duloxetina cristalina como base libre de acuerdo con la presente invención según se obtienen por difracción de rayos X se muestran en la siguiente tabla 2.
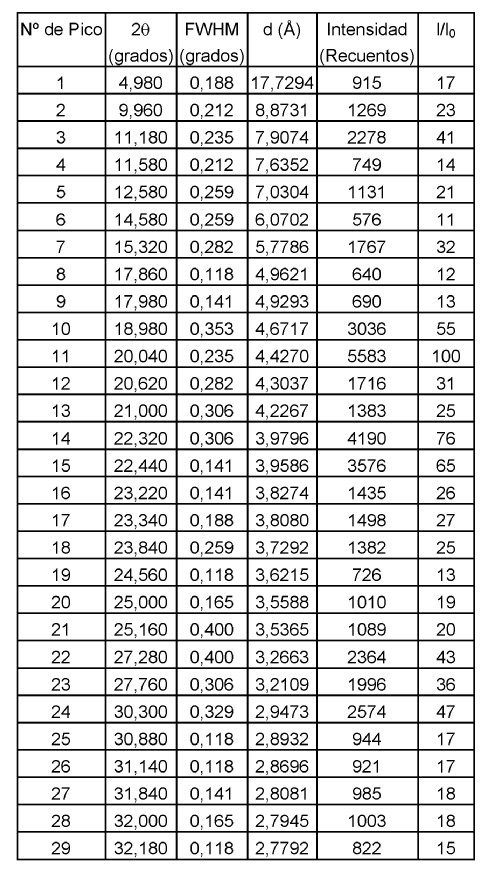
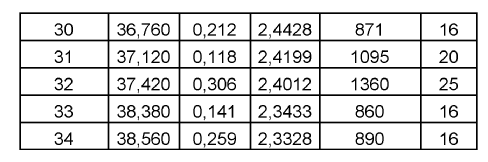
De acuerdo con la presente invención, se proporciona la Forma C de duloxetina cristalina como base libre, que tiene un patrón de difracción de rayos X, o el mismo patrón de difracción de rayos X, como se muestra en la Figura 3. Más particularmente, la Forma C de duloxetina cristalina como base libre de acuerdo con la presente invención puede caracterizarse por tener un patrón de difracción de rayos X con picos característicos (2?): 12,23, 13,49, 16,90, 18,28, 20,37, 22,61, 27,22, 27,40 y 30,65º.
Otros datos caracterizantes para la Forma C de duloxetina cristalina como base libre de acuerdo con la presente invención según se obtienen por difracción de rayos X se muestran en la siguiente tabla 3.
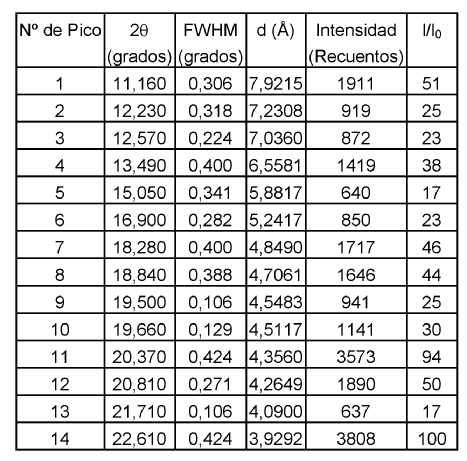
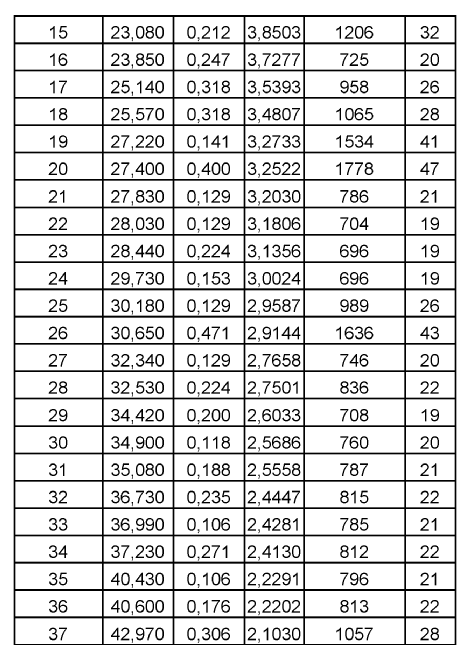
Mediante la presente invención se proporciona también una sal de duloxetina farmacéuticamente aceptable, sal farmacéuticamente aceptable que se preparara a partir de duloxetina como base libre en forma cristalina como se proporciona mediante la presente invención. Las sales de duloxetina farmacéuticamente aceptables preferidas como se proporcionan mediante la presente invención incluyen clorhidrato de duloxetina y oxalato de duloxetina, especialmente clorhidrato de duloxetina.
Una sal de duloxetina farmacéuticamente aceptable como se proporciona mediante la presente invención es preferible al menos aproximadamente un 99,5% p/p pura.
La duloxetina cristalina como base libre como se proporciona mediante la presente invención puede preparase a su vez a partir de sales de duloxetina, tales como la sal oxalato, la sal clorhidrato, la sal di-p-toluil tartrato o cualquier otra sal adecuada. De acuerdo con la presente invención, se proporciona adicionalmente un proceso de preparación de duloxetina cristalina como base libre, proceso que comprende disolver o suspender una sal de duloxetina en un medio adecuado, que comprende agua, neutralizar con una base adecuada, tal como un hidróxido de metal alcalino, típicamente hidróxido sódico, extraer la duloxetina como base libre formada de esta manera en un disolvente adecuado, sustituir del disolvente por un no disolvente y, de esta manera, aislar la duloxetina como base libre en forma cristalina.
También es posible interconvertir distintas formas polimórficas de duloxetina cristalina como base libre como se proporciona mediante la presente invención. Por lo tanto, en este documento se describe un proceso de interconversión, con lo que una segunda forma polimórfica de duloxetina cristalina como base libre se prepara a partir de una primera forma polimórfica distinta de duloxetina cristalina como base libre. Adecuadamente, la primera forma polimórfica de duloxetina cristalina como base libre que se emplea como el material de partida se disuelve o suspende en un disolvente de alcohol inferior adecuado, preferiblemente metanol, y la segunda forma polimórfica se recristaliza en el mismo. Preferiblemente, este proceso de interconversión se emplea para la preparación de duloxetina cristalina como base libre de la Forma B a la Forma A, como se describe posteriormente en este documento con más detalle.
La preparación de duloxetina cristalina como base libre de acuerdo con la presente invención es ventajosa en que la duloxetina cristalina como base libre puede emplearse como un intermedio útil en la preparación de sales farmacéuticamente aceptables muy puras de duloxetina, en particular oxalato o clorhidrato de duloxetina. Las sales de duloxetina farmacéuticamente aceptables preparadas a partir de duloxetina cristalina como base libre pueden presentar propiedades beneficiosas, por ejemplo, el clorhidrato de duloxetina preparado a partir de duloxetina cristalina como base libre como se proporciona mediante la presente invención es más resistente a la degradación que el clorhidrato de duloxetina preparado por métodos convencionales conocidos en la técnica anterior.
De acuerdo con la presente invención se proporciona adicionalmente un proceso para preparar la Forma A de duloxetina cristalina como base libre, proceso que comprende suspender o disolver la sal de duloxetina, tal como la sal clorhidrato o di-p-toluil tartrato de duloxetina, en agua, neutralizarla con una base, tal como un hidróxido de metal alcalino, típicamente hidróxido sódico, extraerla en un disolvente inmiscible en agua, tal como diclorometano, concentrar el disolvente inmiscible en agua, sustituir el disolvente inmiscible en agua por acetona y, de esta manera, aislar la Forma A de duloxetina como base libre en forma cristalina. La Forma A de duloxetina cristalina como base libre se caracteriza por difracción de rayos X en polvo como se muestra en la Figura 1.
De acuerdo con la presente invención se proporciona adicionalmente un proceso de preparación de la Forma B de duloxetina cristalina como base libre, proceso que comprende...
Reivindicaciones:
1. Duloxetina como base libre en forma cristalina.
2. Forma A de duloxetina cristalina como base libre, de acuerdo con la invención, que tiene un patrón de difracción de rayos X como se muestra en la Figura 1.
3. Forma A de duloxetina cristalina como base libre de acuerdo con la reivindicación 1, caracterizada por tener un patrón de difracción de rayos X con picos característicos (2?): 9,70, 10,88, 13,03, 15,61, 19,19, 19,55, 19,88, 21,94, 22,16, 26,95 y 27,76º.
4. Forma B de duloxetina cristalina como base libre de acuerdo con la reivindicación 1, que tiene un patrón de difracción de rayos X como se muestra en la Figura 2.
5. Forma B de duloxetina cristalina como base libre de acuerdo con la reivindicación 1, caracterizada por tener un patrón de difracción de rayos X con picos característicos (2?): 4,98, 9,96, 11,18, 12,58, 15,32, 18,98, 20,04, 20,62, 22,32, 22,44, 27,28 y 30,30º.
6. Forma C de duloxetina cristalina como base libre de acuerdo con la reivindicación 1, que tiene un patrón de difracción de rayos X como se muestra en la Figura 3.
7. Forma C de duloxetina cristalina como base libre de acuerdo con la reivindicación 1, caracterizada por tener un patrón de difracción de rayos X con picos característicos (2?): 12,23, 13,49, 16,90, 18,28, 20,37, 22,61, 27,22, 27,40 y 30,65º.
8. Un proceso de preparación de duloxetina cristalina como base libre de acuerdo con cualquiera de las reivindicaciones 1 a 7, proceso que comprende disolver o suspender una sal de duloxetina en un medio adecuado que comprende agua, neutralizar con una base adecuada, extraer la duloxetina como base libre formada de esta manera en un disolvente adecuado, sustituir el disolvente por un no disolvente y, de esta manera, aislar la duloxetina como base libre en forma cristalina.
9. Un proceso de acuerdo con la reivindicación 8, en el que la duloxetina cristalina como base libre se define en cualquiera de las reivindicaciones 1 a 7, a partir de una sal de duloxetina.
10. Un proceso de acuerdo con la reivindicación 9, en el que la sal se selecciona entre el grupo que consiste en oxalato de duloxetina, clorhidrato de duloxetina y di-p-toluil tartrato de duloxetina.
11. Un proceso de acuerdo con la reivindicación 8, 9 ó 10, en el que dicha base comprende un hidróxido de metal alcalino.
12. Un proceso de acuerdo con la reivindicación 11, en el que dicho hidróxido de metal alcalino es hidróxido sódico.
13. Un proceso de preparación de la Forma A de duloxetina cristalina como base libre de acuerdo con la reivindicación 2 ó 3, proceso que comprende suspender o disolver una sal de duloxetina en agua, neutralizar con una base, extraerla en un disolvente inmiscible en agua, concentrar el disolvente inmiscible en agua, sustituir el disolvente inmiscible en agua con acetona y, de esta manera, aislar la Forma A de duloxetina como base libre en forma cristalina.
14. Un proceso de acuerdo con la reivindicación13 en el que dicha sal de duloxetina es clorhidrato de duloxetina o di-p-toluil tartrato de duloxetina.
15. Un proceso de acuerdo con la reivindicación 13 ó 14, en el que dicha base es un hidróxido de metal alcalino.
16. Un proceso de acuerdo con la reivindicación 15, en el que dicho hidróxido de metal alcalino es hidróxido sódico.
17. Un proceso de acuerdo con cualquiera de las reivindicaciones 13 a 16, en el que dicho disolvente inmiscible en agua es diclorometano.
18. Un proceso de preparación de la Forma B de duloxetina cristalina como base libre de acuerdo con la reivindicación 4 ó 5, proceso que comprende disolver o suspender la Forma A de duloxetina como base libre en metanol y recristalizar la Forma B de duloxetina como base libre en el mismo.
19. Un proceso de preparación de la Forma C de duloxetina cristalina como base libre de acuerdo con la reivindicación 6 ó 7, proceso que comprende suspender o disolver una sal de duloxetina en agua, neutralizar con una base, extraer en un disolvente inmiscible en agua, concentrar el disolvente inmiscible en agua, sustituir el disolvente inmiscible en agua por isopropanol y, de esta manera, aislar la forma de duloxetina como base libre en forma cristalina.
20. Un proceso de acuerdo con la reivindicación 19, en el que dicha sal de duloxetina es clorhidrato de duloxetina o di-p-toluil tartrato de duloxetina.
21. Un proceso de acuerdo con la reivindicación 19 ó 20, en el que dicha base es un hidróxido de metal alcalino.
22. Un proceso de acuerdo con la reivindicación 21, en el que dicho hidróxido de metal alcalino es hidróxido sódico.
23. Un proceso de acuerdo con cualquiera de las reivindicaciones 19 a 22, en el que dicho disolvente inmiscible en agua es diclorometano.
24. Un proceso de preparación de una sal de duloxetina farmacéuticamente aceptable, proceso que comprende disolver o suspender la duloxetina cristalina como base libre de acuerdo con cualquiera de las reivindicaciones 1 a 7 en un disolvente inmiscible en agua, añadir un ácido farmacéuticamente aceptable a la misma requerido para formar la sal farmacéuticamente aceptable y aislar la sal farmacéuticamente aceptable requerida de duloxetina en forma cristalina.
25. Un proceso de acuerdo con la reivindicación 24, en el que dicha duloxetina cristalina como base libre es la Forma A.
26. Un proceso de acuerdo con la reivindicación 24, en el que dicha duloxetina cristalina como base libre es la Forma B.
27. Un proceso de acuerdo con la reivindicación 24, en el que dicha duloxetina cristalina como base libre es la Forma C.
28. Un proceso de acuerdo con cualquiera de las reivindicaciones 24 a 27, en el que dicho disolvente miscible en agua es acetona.
29. Un proceso de acuerdo con cualquiera de las reivindicaciones 24 a 28, en el que dicha sal es oxalato de duloxetina.
30. Un proceso de acuerdo con cualquiera de las reivindicaciones 24 a 29, en que dicha sal es clorhidrato de duloxetina.
31. Una formulación farmacéuticamente aceptable para administrar a un paciente, incluyendo seres humanos, que padecen o son susceptibles de padecer una patología que puede prevenirse, mejorarse o eliminarse mediante al administración de un inhibidor de la recaptación de serotonina y/o norepinefrina, formulación que comprende una cantidad terapéuticamente eficaz de duloxetina cristalina como base libre de acuerdo con cualquiera de las reivindicaciones 1 a 7, junto con un vehículo, diluyente o excipiente farmacéuticamente aceptable para la misma.
32. Duloxetina cristalina como base libre de acuerdo con cualquiera de las reivindicaciones 1 a 7, para usar en terapia.
33. Duloxetina cristalina como base libre de acuerdo con cualquiera de las reivindicaciones 1 a 7, para usar en la fabricación de un medicamento para el tratamiento de una patología que puede evitarse, mejorarse o eliminarse mediante la administración de un inhibidor de la recaptación de serotonina y/o norepinefrina.
34. Duloxetina cristalina como base libre de acuerdo con cualquiera de las reivindicaciones 1 a 7, para usar en la fabricación de un medicamento para el tratamiento de la depresión.
Patentes similares o relacionadas:
Acilguanidinas para el tratamiento de la artrosis, del 22 de Enero de 2020, de MERCK PATENT GMBH: Compuestos de la formula I **(Ver fórmula)** en la que R1, R2, R3 se escogen, independientemente entre si, del grupo formado por H, un grupo alquilo, alquenilo […]
Compuestos para el tratamiento de infecciones víricas por paramixovirus, del 15 de Enero de 2020, de Janssen BioPharma, Inc: Un compuesto de Fórmula (Ic), o su sal farmacéuticamente aceptable, que tiene la estructura: **(Ver fórmula)** en donde: X1, X2 y X3 son cada uno […]
Compuestos de sulfonamida y su uso como inhibidores de stat5, del 2 de Octubre de 2019, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un compuesto de fórmula **(Ver fórmula)** en donde R1 es -(Ch2)n-arilo (C6-C10) o -C(=O)-(CH2)n-arilo (C6-C10), en donde los grupos arilo están opcionalmente […]
Ligandos novedosos del receptor de estrógenos, del 17 de Julio de 2019, de Karo Pharma AB: Compuesto de fórmula (I) o un éster, una amida, un carbamato o una sal farmacéuticamente aceptable del mismo, que incluye una sal de tal […]
Moduladores de SHIP1, del 8 de Mayo de 2019, de Aquinox Pharmaceuticals (Canada) Inc: Un compuesto de fórmula (I):**Fórmula** en la que: R1 es -R8-OR9, -R8-N(R9)2, -R8-O-R10-OR9, -R8-O-R10-N(R9)2, -R8-N(R9)-R10-OR9, […]
Inhibidores de FBXO3, del 24 de Abril de 2019, de UNIVERSITY OF PITTSBURGH OF THE COMMONWEALTH SYSTEM OF HIGHER EDUCATION: Un compuesto, o una sal o éster farmacéuticamente aceptable del mismo, que tiene la estructura de fórmula II:**Fórmula** en el que X es un alcanodiilo […]
Derivado de ácido 4-aminometilbenzoico, del 20 de Marzo de 2019, de TOA EIYO LTD.: Un compuesto representado por la fórmula general :**Fórmula** una sal farmacéuticamente aceptable del mismo o un solvato del mismo; en donde Ar representa […]
Compuestos herbicidas, del 12 de Marzo de 2019, de SYNGENTA PARTICIPATIONS AG: Un compuesto de fórmula (I):**Fórmula** donde: R1 se selecciona del grupo que consiste en metilo, etilo, n-propilo, ciclopropilo, trifluorometilo, […]